新型4–羟基喹啉衍生物的合成
2015-12-20张向阳康秀芝申有名张春香
张向阳, 康秀芝, 申有名, 张春香
新型4–羟基喹啉衍生物的合成
张向阳, 康秀芝, 申有名, 张春香
(湖南文理学院化学化工学院, 湖南常德, 415000)
以米食酸、原甲酸三甲酯、苯胺类化合物和氯甲酸苄酯为原料, 通过2条合成路线, 以中等的收率制备了3种结构新颖的4–羟基喹啉衍生物, 并利用核磁共振谱图对目标化合物进行了表征。另外, 考察了取代基对目标化合物合成的影响, 只有氨基的邻位有取代基时, 才能制备所设计的目标化合物。
喹啉衍生物; 环化反应; 结构互变; 新合成方法
喹啉类衍生物是一类重要的杂环化合物, 被广泛应用于香料、染料和医药工业等领域[1–2]。目前, 天然的喹啉类化合物远远不能满足上述行业的需求。因此, 喹啉类衍生物的合成研究一直受到有机化学家和药物化学家的重视。近年来, 已有多种合成喹啉类衍生物方法的报道, 但是结构新颖的喹啉衍生物的合成方法仍然需要进一步探索[3–4]。
由于喹啉类化合物具有广泛的生物活性, 加之其具有低毒、高效、对环境友好、结构变化多样等特点, 已成为当今新农药研究的杂环结构之一[5–6]。例如, 苯氧喹啉能高效地防治多种农作物的白粉病; 二氯喹啉酸是一种能防除稻田稗草的特效选择性除草剂。在农药研究中, 喹啉类化合物为农药化学的发展开拓了新的天地, 为寻找高效低毒的新型农药提供了新的途径。近年来, 已有多个含有喹啉结构的化合物作为农药新品种投放市场, 而且各大农药公司仍在不断进行探索研究[7–10]。根据喹啉类化合物的结构特点, 本文设计了3种结构新颖的4–羟基喹啉衍生物, 期望能开发出理想的新农药产品。
1 实验部分
1.1 仪器与试剂
仪器: R–1000型旋转蒸发仪(郑州长城科工贸有限公司); SHZ–3型循环水式多用真空泵(上海雅荣生化设备仪器有限公司); 2XZ–4型旋片式真空泵(临海市真空设备有限公司); 核磁共振仪(德国 Bruke公司, TMS 为内标)。所有溶剂和试剂均为市售纯度, 按常规方法处理后使用。
1.2 烯胺类化合物的合成
羟基喹啉类衍生物的合成路线如图1、图2所示。

图1 羟基喹啉类衍生物的合成路线一
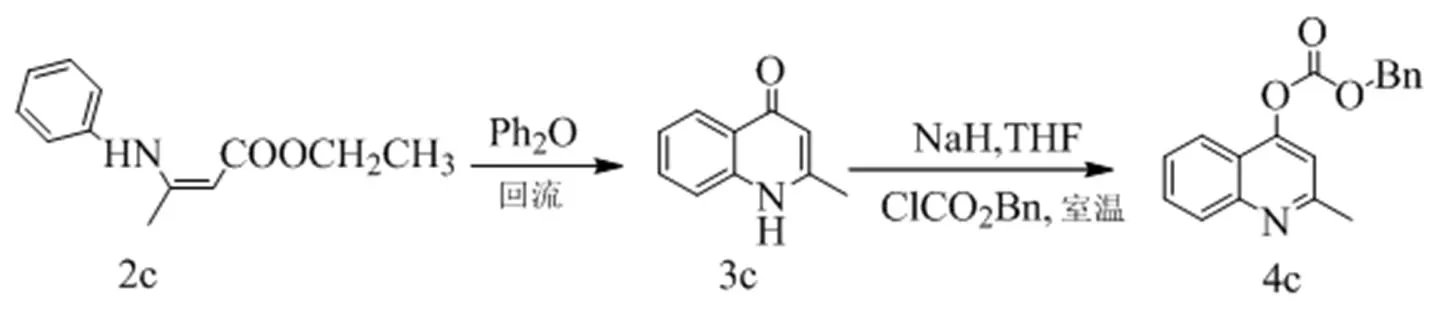
图2 羟基喹啉类衍生物的合成路线二
氮气保护下, 向100 mL圆底烧瓶中, 依次加入米氏酸(4.6 g, 0.032 mol)和原甲酸三甲酯(60 mL, 0.55 mol), 搅拌开始后, 加热至回流状态, 继续搅拌2 h。然后将混合物冷却至室温, 搅拌下缓慢加入苯胺类化合物1a–1b(0.022 mol), 滴加完毕后, 加热至回流状态继续搅拌6 h。TLC检测反应完成后, 将体系冷却至室温, 蒸干大部分原甲酸三甲酯溶液后, 析出大量的黄色固体, 过滤, 滤饼用少量石油醚淋洗3次, 干燥后得到纯品2a–2b。
化合物2a: 黄色固体, 收率为93%;1H–NMR (300 MHz, CDCl3):= 1.75(s, 6H), 7.18–7.23 (m, 1H), 7.34~7.49 (m, 3H), 8.65(d,= 14.0 Hz, 2H), 11.66 (d,= 13.2 Hz, 1H);13C–NMR (75 MHz, CDCl3):= 27.1, 88.6, 105.3, 116.6, 124.6, 127.1, 128.3, 130.5, 134.9, 151.6, 163.4, 165.2。
化合物 2b: 黄色固体, 收率为95%;1H–NMR (300 MHz, CDCl3):= 1.73(s, 6H), 2.26(s, 3H), 2.31(s, 3H), 7.06~7.19 (m, 3H), 8.57(d,= 14.1 Hz, 1H), 11.45 (d,= 13.9 Hz, 1H);13C–NMR (75 MHz, CDCl3):= 13.2, 20.4, 26.9, 86.9, 105.0, 114.9, 126.7, 126.9, 128.5, 136.5, 138.5, 153.6, 163.5, 165.8。
1.3 喹啉酮类化合物的合成
氮气保护下, 向装有回流冷凝管的100 mL单颈圆底烧瓶中, 加入烯胺类化合物(6 mmol)和20 mL二苯醚, 搅拌下加热至260 ℃后(观察到瓶中开始产生大量白色烟雾), 继续搅拌2 h。冷却至室温后, 向体系中加入100 mL正己烷, 静置过夜, 析出大量棕黄色沉淀, 过滤, 滤饼用少量石油醚淋洗3次, 干燥后得到纯的化合物3a–3b, 直接用于下一步反应。
1.4 4–羟基喹啉衍生物的合成
氮气保护下, 向50 mL圆底烧瓶中, 加入二氢喹啉酮3a–3c(3.44 mmol)和20 mL四氢呋喃溶液, 0 ℃下, 分批次加入氢化钠(383 mg, 9.58 mmol), 恢复室温后继续搅拌1 h, 再缓慢滴加氯甲酸苄酯(0.72 mL, 5.16 mmol), 搅拌过夜。最后用1 N的盐酸溶液10 mL淬灭反应, 50 mL乙酸乙酯萃取3次, 有机相用饱和食盐水(30 mL)洗涤2次, 无水硫酸钠干燥有机相后, 减压浓缩, 粗产品经柱层析纯化(乙酸乙酯︰石油醚= 1:4), 得到化合物4a–4c。
化合物4a: 黄色固体, 收率为71%;1H–NMR (300 MHz, CDCl3):= 5.35 (s, 2H), 7.41~7.50 (m, 6H), 7.54 (d,= 5.0 Hz, 1H), 7.87 (d,= 7.5 Hz, 1H), 7.99 (d,= 8.4 Hz, 1H), 9.04 (d,= 5.0 Hz, 1H); 13C–NMR (75 MHz, CDCl3):= 71.1, 112.4, 120.3, 123.2, 126.9, 128.7, 128.8, 129.1, 130.4, 133.6, 134.0, 146.0, 151.4, 151.9, 154.3。
化合物4b: 黄色固体, 收率为62%; 1H–NMR (300 MHz, CDCl3):= 2.50(s, 3H), 2.76(s, 2H), 5.35 (s, 2H), 7.34~7.49 (m, 7H), 7.79 (d,= 8.6 Hz, 1H), 8.91 (d,= 4.9 Hz, 1H); 13C–NMR (75 MHz, CDCl3):= 13.6, 20.7, 70.8, 110.6, 117.8, 119.9, 128.6, 128.7, 128.9, 129.8, 134.3, 134.5, 138.0, 149.1, 149.3, 152.3, 154.2。
化合物4c: 黄色固体, 收率为68%; 1H–NMR (300 MHz, CDCl3):= 2.75 (s, 3H), 5.34 (s, 2H), 7.31 (s, 1H), 7.41~7.51 (m, 6H), 7.68~7.72 (m, 1H), 7.96 (d,= 8.3 Hz, 1H), 8.04 (d,= 8.5 Hz, 1H); 13C–NMR (75 MHz, CDCl3):= 25.6, 70.9, 112.4, 120.1, 120.8, 126.0, 128.6, 128.7, 128.9, 130.1, 134.3, 149.4, 152.3, 154.1, 159.8。
2 结果与讨论
2.1 合成路线
以米氏酸、原甲酸三甲酯和苯胺类衍生物生成亚胺类化合物, 再在加强热的条件下无需添加任何催化剂实现关环, 合成了一系列二氢喹啉酮类衍生物。最后与氯甲酸苄酯得到了4–O–苄氧羰基–2,3–二氢喹啉衍生物。通过对比, 发现这种合成方法更简单, 选取的米氏酸和苯胺类作为原料更容易得到, 价格方面也比较实惠, 关环后的产物易分离, 产率较高。
2.2 目标化合物的表征
以化合物4a为例, 核磁共振氢谱如图4所示, 从图4可以看出, 很难确认保护基团是在氮原子上还是在氧原子上, 但是通过核磁共振碳谱(图5)很容易发现保护基团在氧原子上。理由是, 在核磁共振碳谱上, 很难找到酮羰基的特征峰。同样, 发现化合物4b和4c在核磁共振碳谱上也很难找到酮羰基的特征峰。

图4 化合物4a的核磁共振氢谱
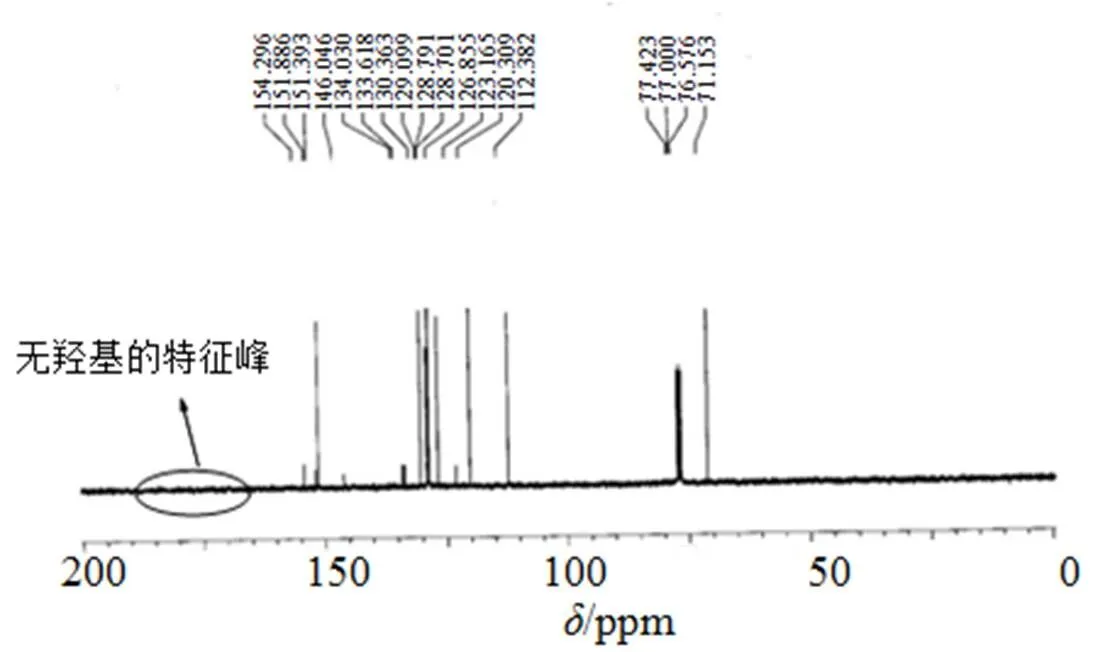
图5 化合物4a的核磁共振碳谱
2.3 反应机理
采用传统的合成方法, 氢化钠去掉胺基上的质子氢后, 容易与氯甲酸苄酯反应, 这样苄氧羰基就保护了胺基, 反应机理如图6所示。然而, 实验结果表明, 靠近氮原子的苯环邻位有取代基团时, 用氢化钠去掉胺基上的质子氢后, 与氯甲酸苄酯反应, 核磁共振谱的结果证明, 产物为对酚羟基进行苄氧羰基保护的产物。查阅文献[11]发现, 苯并喹啉结构存在互变异构体, 可通过质子迁移而发生结构互变。实验结果证实, 靠近氮原子的苯环邻位有取代基团的苯并喹啉更倾向于形成4–羟基喹啉。
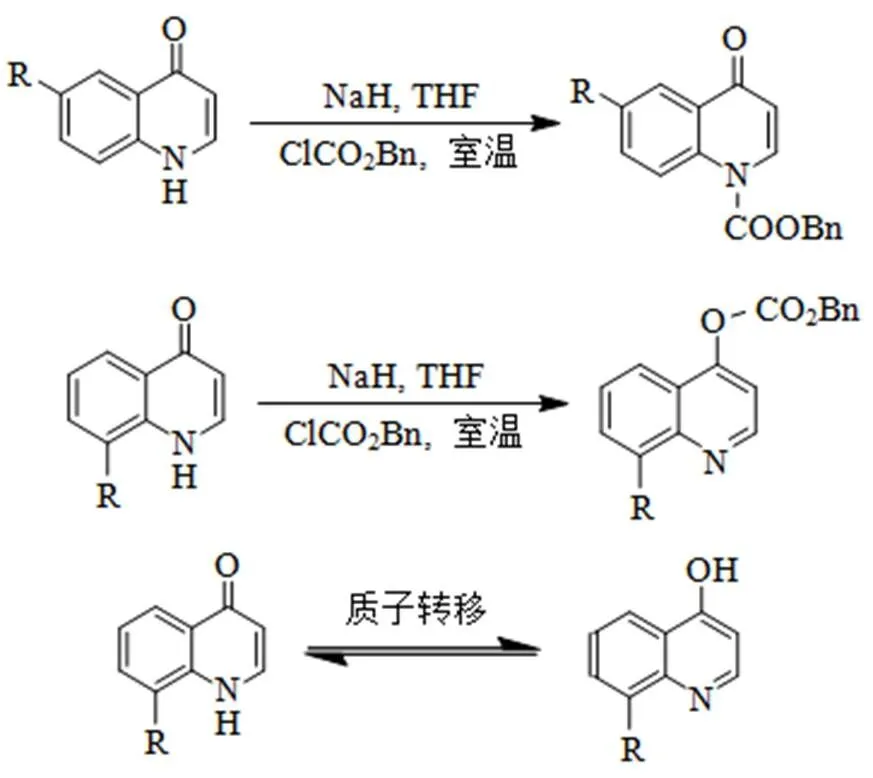
图6 反应机理
3 结论
本文以米食酸、原甲酸三甲酯和苯胺类化合物为原料, 合成了2种喹啉酮类化合物。同时, 合成了另一种2位为甲基的喹啉酮类化合物。最后将所合成的喹啉酮类化合物与氯甲酸苄酯反应, 以中等的收率制备了3种结构新颖的4–羟基喹啉衍生物, 并利用核磁共振谱图对目标化合物进行了表征。这种合成方法简单, 关环后的产物易分离, 产率较高, 同时为深入研究喹啉类农药关键中间体提供了新思路, 特别是为4–O–苄氧羰基–2,3–二氢喹啉类先导化合物库的建立提供了一定的参考。
参考文献:
[1] 陶绍木, 张建华, 彭昌亚, 等. 杂环化合物的应用和发展[J]. 中国食品添加剂, 2003, 3(3): 31–34.
[2] 王军, 刘文彬, 吴振, 等. 从煤焦油洗油中提取喹啉和异喹啉的研究[J]. 化工科技, 2005, 13(2): 19–22.
[3] 吕早生, 徐榕, 魏涛. 从煤焦油洗油中提取喹啉的研究[J]. 武汉科技大学学报, 2008, 31(6): 652–656.
[4] 祝丽永. 3, 4–二氢异喹啉–1–酮类衍生物的合成研究[D]. 西安: 陕西师范大学, 2008.
[5] 谢宇, 胡金刚, 洪小伟, 等. 异喹啉酮类衍生物的合成研究[J]. 有机化学, 2010, 30(6): 894–89.
[6] 田俊锋, 刘军, 刘长令, 等. 具有生物活性的喹啉类化合物的研究进展[J]. 农药, 2011, 50(8): 552–557.
[7] 徐峰, 杨定乔, 李文辉, 等. 喹啉类药物研究进展[J]. 广东药学, 2004, 14(6): 6–9.
[8] 徐勤丰. 4–氨基喹啉类药物的研究进展[J]. 中国药物化学杂志, 1994, 1(1): 68–73.
[9] 魏晓莉, 苏瑞斌. 喹啉类药物抗疟作用机制研究进展[J]. 军事医学科学院院刊, 2002, 26(3): 228–230.
[10] 汪小华, 丰枫, 袁俊峰, 等. 催化法合成喹啉及其衍生物的研究进展[J]. 化工生产与技术, 2009, 16(1): 34–40.
[11] Reitsema, R H. The Chemistry of 4-Hydroxyquinolines [J]. Chem Rev, 1948, 43(1): 43–68.
(责任编校:刘晓霞)
Study on the synthesis of 4-hydroxyquinoline derivatives
Zhang Xiangyang, Kang Xiuzhi, Shen Youming, Zhang Chunxiang
(College of Chemistry and Chemical Engineering, Hunan University of Arts and Science, Changde 41500, China)
Three kinds of novel 4-hydroxyquinoline derivatives with medium yield are obtained through two routes, using eat rice acid, trimethyl orthoformate, aniline compounds and benzyl ester as raw materials.The spectra of target compounds are characterized by NMR. In addition, the effect of substituents on the synthetic compounds is investigated. When the substituent at ortho positionat of amino atom, the target compound can be successfully synthesized.
quinoline derivatives; cyclization reaction; tautomerism; new synthetic method
10.3969/j.issn.1672–6146.2015.01.009
TQ 171.73
1672–6146(2015)01–0038–04
张向阳, zhangxiangy06@163.com。
2014–09–20
湖南文理学院博士启动基金(10305005), 湖南文理学院校级重点项目(13ZD08), 湖南省十二五重点建设学科—应用化学资助.
