共轭亚油酸和α-亚麻酸对HepG2细胞核转录因子NF-E2相关因子及谷胱甘肽硫转移酶A1表达的影响
2015-12-20李广亮张秀英郝丽红张金铭
李广亮 张秀英 齐 悦 郝丽红 张金铭
(东北农业大学动物医学学院,哈尔滨 150030)
共轭亚油酸(CLA)和α-亚麻酸(ALA)分别是多不饱和脂肪酸(PUFA)中n-6家族和n-3家族的重要代表,是人和动物不可或缺的营养物质,在食品和饲料中保持适量的CLA和ALA能够有效预防和抑制代谢综合征及其引发的多种疾病[1-3]。核转录因子NF-E2相关因子(Nrf2)是可诱导多种解毒酶、生物转化酶和异生物质转运蛋白的关键核转录因子[4-5],谷胱甘肽硫转移酶(GSTs)是Nrf2信号通路下游的靶基因,其中谷胱甘肽硫转移酶A1(GSTA1)是Ⅱ相代谢酶GSTs酶系重要亚型,占胞液总GSTs的65% ~75%,是细胞防御系统重要的组成部分。因此研究CLA和ALA与Nrf2和GSTA1的相关性具有重要意义[6]。研究证明,Nrf2具有抗氧化和抗炎症等功能,被认为是能够治疗多种代谢综合征引起的疾病的潜在药物作用靶点[7],而在鸡和家兔的饲料中添加2种脂肪酸均发现会提高鸡蛋和家兔肝脏中Nrf2的表达量[8-9]。但对于不同浓度的 CLA和 ALA作用HepG2细胞时,对Nrf2-Kelch样环氧氯丙烷相关蛋白1(Keap1)信号通路以及GSTA1表达量的影响,鲜有详细报道。鉴于此,本文旨在探讨CLA和ALA以不同的浓度作用HepG2细胞24 h时,对HepG2细胞中Nrf2和GSTA1的mRNA以及蛋白质表达量的影响。
1 材料与方法
1.1 试验材料
HepG2细胞由哈尔滨医科大学药理学实验室赠送;DMEM培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青生物工程材料有限公司;CLA和ALA购自Sigma公司;RT-PCR试剂盒购自全式金生物技术有限公司;Trizol购自Invitrogen公司;人源细胞Nrf2抗体购自Immunoway公司;GSTA1抗体购自武汉三鹰公司;辣根过氧化物标记羊抗兔二抗购自北京博奥森生物技术有限公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒和RIPA裂解液均购自碧云天生物技术研究所。
1.2 试验方法
1.2.1 细胞培养和试验设计
HepG2细胞用含10%胎牛血清的DMEM培养基培养于25 mL培养瓶,5%CO2、37℃条件下培养。使用0.25%的胰蛋白酶消化,将对数生长期细胞接种于六孔板,待细胞生长稳定、细胞融合率达到80%以上时,将皂化后的CLA和ALA加入培养基至所需浓度。分别添加0.2、0.5和1.0 mmol/L CLA,0.2、0.5 和 1.0 mmol/L ALA,作用24 h,每个处理6个重复,并设空白对照组。
1.2.2 噻唑蓝(MTT)试验
将细胞接种于96孔板,待其长成单层后弃掉原有培养液,加入稀释后的CLA和ALA培养液,浓度梯度分别是 0、0.1、0.2、0.5、1.0、3.0 和5.0 mmol/L。每梯度平行接种12个孔,同时设对照孔。每孔加入100μL培养基,培养24 h,加入10μL的MTT,培养4 h,加入100μL二甲基亚砜(DMSO)溶解紫色结晶,酶标仪检测,计算细胞成活率。
细胞成活率(%)=100×样品孔吸光度值/对照孔吸光度值。
1.2.3 总 RNA提取和 RT-PCR检测 Nrf2和GSTA1的mRNA表达量
用TRIzol(Invitrogen)法提取HepG2细胞中总RNA,立刻使用反转录试剂盒(全式金生物技术有限公司)反转录成cDNA。使用荧光定量PCR仪(ABI 7500 RT-PCR SDS system)定量。通过SYBR Green荧光定量染料法,反应条件设置为94℃预变性30 s,94℃变性5 s,60℃退火34 s,循环次数40次。使用引物如下,Nrf2的上游引物:5’-TTCCCGGTCACATCGAGAG-3’,下游引物:5’-TCCTGTTGCATACCGTCTAAATC-3’;GSTA1的上游引物:5’-GGGAAAGACATA AAGGAGAGAG-3’,下游引物:5’-TCAAAGGCAGGGAAGTAGC-3’;β -肌动蛋白(β-actin)的上游引物:5’-GATCCACATCAGCTGGGAAGG-3’,下游引物:5’-AAGTGTGACGTTGACATCCG-3’。
1.2.4 蛋白质的提取以及蛋白质印迹法(Western blotting)检测Nrf2和GSTA1的蛋白质表达量
采用RIPA裂解法,提取细胞总蛋白。将弃掉培养液的细胞,用灭菌处理的冰PBS冲洗1~2次,加入80μL RIPA裂解液(碧云天试剂公司)用细胞刮刀刮取细胞,并吸取进离心管中,14 000×g离心30 min,吸取上层清液备用,以上提取蛋白质操作都在冰上操作,以防止在提取过程中蛋白质降解,通过紫外分光光度法和BCA法测定蛋白质浓度。将蛋白质样品稀释至相同且合适的浓度进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)电泳(电泳时间:100 V、2 h;100 V、40 min)。湿转至硝酸纤维素(NC)膜(转膜时间:100 V、2 h),用三乙醇胺缓冲盐(TBST)溶液稀释的终浓度为5%的脱脂乳封闭1 h,用兔抗人Nrf2抗体(1∶1 000)孵育4℃过夜。然后用羊抗兔二抗室温封闭1 h,采用电化学发光检测法(ECL法)显色。同一样本用β-actin作为内参。结果用Image J凝胶分析软件进行吸光度值分析。每个结果至少经过3次重复试验得到。
1.3 数据分析
试验数据用平均值±标准差表示,用SPSS 19.0统计软件进行统计分析,多组间比较采用单因素方差分析。P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 不同浓度的 CLA和 ALA对 Hep G2细胞成活率的影响
由表1可知,不同浓度的CLA和 ALA对HepG2细胞成活率的影响,与对照组相比,CLA和ALA低浓度时对细胞成活率无显著影响(P>0.05),当 CLA 和 ALA 的 浓 度 为 3.0 和5.0 mmol/L时,极显著降低HepG2细胞的成活率(P<0.01)。本试验所使用的浓度对细胞成活率没有显著影响(P>0.05)。
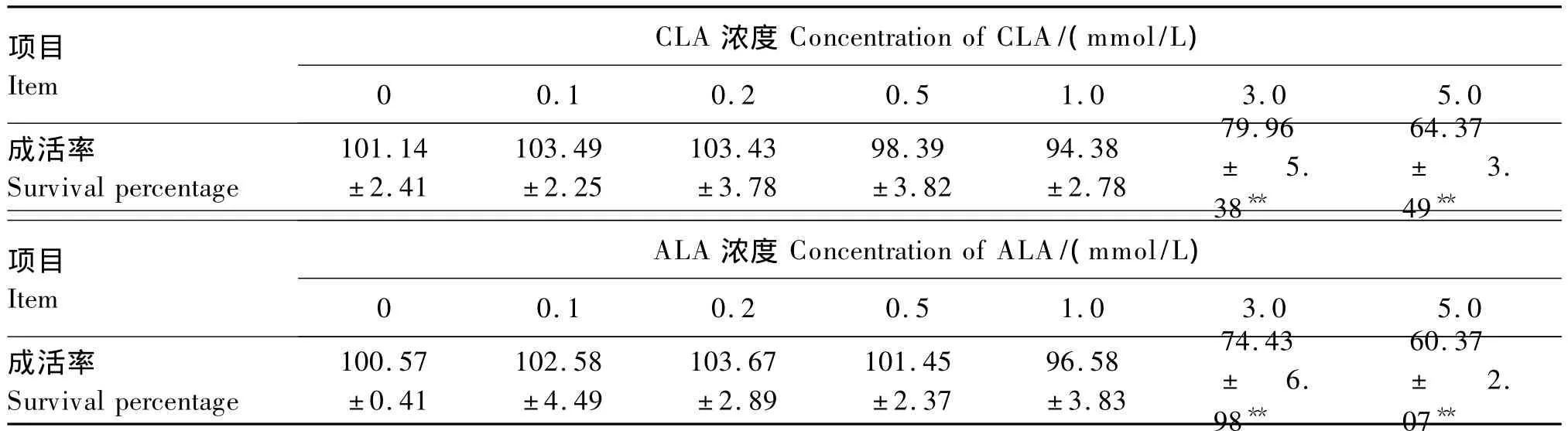
表1 不同浓度的CLA和ALA对HepG2细胞成活率的影响Table 1 Effects of different CLA and ALA concentrations on survival percentage of HepG2 cells %
2.2 不同浓度的 CLA和 ALA对 Nrf2 mRNA表达量的影响
由图1可知,与对照组相比,CLA浓度为0.2和0.5 mmol/L时,Nrf2 mRNA的表达量分别提高4.53倍和3.39倍,差异极显著(P <0.01);CLA浓度为1.0 mmol/L时,Nrf2 mRNA的表达量与对照组相比提高1.67倍,差异显著(P<0.05)。与对照组相比,ALA浓度为0.2 mmol/L时,Nrf2 mRNA表达量变化不显著(P>0.05);ALA浓度为0.5和1.0 mmol/L时,Nrf2 mRNA表达量分别提高2.65 倍和8.44 倍,差异极显著(P <0.01)。
2.3 不同浓度的CLA和ALA对GSTA1 mRNA表达量的影响
由图2可知,与对照组相比,CLA浓度为0.5和1.0 mmol/L时,GSTA1 mRNA表达量分别提高4.39倍和 3.35 倍,差异极显著(P <0.01);CLA浓度为0.2 mmol/L时,GSTA1 mRNA表达量与对照组相比提高1.61倍,差异显著(P<0.05)。与对照组相比,ALA浓度为0.2 mmol/L时,GSTA1 mRNA变化不显著(P >0.05),ALA 浓度为 0.5和1.0 mmol/L时,GSTA1 mRNA表达量分别提高3.00倍和 4.59 倍,差异极显著(P <0.01)。
2.4 不同浓度的CLA对Nrf2和GSTA1蛋白质表达量的影响
由图3可知,与对照组相比,CLA浓度为0.2和0.5 mmol/L时,Nrf2蛋白质表达量提高1.85倍和1.91倍,差异极显著(P<0.01);CLA 浓度为1.0 mmol/L时,Nrf2蛋白质表达量提高 1.27倍,差异不显著(P>0.05)。与对照组相比,CLA浓度为 0.2和0.5 mmol/L时,GSTA1蛋白质表达量分别提高1.93倍和2.05倍,差异极显著(P<0.01);CLA 浓度为 1.0 mmol/L 时,GSTA1 蛋白质表达量提高1.53倍,差异显著(P<0.05)。

图1 不同浓度的CLA和ALA对Nrf2 mRNA表达量的影响Fig.1 Effects of different CLA and ALA concentrations on expression of Nrf2 mRNA
2.5 不同浓度的ALA对Nrf2和GSTA1蛋白质表达量的影响
由图4可知,与对照组相比,ALA浓度为0.2 mmol/L时,Nrf2蛋白质表达量提高1.35倍,差异显著(P<0.05);ALA浓度为 0.5和1.0 mmol/L时,Nrf2蛋白质表达量分别提高1.77倍和1.94倍,差异极显著(P<0.01)。与对照组相比,当 ALA 浓度分别为0.2、0.5 和1.0 mmol/L时,GSTA1蛋白质表达量分别提高了1.75倍、2.28倍和 2.86 倍,差异极显著(P <0.01)。

图2 不同浓度CLA和ALA对GSTA1 mRNA表达量的影响Fig.2 Effects of different CLA and ALA concentrations on expression of GSTA1 mRNA

图3 不同浓度的CLA对Nrf2和GSTA1蛋白质表达量的影响Fig.3 Effects of different CLA concentrations on protein expression of Nrf2 and GSTA1
3 讨论
基因和环境因素是影响人和动物的健康和疾病的关键因素,营养物质是环境因素中重要的组成部分,而且其变化会影响人和动物的健康和疾病[10-11]。CLA和ALA是机体所必需的重要营养物质,2种不饱和脂肪酸对于维持人和动物的健康具有重要作用。目前,对于CLA和ALA的研究,大多数是进行体内试验,研究集中在摄入食物时的比例和血液中的含量等方面,而在细胞水平上,CLA和ALA对细胞状态的影响和对细胞内关键信号通路的影响鲜有研究[1,9,12]。

图4 不同浓度的ALA对Nrf2和GSTA1蛋白质表达量的影响Fig.4 Effects of different ALA concentrations on protein expression of Nrf2 and GSTA1
GSTA1具有降解多种有毒化学物质和调节体内氧化平衡的作用,也是Nrf2-Keap1信号通路调控的下游靶基因之一[6],Nrf2是信号通路的关键核转录因子,提高Nrf2的表达量对于机体具有保护作用,可治疗和预防人和动物的代谢综合征和脂肪肝等多种疾病,适量的摄入CLA和ALA,对于保证人和动物的健康至关重要[12,14]。本试验结果表明,不同浓度的CLA和ALA均不同程度上提高了Nrf2和GSTA1的mRNA和蛋白质的表达量,但提高的量不同。Selene 等报道[14],0.4 mmol/L ALA可通过提高HepG2细胞中Nrf2 mRNA和蛋白质表达量,由此减轻砷引起的细胞损害;还有研究证明,在饲料中添加ALA可增加家兔脑内Nrf2的蛋白质表达量,调节脑内的氧化还原状态,缓解脑退行性变等多种脑内疾病[15];并且在威斯塔鼠饲料中添加CLA,同样会增加Nrf2蛋白质的表达量[11],这与本试验结果可相互印证。在本试验选择的浓度范围内,ALA的浓度越大,Nrf2和GSTA1的mRNA和蛋白质表达量提高的越多;而CLA则是在浓度为0.5 mmol/L时,诱导 Nrf2和 GSTA1的mRNA和蛋白质表达的作用最强,而CLA浓度为1.0 mmol/L时,提高 Nrf2和 GSTA1的 mRNA和蛋白质的表达量相对减少。ALA和CLA都能增强Nrf2和GSTA1的mRNA和蛋白质表达量,而不同的浓度增强的幅度变化较大。CLA和ALA作为必需脂肪酸,摄入的多少对于机体的健康非常重要。CLA和ALA在体内含量不同时,引起相应的生物学特征改变的具体机制仍需进一步研究。
4 结论
CLA在较低浓度时,诱导 Nrf2和 GSTA1 mRNA和蛋白质表达量作用较强,而随ALA浓度增加Nrf2和GSTA1 mRNA和蛋白质的表达量逐渐增多。
[1] MONTEIRO J,LESLIE M,MOGHADASIAN M H,et al.The role of n-6 and n-3 polyunsaturated fatty acids in the manifestation of the metabolic syndrome in cardiovascular disease and non-alcoholic fatty liver disease[J].Food & Function,2014,5(3):426-435.
[2] PATTERSON E,WALL R,FITZGERALD G F,et al.Health implications of high dietary omega-6 polyunsaturated fatty acids[J].Journal of Nutrition and Metabolism,2012,2012:539426.
[3] POUDYAL H,PANCHAL S K,DIWAN V,et al.O-mega-3 fatty acids and metabolic syndrome:effects and emerging mechanisms of action[J].Progress in Lipid Research,2011,50(4):372-387.
[4] BATAILLE A M,MANAUTOU J E.Nrf2:a potential target for new therapeutics in liver disease[J].Clinical Pharmacology & Therapeutics,2012,92(3):340-348.
[5] WAKABAYASHI N,SLOCUM S L,SKOKO J J,et al.When NRF2 talks,who’s listening?[J].Antioxidants& Redox Signaling,2010,13(11):1649-1663.
[6] LIANG F Q,ALSSADI R,MOREHEAD P,et al.Enhanced expression of glutathione-S-transferase A1-1 protects against oxidative stress in human retinal pigment epithelial cells[J].Experimental Eye Research,2005,80(1):113-119.
[7] SYKIOTIS G P,HABEOS I G,SAMUELSON A V,et al.The role of the antioxidant and longevity-promoting Nrf2 pathway in metabolic regulation[J].Current Opinion in Clinical Nutrition and Metabolic Care,2011,14(1):41-48.
[8] QI X L,WU SG,ZHANG H J,et al.Effects of dietary conjugated linoleic acids on lipid metabolism and antioxidant capacity in laying hens[J].Archives of Animal Nutrition,2011,65(5):354-365.
[9] MOLLICA M P,TRINCHESE G,CAVALIERE G,et al.c9,t11-conjugated linoleic acid ameliorates steatosis by modulating mitochondrial uncoupling and Nrf2 pathway[J].Journal of Lipid Research,2014,55(5):837-849.
[10] SIMOPOULOS A P.The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases[J].Experimental Biology and Medicine,2008,233(6):674-688.
[11] MIRMIRAN P,HOSSEINPOUR-NIAZI S,NADERI Z,et al.Association between interaction and ratio of ω-3 andω-6 polyunsaturated fatty acid and the metabolic syndrome in adults[J].Nutrition,2012,28(9):856-863.
[12] BEYAZIT Y,PURNAK T,KEKILLI M.Omega-3 fatty acids:a promising alternative treatment approach for patients with nonalcoholic fatty liver disease[J].Digestive Diseases and Sciences,2010,55(8):2422-2423.
[13] KOHJIMA M,ENJOJI M,HIGUCHI N,et al.The effects of unsaturated fatty acids on lipid metabolism in HepG2 cells[J].In Vitro Cellular & Developmental Biology-Animal,2009,45(1/2):6-9.
[14] HUERTA-OLVERA S G,MACÍAS-BARRAGÁN J,RAMOS-MÁRQUEZ M E,et al.Alpha-lipoic acid regulates heme oxygenase gene expression and nuclear Nrf2 activation as a mechanism of protection against arsenic exposure in HepG2 cells[J].Environmental Toxicology and Pharmacology,2010,29(2):144-149.
[15] DELPLANQUE B,DU Q,AGNANI G,et al.A dairy fat matrix providing alpha-linolenic acid(ALA)is better than a vegetable fat mixture to increase brain DHA accretion in young rats[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,2013,88(1):115-120.
