一种经济稳定的小鼠腭裂模型的建立
2015-12-19柴继侠张艳萍尹海燕李徽徽周艳梅贺文欣王元元张志诚
柴继侠 张艳萍 尹海燕 李徽徽 周艳梅 贺文欣 王元元 张志诚
(1蚌埠医学院组胚教研室,蚌埠 233030;2山东省计划生育科学技术研究所,济南 250000;3蚌埠医学院临床医学系,蚌埠 233030)
先天性腭裂畸形是由遗传和环境因素共同作用 导致的多基因遗传病,但其具体发病机制至今仍未完全阐明。在先天性腭裂畸形的发病机制研究中,稳定的腭裂动物模型对研究人类腭裂的发病原因、演变机制及预防具有重要意义[1]。由于小鼠腭的正常发育及腭裂形成与人类十分相似,且繁殖周期短,产仔多,因此国内外多使用小鼠来制备腭裂畸形动物模型。
四氯二苯并二恶英 (tetrachlorodibenzo-p-dioxin,TCDD)是一类持久性环境有机污染物,由于其高毒性、难降解、强脂溶性,容易在食物链中产生蓄积作用,对人类健康和环境安全构成极大威胁,可来源于汽车尾气、垃圾焚烧、农药及剂等,易通过食物链及环境污染物进入生物体内蓄积,危及人体健康[2]。近年来有研究发现 TCDD与腭裂畸形发生密切相关[3,4]。
昆明小鼠是我国生产量、使用量最大的远交系小鼠。通过TCDD诱导产生昆明小鼠腭裂动物模型,尚未见报道。因此,本文采用不同剂量的 TCDD灌胃不同妊娠天数(gestational day,GD)的昆明小鼠,通过计数胎鼠腭裂发生率、观测胎鼠腭解剖结构及组织结构,建立一种稳定高效的昆明小鼠腭裂畸形动物模型。
材料和方法
1.材料
1.1 实验动物
成年未经产昆明小鼠,周龄8-10周,体重25-30克,由蚌埠医学院实验动物中心提供。
1.2 试剂
TCDD购自美国SIGMA公司,用超市出售的优质花生油配制成4μg/ml的浓度,HE试剂盒购自碧云天试剂公司。
2.方法
2.1 小鼠饲养
60只昆明小鼠常规饲养,颗粒喂食,自来水随意饮水,明暗周期各12小时,室温20-22℃。下午6点小鼠按雌雄3:1合笼,次日上午8时查阴栓,阴栓阳性者记录为孕 0天 (gestational day,GD0)。将孕鼠随机分为实验组和对照组,实验组40只,对照组20只。
2.2 致畸方法
实验组分为5个小组。其中3个小组分别于GD11.5、GD12.5和 GD13.5,一次性灌服20μg/kg的TCDD溶液。另外2个小组分别于GD12.5一次性灌服10μg/kg和40μg/kg的 TCDD溶液。对照组一次性灌服等剂量花生油。
2.3 毒性、致畸性检测
记录GD16.5时各组孕鼠一般情况和胎鼠存活情况,解剖镜下观察胎鼠有无腭裂和其他畸形,统计腭裂发生率。
2.4 组织学观察
实验组及对照组分别于 GD13.5、GD14.5、GD15.5和GD16.5剖腹取胎,部分胚胎用4% 多聚甲醛固定,常规石蜡切片、HE染色,观察各组胎鼠腭裂组织学特征。同时取 GD14.5、GD16.5时孕鼠及胎鼠的肝、肺器官,常规石蜡切片HE染色,光镜下观察各脏器的组织学结构。
2.5 统计学分析
采用SPSS 12.0软件进行实验数据的统计学分析,腭裂发生率的比较用 x2检验和确切概率法。Peason线性相关分析TCDD剂量和腭裂发生率的相关性,P<0.05有统计学意义。
结 果
1.给药方案的确定
GD11.5、GD12.5和 GD13.5一次性灌服20μg/kg的 TCDD溶液,腭裂发生率为(23/33)69.7%、(36/44)81.82% 和(12/34)35.29%。GD11.5和GD12.5两组之间腭裂发生率呈上升趋势,虽差异无统计学意义(P>0.05),但GD11.5组腭裂之间的距离较小,腭裂没有GD12.5组明显。GD12.5和GD13.5两组之间腭裂发生率呈下降趋势,差异有统计学意义(P<0.01)(表1)。故选取GD12.5作为最佳用药时间。
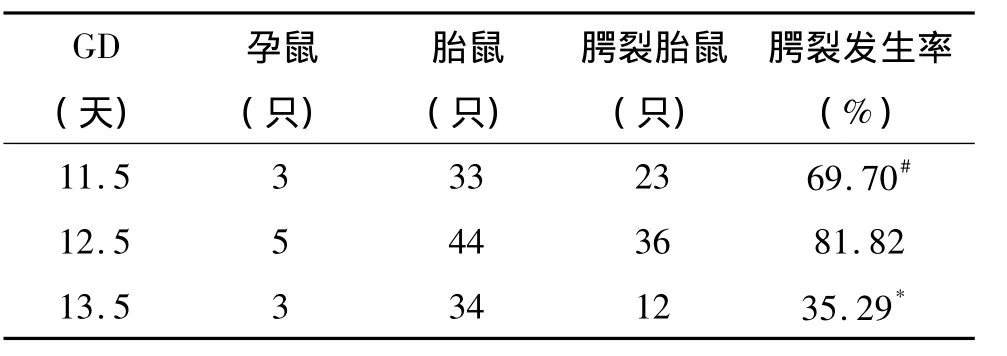
表1 妊娠不同天数给予20μg/kg TCDD灌胃后胎鼠腭裂发生率Table 1 The incidence of fetalm ice cleft palate after given 20μg/kg TCDD lavage at different gestational day
GD12.5给予0、10、20和40μg/kg的TCDD溶液灌胃后,胎鼠腭裂发生率为(2/51)3.92%、(20/43)46.51%、(36/44)81.82% 和(50/51)98.04%。和对照组相比,TCDD实验组腭裂发生率差异有统计学意义(P<0.01)(表 2)。和 20μg/kg组相比,10μg/kg和40μg/kg组腭裂发生率差异有统计学意义(P<0.01,P<0.05)。Peason线性相关分析显示,TCDD剂量与腭裂发生率之间呈正相关(r=0.895,P <0.01)(图1)。
各组孕鼠一般情况良好,无明显的中毒、流产现象。胎鼠未见眼部、尾部、四肢和皮肤等畸形。GD12.5给予40μg/kg的TCDD组有1只死胎,其余均为活胎。
故后续实验采用最佳的造模条件GD12.5灌胃40μg/kg TCDD为实验组,对照组则给予等剂量玉米油。
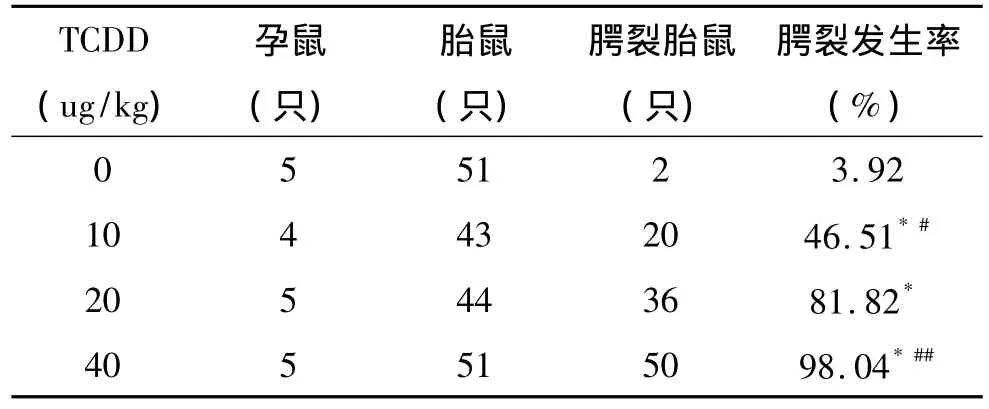
表2 GD12.5给予不同剂量TCDD灌胃后胎鼠腭裂发生率Table 2 The incidence of fetalm ice cleft palate after given different dose TCDD by lavage on GD12.5
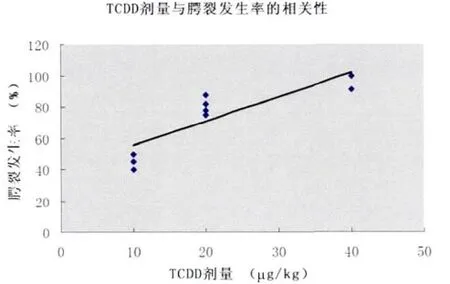
图1 TCDD剂量与腭裂发生率的相关性Fig.1 The correlation between TCDD dose andthe cleft palate incidence
2.解剖镜下观察实验组腭裂畸形形成
GD13.5时,实验组及对照组胎鼠的侧腭突位于舌两侧。GD14.5时,对照组胎鼠侧腭突增大并呈对向生长,侧腭突头端开始融合;实验组侧腭突增大,但未出现融合。GD15.5和GD16.5时,对照组两侧腭突完全融合,形成完整的腭,GD16.5时腭的骨化明显;实验组侧腭突体积继续增大,GD15.5时两侧腭突之间的距离相对缩小,但未出现接触融合,GD16.5时,侧腭突之间的距离增大,头端部分出现骨化,并形成腭裂畸形(图2)。
3.光镜下观察实验组腭裂畸形形成
GD13.5时,实验组及对照组胎鼠的侧腭突位于舌两侧。GD14.5时,对照组胎鼠侧腭突上抬至舌上方,呈对向生长;实验组侧腭突体积增大,但未上抬,仍位于舌两侧。GD15.5和GD16.5时,对照组两侧腭突完全融合,融合处上皮缝消失,出现一个富含细胞的团状区域;实验组两侧腭突上抬至舌的上方,呈对向生长,但两者之间距离大,未出现接触融合,形成腭裂畸形(图3)。
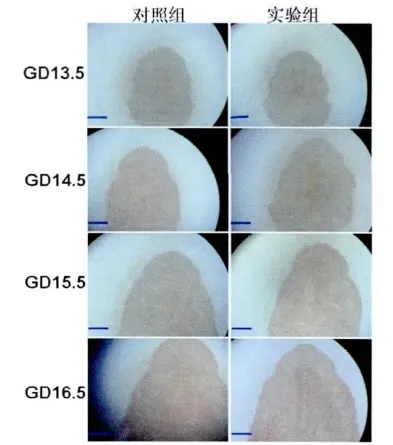
图2 实验组及对照组于 GD13.5~16.5时腭发育的解剖镜观察(Bar=80μm)Fig.2 The palatal development of the fetalmiceduring GD13.5 to GD16.5 in two groups by anatomical lens(Bar=80μm)
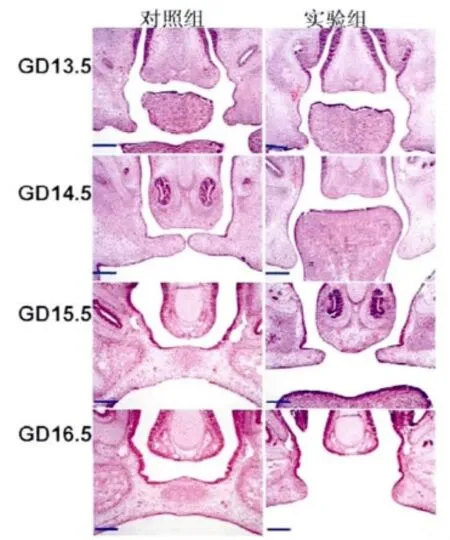
图3 实验组及对照组于GD13.5~16.5时腭组织的HE染色 (Bar=400μm)Fig.3 The palate developmentof the fetalmice during GD13.5 to GD16.5 in two groups by HE staining(Bar=400μm)
4.实验组孕鼠及胎鼠肝、肺的组织学结构正常
GD14.5时,实验组孕鼠肝组织结构与对照组相比,肝细胞胞质内出现空泡样结构,但肝细胞索排列仍比较规则;GD16.5时,两组肝细胞的组织结构未出现明显异常。孕鼠肺及胎鼠的肝、肺组织结构未出现明显异常(图4)。
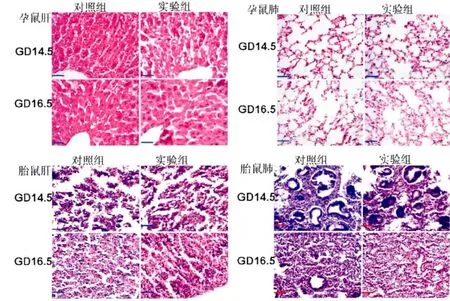
图4 实验组及对照组于GD14.5及GD16.5时,孕鼠、胎鼠的肝、肺组织HE染色(Bar=100μm)Fig.4 The organizational structure of liver and lung in pregnantmice and fetalmice on GD14.5 and GD16.5 in two groups by HE staining(Bar=100μm)
讨 论
TCDD是二恶英中毒性最强的一种环境污染物,结构稳定、半衰期长,具有脂溶性,易通过食物链及环境污染物进入生物体内蓄积,危及人体健康,尤其是干扰正常的胚胎发育[2]。近几年越来越多的文献采用 TCDD[5,6]或联合使用糖皮质激素类[7]诱导腭裂发生,此外还有维甲酸类[8]、甲基 N-硝基亚硝基胍 (MNNG)[1]等或联合使用[9]。这些先天性腭裂畸形动物模型,主要用于腭裂病因学和发生机制方面的研究。
对不同致畸物质或不同动物而言,腭裂畸形的发生条件不同,可能与致畸物质不同的作用机制或种属差异性、敏感性等有关。何晓梦等[3]研究显示,GD10给予28μg/kg TCDD,是 C57BL/6J胎鼠腭裂模型建立的最适剂量,腭裂的发生率为93.02%。对ICR小鼠而言,GD10给予40 mg/kg MNNG,是该种腭裂畸形发生的最佳条件,但是腭裂的畸形率为55.2%[10]。全反式维A酸作用于昆明小鼠,理想腭裂动物模型的条件是GD10给予80 mg/kg剂量,腭裂的发生率为100%。绝大多数两侧腭突不能上抬至正常水平并向水平方向生长,极少部分发现有单侧腭突上抬,腭突发育不全,体积较小,不能在中线相互接触融合形成腭板[8]。本文研究显示,对昆明小鼠而言,TCDD的最佳使用时间在 GD12.5,最佳使用剂量是40μg/kg,腭裂的发生率为98.04%。和其他模型相比,本文的模型成功率高,腭裂形成的具体过程和类型稳定一致,对孕鼠和胎鼠其他脏器的毒性作用非常小。
腭器官发育是一个连续、复杂的生物学过程,包括腭突的垂直生长、上抬、接触及融合等关键步骤[3]。本研究对照组显示,侧腭突的发育也经历了垂直生长期(GD13.5),上抬接触期(GD14.5)和腭突融合期(GD15.5和 GD16.5)。和尹海燕等[8]等的结果相似。本研究实验组结果显示,和对照组相比,侧腭突上抬延迟1天左右(GD14.5时仍位于舌两侧;GD15.5时,侧腭突上抬至舌的上方),侧腭突始终没有接触和融合(GD16.5时侧腭突之间的距离更大),形成腭裂畸形。因此本研究表明,TCDD主要通过延迟侧腭突上抬诱导昆明小鼠腭裂畸形发生,与何晓梦等使用近交系小鼠的文献[3]报道相似。然而有文献报道TCDD主要通过干扰腭中嵴上皮分化、影响两侧腭突融合以诱导小鼠腭裂畸形发生[11,12],出现这种不一致可能是由于所使用实验动物的遗传基因背景不同导致。腭裂的发生机制复杂多样,不同致畸物质、不同动物模型具体发生机制的研究将为腭裂机制的研究提供更广的空间和思路。
本研究显示,实验组孕鼠肝脏在 GD14.5时肝细胞出现空泡样结构,可能是由于肝细胞对 TCDD进行解毒处理,发生脂肪样变的缘故。在 GD 16.5时,肝细胞组织结构基本恢复正常,说明孕鼠的肝细胞对该剂量的 TCDD可以代谢,不会造成肝细胞或肝组织结构的明显破坏。孕鼠一般情况良好,孕鼠肺、胎鼠肺以及胎鼠肝组织结构无明显异常,提示该剂量的TCDD没有明显的母体中毒症状。此外该剂量的 TCDD对胎鼠的发育毒性有明显组织性特异性,跟以往报道一致[11,13]。
昆明小鼠是我国生产量、使用量最大的远交系小鼠,抗病力强、繁殖快且价格低廉。本研究给予GD12.5昆明孕鼠一次性灌胃40μg/kg TCDD,成功地建立稳定、高效的昆明小鼠腭裂畸形动物模型,腭裂发生率高达98.04%,TCDD主要通过延迟侧腭突上抬诱导昆明小鼠腭裂的发生。这将为科研工作者对腭裂畸形发病原因及发病机制等的研究提供稳定高效的昆明小鼠腭裂模型。
[1]朱江波,印木泉,陈蓉芳等.甲基N-硝基亚硝基胍和视黄酸致ICR小鼠腭裂发育模型的建立.第二军医大学学报,2005,26(1):58-60
[2]Chopra M,Schrenk D.Dioxin toxicity,aryl hydrocarbon receptor signaling,and apoptosis-persistent pollutants affect programmed cell death.Crit Rev Toxicol,2011,41(4):292-320
[3]何晓梦,刘翠苹,蒲亚兰等.以形态与组织学为基础筛选诱导胎鼠腭裂的四氯二苯二噁英最适剂量.卫生研究,2013,42(2):277-281
[4]Fujiwara K,Yamada T,Mishima K,et al.Morphological and immunohistochemical studies on cleft palates induced by 2,3,7,8-tetrachloro-dibenzo-p-dioxin in mice.Congenit Anom(Kyoto),2008,48(2):68-73
[5]蒲亚兰,刘丽玲,甘立强等.二噁英诱导胎鼠腭裂组织中TGF-β3 表达变化.中国公共卫生,2011,27(9):1203-1205
[6]刘丽玲,傅跃先,蒲亚兰等.2,3,7,8-四氯二苯二噁英诱导腭裂发生的差异蛋白筛选.重庆医科大学学报,2011,36(9):1087-1090
[7]柴茂洲,李承浩,何永红等.四氯二苯对二恶英和地塞米松诱导小鼠腭裂及转化生长因子-β3和受体活化样激酶5的表达.华西口腔医学杂志,2010,28(4):356-360
[8]尹海燕,刘 凯,卓煜娅等.过量维A酸致昆明小鼠腭裂动物模型的建立.蚌埠医学院学报,2010,35(1):14-16
[9]吕红兵,李鑫,金岩等.BALB/C近交系小鼠腭裂模型的建立及形态学观察.实用口腔医学杂志,1999,15(4):251-253
[10]朱江波,张天宝.腭裂动物模型的研究现状.国外医学口腔医学分册,2005,32(2):133-135
[11]Abbott BD,Birnbaum LS.Cellular alterations and enhanced induction of cleft palate after coadministration of retinoic acid and TCDD.Toxicol Appl Pharmacol.1989,99(2):287-301
[12]Imura H,Yamada T,Mishima K,et al.Effect of 2,3,7,8-tetrachlorodibenzo-p-dioxin suggests abnormal palate development after palatal fusion.Congenit Anom,2010,50(2):77-84
[13]Couture LA,Abbott BD,Birnbaum LS.A critical review of the developmental toxicity and teratogenicity of 2,3,7,8-tetrachlorodibenzo-p-dioxin:recent advances toward understanding the mechanism.Teratology,1990,42(6):619-627
