银杏内酯B 抑制缺氧诱导的肝细胞凋亡
2015-12-19李中文
李中文 吴 涛
(蚌埠医学院生物科学系细胞生物学教研室,蚌埠 233030)
银杏叶提取物(extract of ginkgo biloba,EGB)是从银杏科植物银杏Ginkgo biloba L.的叶中分离纯化出来的提取物,主要成分有黄酮糖苷类、萜烯内酯类等,银杏内酯B(BN52021)是其主要有效成份之一[1],具有抗氧化和清除自由基的作用。
现有的研究表明银杏叶提取物对中枢神经系统有保护作用,如对实验性脑损伤和临床脑功能不全有较明显的治疗效果[2]。此外还发现银杏内酯B具有对抗肝纤维化,保护肝脏作用[3]。但是,EGB在体内发挥保护作用的分子机制尚不明确。
本研究在大鼠肝细胞的体外培养体系中通过缺氧建立体外凋亡模型,观察EGB对肝细胞凋亡有无保护作用及可能的作用机制,进一步探讨银杏内酯B对大鼠肝细胞缺氧诱导凋亡的分子生物学机制。
材料和方法
1.材料
1.1 实验动物
SD新生鼠鼠龄10d以内,由蚌埠医学院实验动物中心提供。
1.2 试剂和仪器
EGB(扬子江药业集团)、Hoechst(美国MolecularProbes公司)、PI染色剂(美国 Sigma公司)、Annexin V-FITC/PI双染法流式细胞分析试剂盒(美国Pharmigen公司);倒置荧光显微镜(日本Olympus公司)、高效液相色谱仪(美国奥泰公司)、加样枪(美国安捷伦公司)、FACS Calibur型流式细胞仪(美国Becton-Dickinson公司)。
2.方法
2.1 肝脏处理
1d龄SD新生大鼠,快速分离新生鼠肝脏,浸入D-hank液中,取肝脏并剪成约1mm3的碎块,再用DHank液洗三次,并剔除脂肪、结缔组织、血液等杂物。0.25%胰蛋白酶分次消化后自然沉淀,取上清液,加入冷DMEM终止消化,离心弃上清液,再加入DMEM洗去残存胰蛋白酶,用DMEM(Gibco)+10%胎牛血清+抗生素培养液的培养液制成细胞悬液,37℃ 5%CO2培养箱中培养1h,将细胞悬液以1×106个/ml的密度重新接种,37℃ 5%CO2培养箱中培养。适时更换培养液至72h细胞维持旺盛的代谢。经上述处理获得纯度>95%的肝细胞。
2.2 肝细胞培养与分组
将肝细胞随机分为5组:正常对照组(N组)、缺氧对照组(H组)、缺氧加EGB组1(B1组)、缺氧加EGB组2(B2组)、缺氧加EGB组3(B3组)。B1、B2、B3组于缺氧前加入银杏内酯B注射液(20mg/ml),银杏内酯 B 的终浓度分别为 1μg/ml、2μg/ml、4μg/ml。
2.3 缺氧诱导细胞凋亡模型建立
取上述5组细胞,向其中4组缓慢充入95%N2+5%CO2混合气10min,直至培养瓶中空气被替代,肝细胞处于缺氧状态,放入CO2孵箱中孵育12h后倒出培养液,D-Hanks液漂洗,0.25%胰蛋白酶消化,当消化一定程度后加入5ml培养液终止消化,将消化下来的细胞分别1500r/min 10min离心收集,细胞转移到Eppendorf管中,调整细胞浓度至1×106/ml,参照Annexin V-FITC试剂盒说明书处理细胞,检测细胞凋亡情况,确定缺氧诱导细胞凋亡模型的建立。
2.4 Hoechst33258染色
每组细胞加入 10μg/mL Hoechst33258染液,37℃孵育5min,PBS清洗2次。每组随机选取15个视野,在倒置荧光显微镜下观察,可见正常肝细胞核边界规则整齐,染色均匀并呈淡染;凋亡肝细胞核呈现致密浓染,皱缩、碎裂。按细胞凋亡形态学标准,计数凋亡细胞和细胞总数,计算新生鼠肝细胞凋亡率(凋亡细胞数/细胞总数)。
2.5 流式细胞术
Annexin V-FITC/PI双染法:取单细胞悬液细胞用1×Binding Buffer调整至1×106/mL浓度,取100μL细胞液至5mL流式专用试管,分别加入5μL AV-FITC和10μL PI溶液。混匀细胞,避光孵育15min后,加入400μL的1×Binding Buffer。1h之内上机检测。设置即未染色的裸细胞,单染AV-FITC和单染PI。采用488nm激发光源,首先检测对照管,调整参数FSC/SSC,设定阈值,排除碎片和噪声的干扰,设门(gate)以获取细胞,以门中细胞进行后续荧光信号检测。将对照管(裸细胞)荧光强度设定为非特异本底荧光。每个样本均获取10000个细胞,数据采用CellQuest软件进行分析。流式细胞仪分析条件:激发波长Ex=488 nm;发射波长Em=530 nm。
2.6 统计学分析
细胞荧光染色检测数据 所有实验均3次重复,用SPSS14统计软件进行统计分析,以均数±标准差()表示。多组比较用单因素方差分析,均数间的两两比较用t检验,统计学分析P<0.05为有显著性差异,P>0.05为无显著性差异。
结 果
1.荧光显微镜观察新生鼠肝细胞核形态
正常新生鼠肝细胞核形态完整,核膜清晰,染色均匀并呈淡染;新生鼠肝细胞凋亡后细胞核碎裂,核膜不清或皱缩或碎裂,染色不均匀并呈致密浓染。从采集各组荧光图像可以看出:正常培养的大鼠肝细胞(N组)凋亡较少,缺氧刺激后肝细胞(H组)凋亡数增加,EGB处理保护组(B1、B2、B3组)肝细胞凋亡减少,但不同EGB浓度组间肝细胞凋亡保护作用区别不明显(图1)。
2.肝细胞诱导凋亡形态学统计学分析
荧光显微镜下观察新生鼠肝细胞核形态,按凋亡细胞形态学标准,每组随机选取15个视野,统计分析EGB处理组与缺氧组肝细胞凋亡率,二者相比有显著性差异(P <0.05),EGB对大鼠肝细胞凋亡具有抑制作用,但这种抑制作用未表现出明显的EGB剂量依赖性(表1)。
表1 银杏内酯B浓度对大鼠肝细胞凋亡率的影响()Table 1 Effects of ginkgolide B concentration on the liver cell apoptosis rate()
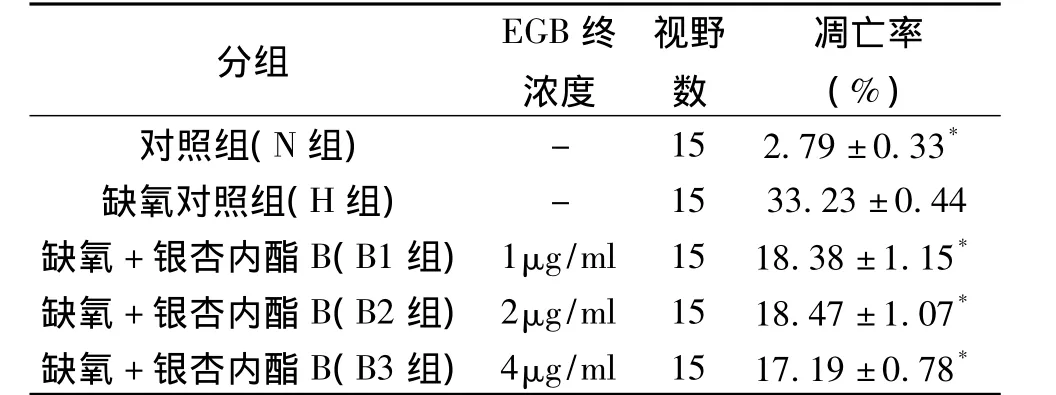
表1 银杏内酯B浓度对大鼠肝细胞凋亡率的影响()Table 1 Effects of ginkgolide B concentration on the liver cell apoptosis rate()
*P<0.05
分组 EGB终浓度视野数凋亡率(%)对照组(N组) - 15 2.79±0.33*缺氧对照组(H组) - 15 33.23±0.44缺氧+银杏内酯B(B1组)1μg/ml 15 18.38±1.15*缺氧+银杏内酯B(B2组)2μg/ml 15 18.47±1.07*缺氧+银杏内酯B(B3组)4μg/ml 15 17.19±0.78*
3.流式细胞仪检测新生鼠肝细胞凋亡
流式细胞仪检测缺氧12hEGB保护组(1μg/ml、2μg/m l、4μg/m l)的 肝细 胞 早期 凋亡率 分别为19.10%、18.65%、19.80%,单纯缺氧组细胞早期凋亡率为34.20%(表2);流式细胞仪检测EGB保护下肝细胞凋亡情况,新生鼠肝细胞培养对照组早期+晚期凋亡率17.17±2.09%,缺氧组早期+晚期凋亡率85.26±3.42%,缺氧组与对照组间比较,P<0.05为有显著性差异;不同浓度EGB保护作用下新生鼠肝细胞培养12h时,早期+晚期凋亡率分别为 77.97±4.21%、73.39±2.13%、70.66±4.23%,EGB保护组间无显著性差异(P>0.05)(表3)。流式结果与荧光显微镜观察统计结果总体一致。

图1 Hoechst33258染液染色的肝细胞(200×)。A.正常培养的肝细胞(N组);B.缺氧诱导凋亡的肝细胞(H组);C.缺氧+银杏内酯B 1μg/ml(B1组);D.缺氧+银杏内酯B 2μg/ml(B2组);E.缺氧+银杏内酯B 4μg/ml(B3组)Fig.1 Hoechst33258 staining of liver cells(200×).A.Normal culture of liver cells(N组);B.Hypoxia induced apoptosis of liver cells(H 组);C.Hypoxia+EGB1μg/ml(B1 group);D.Hypoxia+EGB2μg/ml(B2 group);E.Hypoxia+EGB4μg/ml(B3 group)

图2 肝细胞凋亡流式图(对照/N组、缺氧对照/H组、EGB 1μg/ml/B1组、EGB 2μg/ml/B2组、EGB 4μg/ml/B3组)Fig.2 Apoptosis of liver cell(control group N、Hypoxia control group H、EGB 1μg/ml group B1、EGB 2μg/ml group B2、EGB 4μg/ml group B3)

表2 不同浓度的EGB保护下细胞凋亡率(%)Table 2 different concentrations of EGB on cell apoptosis(%)
表3 不同浓度EGB保护下肝细胞早期及晚期凋亡情况(%,)Table3 Apoptosis of liver cells at different concentrations of EGB(%,)

表3 不同浓度EGB保护下肝细胞早期及晚期凋亡情况(%,)Table3 Apoptosis of liver cells at different concentrations of EGB(%,)
*P<0.05为有显著性差异,△P>0.05为无显著性差异。
晚期凋亡对照组(N组)EGB浓度(μg/ml) 正常细胞 早期凋亡 晚期凋亡 早期+80.35±4.88*8.49±1.20 8.68±1.02 17.17±2.09*85.26±3.42*1μg/ml(B1组)缺氧组(H组)4.42±2.03*34.21±2.16 50.92±2.85 77.97±4.21*2μg/ml(B2组)4.45±1.85*19.10±2.55△58.87±2.71 73.39±2.13*4μg/ml(B3组)4.27±1.11*18.65±0.09△54.74±3.02 6.74±1.25*19.80±4.52△50.86±0.41 70.66±4.23*
讨 论
细胞凋亡是主动性基因控制的自杀过程,是生物体维持内稳态的生理机制。肝细胞凋亡是肝脏的实质和间质细胞死亡的最主要形式,肝细胞增殖和细胞凋亡失去平衡,肝细胞发生再生异常,可能导致慢性肝脏组织病变的发生[1]。
文献报道银杏内酯B具有清除氧自由基、限制多聚不饱和脂肪酶的超氧化、降血脂、抗纤维化、改善微循环等作用,对缺血、缺氧等多种因素引起的肝脏损伤有保护作用[6-8]。同时,银杏内酯对体外培养的神经元有保护作用。银杏叶提取物EGb761有促进外周神经再生及减少神经元凋亡的作用。此外,Daba等[10]的研究表明,GEB可通过抑制脂质过氧化而对博莱霉素(Bleomycin)诱导的肺纤维化具有防护作用。在肝脏细胞方面,研究显示[9],GEB对肝窦状内皮细胞具有保护作用,可以改善慢性肝损伤后微循环紊乱。
本研究使用不同浓度(1μg、2μg、4μg/ml)银杏内酯B可能是抑制大鼠肝细胞荧光漂白后荧光恢复率,解释了银杏内酯B通过抑制细胞间有害物质的交换,达到抑制肝细胞凋亡及坏死的发生,实现对肝细胞的保护作用。
本研究还发现银杏内酯B对肝细胞缺氧凋亡有一定的抑制作用,但浓度之间的差异较小,原因可能有:1.缺氧中使部分肝细胞死亡,非真正凋亡,造成浓度间的差异不明显;2.注射液选择的浓度范围窄而且浓度梯度少,不能明显的看到反应结果;3.在注射剂中溶剂为聚乙二醇,该物质极难溶于水,只有在有机溶剂中才可溶,实验中需要用甲醇来稀释,对细胞有一定的毒害作用。药物作用浓度没有显现出来何种浓度的作用效果最明显,还需要进一步的研究。
综上,本研究在大鼠肝细胞胞的体外培养体系中通过缺氧建立体外凋亡模型,发现EGB对肝细胞凋亡的保护作用及可能的机制。
[1]Li K,Luo J.The role of SIRT1 in tumorigenesis N Am JMed Sci(Boston),2011,4(2):104-106
[2]陈淮军,谢笔钧,胡慰望.银杏苦内酯的化学结构及药理作用研究进展.中国药学杂志,2011,18(9):5-16
[3]高晓倩,陈芝芸,张晓苹,等.银杏叶提取物抗肝纤维化作用的研究.中华中医药学刊,2008,24(04):779-781
[4]刘熹昀,赵革新,鲍利,等.银杏内酯B对ApoE基因敲除小鼠动脉粥样硬化的影响.中国药理学通报.2011,26(01):81-84
[5]Chamberian J S ,Gibbs R A,Ranier J E,et al.Detection Screening of the Duchenne Muscular Dystrophy Locus via Multiplex DNA Amplification.Nucl AcidsRes,2000,16(05):1141-1156
[6]马丽娜,陈北冬,赵艳阳,等.银杏内酯B对内皮细胞的保护作用及分子机制研究.中国药理学通报,2013,121(02):189-193
[7]Lock R B,Mu rphy KM.Immunodetectingm ebers of the Bcl-2 family of proteins.Methoths MoMled,2013,111(03):83-96
[8]Sam F,Sawyer DB,Chang DL,et al.Progressive left ventricular remodeling and apoptosis late aftermyocardial infarction in mouse heart.Am JPhysiol Heart Circ Physiol,2000,279(10):22-38
[9]马庭芳,胡伟,于皆平,等.银杏叶提取物对实验性大鼠肝纤维化抑制作用的研究.数理医药学杂志,2003,43(05):396-398
[10]Daba MH,Abdel-Aziz A A,Moustafa AM,et al.ffects of L-carnitine and ginkgo biloba ext rat(EB761)in expermien talbleomycin-induced lung fibrosis.Pharmacol Res,2012,108(6):461-467
