解淀粉芽孢杆菌Y-S-Y12菌株对人参锈腐病的生防作用
2015-12-18金海强朴光一屈俊廷沈国娟李熙英
金海强,朴光一,屈俊廷,沈国娟,李熙英
(1.延边朝鲜族自治州农业科学研究院,吉林 龙井 133400;2.延边大学长白山生物资源与功能分子教育部重点实验室,吉林 延吉 133002;3.延边大学农学院,吉林 延吉 133002)
人参Panax ginseng C.A.Mey.为五加科药用植物。我国是人参的原产国,吉林省长白山是人参的宗主地和发祥地,人参产量占全国的80%,占世界的70%[1]。在人参(园参)种植方面,我国仍然采用伐林栽参、参后还林的栽培方式,影响长白山的森林资源和生态环境。随着国家天然林保护工程的启动,毁林栽参受到严格限制。而人参(园参)需种植4~8 a才能采收,采收后的参地10~15 a内不能重茬栽参的特点,使人参种植用地变得异常紧张。造成上述现象的主要原因与人参锈腐病Cylindrocarpon destructans等人参根部病害经常发生有直接关系。据文献报道人参锈腐病菌以厚垣孢子休眠的方式在无寄主的条件下在土壤中长期存活,致使土壤带菌,直接影响下一茬人参的种植,造成人参连作障碍[2-3]。因此,凡栽培人参的地方,人参锈腐病便成为主要威胁。
解淀粉芽孢杆菌Bacillus amyloliquefaciens与枯草芽孢杆菌B.subtilis亲缘性很高,且均为安全菌株,特性非常相似。研究表明,该类菌通过非核糖体途径合成分子量小、热稳定性好、含有D-氨基酸、耐受蛋白酶水解以及有机溶剂作用的脂肽类抗生素[4]。解淀粉芽孢杆菌通过产生低分子量抗生素以及抗菌蛋白或多肽等活性物质抑制植物病原菌,并且可作为根围细菌促进植物生长,其产抗真菌物质主要有抗真菌蛋白、伊枯草菌素、几丁质酶等[5]。而解淀粉芽孢杆菌对人参锈腐病菌抑菌作用方面未见报道。本文研究了从杨树上分离到的内生解淀粉芽孢杆菌菌株Y-S-Y12对人参锈腐病的防治作用,为人参锈腐病生物防治提供依据。
1 材料与方法
1.1 供试菌供试植物病原菌有人参锈腐病菌Cylindrocarpon destructans、人参黑斑病菌Alternaria brassicicola、人参灰霉病菌Botrytis cinerea,水稻纹枯病菌Rhizoctonia solani,杨树腐烂病菌Cytospora chrysosperma,水稻恶苗病菌Fusarium moniliforme;供试拮抗菌菌株有Y-S-Y12,YBN13,YBN18,YBN20和YBN21。根据形态特征及16S rDNA序列分析方法鉴定,Y-S-Y12菌株为解淀粉芽孢杆菌Bacillus amyloliquefaciens[6];YBN13和YBN18为芽孢杆菌属的细菌Bacillus sp.,登录号分别为JX156418和JX156419。以上植物病原菌和拮抗菌均由延边大学农学院植物病理研究室提供。
1.2 5株拮抗菌菌株及其发酵浓缩液对人参锈腐病菌菌丝生长抑制作用的室内测定
1.2.1 菌 株 选 用Y-S-Y12,YBN13,YBN18,YBN20,YBN21菌株在KB培养基上活化2 d,人参锈腐病菌在PDA平板上活化7 d。用打孔器打出直径8 mm的人参锈腐病菌菌碟,放入新的PDA平板中间,人参锈腐病菌菌碟两边10 mm处点接已活化的拮抗菌(2个点对称),每个处理重复5个培养皿,并以只接人参锈腐病菌不接拮抗菌的为对照。20℃恒温箱培养4 d,测菌落直径,计算抑菌率。
抑菌率(%)=(对照病菌菌落宽度-处理病菌菌落宽度)÷(对照病菌菌落宽度-接种时菌碟宽度)×100
1.2.2 发酵浓缩液 上述5株拮抗菌菌株用KB培养基活化培养2 d后,分别接种于200 mL KB液体培养液中,在28℃,120 r/min恒温双层摇床中振荡培养5 d后,经4000 r/min离心25 min,取上清液用直径0.22μm微孔滤膜过滤,用旋转蒸发仪浓缩至30 mL。此为拮抗菌发酵浓缩液。
抑菌活性测定采用纸片法。先PDA平板中间放入直径8 mm的人参锈腐病菌的菌碟1片,在菌碟两边10 mm处放置滴200μL拮抗菌浓缩液的滤纸2片(2片对称),以只放置人参锈腐病菌菌碟的为对照,每个处理重复5个培养皿,放入20℃恒温箱培养4 d,测人参锈腐病菌菌落直径,计算抑菌率。1.3 5株拮抗菌对人参锈腐病田间防治试验 试验地在延边大学农学院试验田(龙井),人参锈腐病发生十分严重,基本上不能种植人参。2 L的KB培 养 液 中 分 别 接Y-S-Y12,YBN13,YBN18,YBN20,YBN21拮抗菌菌株,在28℃,120 r/min恒温摇床中培养7 d后备用。人参苗移栽前(4月份),拮抗菌培养液稀释成40倍液,人参苗浸泡其中20 min,捞出移栽。试验地设12个小区,每小区面积30 m2,试验采用随机区组设计,2次重复。KB培养液的稀释液中浸泡的苗为对照。栽植人参苗的株距10 cm,行距30 cm。正常管理。10月中旬,取出3行参根调查成活率、病株率、参根的地茎、根长、根重,并取整个小区参根测小区产量。
1.4 Y-S-Y12菌株及其发酵浓缩液对6种植物病原菌菌丝生长的抑制作用选用在PDA平板中已活化培养的人参锈腐病菌、人参黑斑病菌、人参灰霉病菌、水稻纹枯病菌、水稻恶苗病菌和杨树腐烂病菌进行抑菌试验。Y-S-Y12菌株抑菌测定方法同1.2.1,发酵浓缩液制作方法和抑菌试验同1.2.2。
1.5 不同温度和pH值下Y-S-Y12菌株及其发酵浓缩液对人参锈病菌的抑菌作用
1
.5.1 不同温度
(1)Y-S-Y12菌株对病菌菌丝生长的抑制作用。Y-S-Y12菌株在KB培养基上活化培养2 d。在PDA平板中间放置直径8 mm的人参锈腐病菌的菌碟1片,在距离菌碟15 mm处接入Y-S-Y12菌株(2点对称),以只放置人参锈腐病菌菌碟的为对照,分别放置5,10,15,20,25,30℃恒温箱中培养,每个处理重复5个培养皿。培养6 d后测人参锈腐病菌菌落直径,并计算抑菌率。
(2)Y-S-Y12菌株的发酵浓缩液对病菌菌丝生长的抑制作用。在PDA平板中间放置直径8 mm的人参锈腐病菌的菌碟1片,在距离菌碟15 mm处放置滴Y-S-Y12菌株的发酵浓缩液200μL的滤纸2片(2片对称),以只放置人参锈腐病菌碟的为对照,每个处理重复5个培养皿,分别放置5,10,15,20,25,30℃恒温箱中培养。培养6 d后测人参锈腐病菌菌落直径,并计算抑菌率。
(3)Y-S-Y12菌株的发酵浓缩液对病菌分生孢子萌发的抑制作用。在PDA培养基上培养12 d的人参锈腐病菌菌落制成孢子悬浮液(每个视野大约100孢子),并测500个孢子中的孢子萌发率(处理前的萌发率)。取0.2 mL人参锈腐病菌孢子悬浮液和0.2 mL Y-S-Y12菌株的发酵浓缩液的混合液滴入凹玻片中,0.2 mL人参锈腐病菌孢子悬浮液和0.2 mL KB培养液的混合液为对照,分别放置5,10,15,20,25,30℃恒温箱中培养。8 h后,用显微镜观察不同处理中的500个孢子中的孢子萌发数,并计算萌发率和孢子萌发抑制率。
萌发标准:芽管长度以超过孢子短直径长度1/3为已萌发孢子。
孢子萌发抑制率(%)=[对照组孢子萌发率(8 h)-处理组孢子萌发率(8 h)]÷(对照组孢子萌发率(8 h)-处理前孢子萌发率)×100
1.5.2 不同pH值
(1)Y-S-Y12菌株对病菌菌丝生长的抑制作用。分别配制pH值为5,6.18(未调pH的PDA培养基,以下相同),7,9,11的PDA培养基。具体抑菌试验方法见1.5.1中的(1),放入20℃恒温箱中培养。
(2)Y-S-Y12菌株的发酵浓缩液对病菌菌丝生长的抑制作用。分别配制pH值为5,6,7,9,11的PDA培养基。具体抑菌试验方法见1.5.1中的(2),放入20℃恒温箱中培养。
1.6 数据统计与分析采用Excel软件对试验数据进行汇总和单因素方差分析。
2 结果与分析
2.1 不同拮抗菌菌株及其发酵浓缩液对人参锈腐病菌菌丝生长的抑制作用5株拮抗菌菌株对人参锈腐病菌菌丝生长的抑菌率均在85%以上,其中Y-S-Y12菌株的抑菌率最高,达到95.13%;其次为YBN13和YBN18,其抑菌率分别为91.39%和90.26%。5株拮抗菌株的发酵浓缩液对人参锈腐病菌菌丝生长均具有较强的抑菌活性,其抑菌率均为50%以上。其中Y-S-Y12菌株的发酵浓缩液抑菌率为69.41%,抑菌活性显著高于其它拮抗菌发酵浓缩液;其次为YBN13发酵浓缩液,抑菌率为62.65%;再次为YBN18、YBN21发酵浓缩液,并两者之间没有显著性差异(表1)。
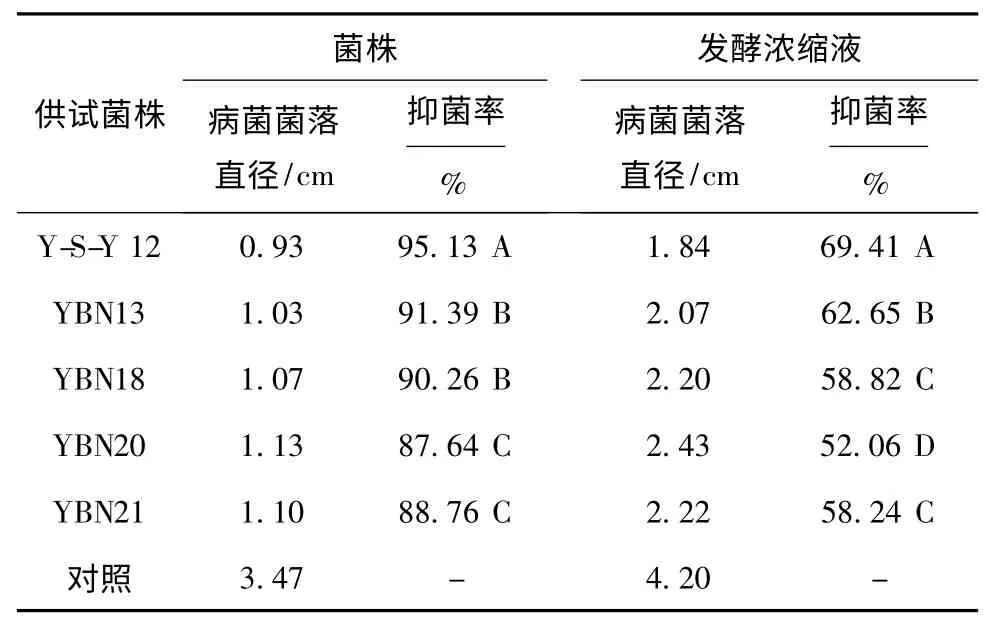
表1 拮抗菌菌株及其发酵浓缩液对人参锈腐病菌菌丝的抑制效果
2.2 拮抗菌菌株防治人参锈腐病田间效果
2.2.1 不同拮抗菌株对人参锈腐病病情指标的影响 对人参苗成活株数和锈腐病病株数进行方差分析,处理间差异均达到了极显著水平[F成活株数=147.63 > F0.01(2,6)=10.92;F病株数=147.63 >F0.01(2,6)=10.92]。对此进行了多重比较,用拮抗菌菌株处理的人参苗成活株数显著多于对照,其中用Y-S-Y12菌株处理的人参植株成活数最多,成活率为92.73%;其次为YBN18和YBN13,成活率分别为83.64%和82.73%,并它们之间没有显著差异;再次为YBN20,成活率75.45%;YBN21处理的人参苗成活数最少,成活率仅为48.18%。
对照的人参苗病株显著多于处理的,Y-S-Y12菌株、YBN13菌株和YBN18菌株处理的人参苗病株数显著少于其它处理,并它们之间没有显著性差异,防效分别为75.79%,73.68%,73.68%;其次为YBN20,防效为52.63%;YBN21菌株处理的病株数较多,防效仅为34.74%(表2)。
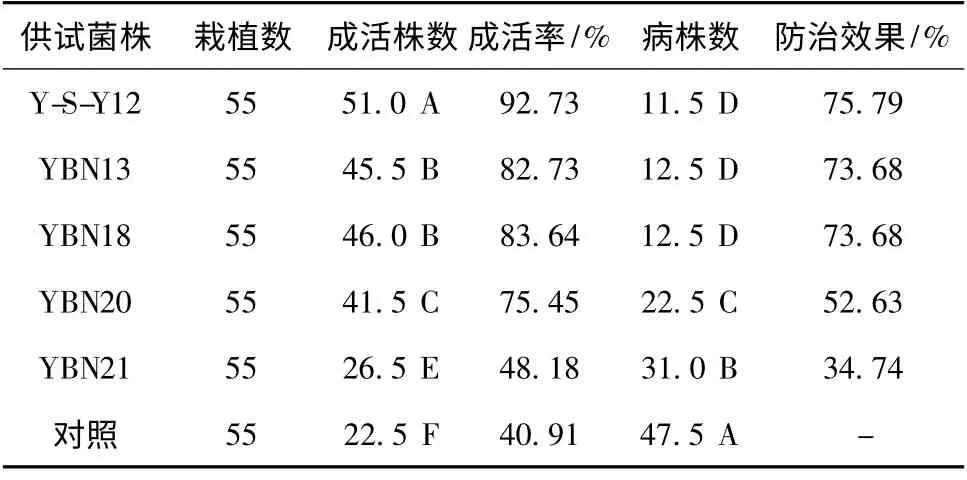
表2 人参锈腐病用不同拮抗菌株防治后的病情指标(2012年)
2.2.2 不同拮抗菌处理对人参产量的影响 对人参根茎、根长和小区产量进行方差分析,处理间差异均达到极显著水平[F根茎=21.17>F0.01(2,6)=10.92;F根长=147.63>F0.01(2,6)=10.92;F小区产量=109.42>F0.01(2,6)=10.92]。对此进行了多重比较,Y-S-Y12和YBN13处理的人参根茎最粗;其次为YBN18和YBN20;YBN21处理的人参根茎与对照没有显著性差异。
不同拮抗菌株处理的人参根长之间具有显著性差异,其中Y-S-Y12、YBN13和YBN18处理的人参根最长,并它们之间没有显著性差异;其次为YBN20和YBN21,它们之间也没有显著性差异。
不同拮抗菌株处理的试验小区人参产量显著高于对照,其中Y-S-Y12和YBN18处理小区人参产量最多,并它们之间没有显著性差异;其次为YBN13;再次为YBN20。
从人参单根重上看,用Y-S-Y12,YBN13,YBN18,YBN20菌株处理的人参单根重明显多于对照,其中Y-S-Y12处理的人参单根重比对照增多25.95%;其次为YBN13,比对照增多21.79%;再次为YBN18,比对照增多14.99%。说明这几种拮抗菌对人参根生长有明显的促进作用(表3)。

表3 不同拮抗菌处理后的人参产量指标(2012年)
2.3 Y-S-Y12菌株及其发酵浓缩液对6种植物病原菌菌丝生长的抑制作用Y-S-Y12菌株与植物病原菌的室内对峙培养结果显示,Y-S-Y12菌株对供试的6种植物病原菌均具有很强的抑制作用。其中对杨树腐烂病菌抑菌率最高,达到100%;其次是对人参锈腐病菌和人参灰霉病菌,抑菌率达到96%和95.44%;再次是对人参黑斑病菌,抑菌率94.19%;对水稻恶苗病菌的抑制率最低,只有88.86%。
Y-S-Y12菌株的发酵浓缩液对供试的6种植物病原菌均具有较强的抑菌作用。其中对水稻纹枯病菌的抑菌率最高,达到78.73%;其次为对杨树腐烂病菌、人参锈腐病菌和人参灰霉病菌的抑菌率,分别达到了68.23%,67.94%,67.34%;对水稻恶苗病菌的抑菌率最低,仅为47.59%(表4)。

表4 拮抗菌Y-S-Y12菌株及其发酵浓缩液对6种植物病原菌菌丝生长的抑制作用
2.4 不同温度和pH条件下Y-S-Y12菌株及发酵浓缩液对人参锈腐病菌的抑菌作用
2.4.1 不同温度 10~30℃条件下Y-S-Y12菌株对人参锈腐病菌菌丝生长均有抑制作用。其中20℃时的抑菌作用最强,抑菌率为91.46%;其次为25℃,其抑菌率83.63%;再次为15℃和30℃,其抑菌率分别为74.61%和76.47%。但30℃时人参锈腐病菌菌丝生长已受到严重抑制,5℃时人参锈腐病菌停止生长,不能表现拮抗菌株的抑菌作用。说明20℃左右的条件下,Y-S-Y12菌株对人参锈腐病菌具有较强的抑菌作用。
随着温度的增高Y-S-Y12菌株的发酵浓缩液对人参锈腐病菌的抑菌作用呈抛物线增加趋势,20~25℃时对人参锈腐病菌菌丝生长抑制作用最强,其抑菌率在69.31%~69.45%;30℃时抑菌率急剧下降,只有5.88%(表5)。

表5 不同温度下Y-S-Y12对人参锈腐病菌菌丝生长的抑制
在20℃条件下Y-S-Y12菌株的发酵浓缩液对人参锈腐病菌孢子萌发抑制作用最强,其抑制率为81.69%。其次是15℃和25℃,抑制率分别为63.27%和65.71%(表6)。

表6 不同温度条件下Y-S-Y12菌株发酵浓缩液对人参锈腐病菌孢子萌发的抑制作用
2.4.2 不同pH值 Y-S-Y12菌株在pH6.18时(在未调pH值的PDA培养基)对人参锈腐病菌菌丝生长抑制作用最强,抑菌率92.50%;其次为pH7,pH9,pH11,抑菌率为82.24%~84.48%;pH5时的抑菌作用较差,抑菌率78.21%。说明偏酸性条件下,Y-S-Y12菌株对人参锈腐病菌的抑菌作用最强。
在pH5~7的偏酸性条件下,Y-S-Y12菌株的发酵浓缩液对人参锈腐病菌菌丝生长抑制作用最强,其抑菌率为68.59%~69.38%;在碱性条件下抑菌率有下降趋势(表7)。

表7 不同p H值条件下Y-S-Y12菌株及其发酵浓缩液对人参锈腐病菌菌丝生长的抑制作用
3 讨论
解淀粉芽孢杆菌在其自身的生长过程中可以产生一系列的代谢产物,这些代谢产物具有抑制真菌和细菌的活性[7],但未见有关人参病害防治方面的应用报道。本研究采用杨树中分离得到的内生解淀粉芽孢杆菌菌株Y-S-Y12及其发酵浓缩液进行室内抑菌试验的结果表明,对人参锈腐病菌菌丝生长抑菌率分别为95.13%和69.41%;Y-S-Y12菌株发酵液(含活菌)田间防病试验结果为人参苗成活率比对照增加了51.82%,对锈腐病的防效75.79%,小区人参产量比对照增加了154.73%。
据报道解淀粉芽孢杆菌对多种植物病原菌具有较强的抑菌作用,如抑制花生青枯病菌、柑橘绿霉菌、水稻细菌性条斑病、对香蕉枯萎病病原菌、辣椒疫霉菌、根癌土壤杆菌、稻瘟病菌和野油菜黄单胞杆菌野油菜致病变种等[8-12]。研究Y-S-Y12菌株及发酵浓缩液的抑菌谱结果显示,对供试的6种植物病原菌菌丝生长均具有较强的抑制作用。其中YS-Y12菌株对杨树腐烂病菌和人参锈腐病菌的抑制作用最强,其抑菌率分别为100%和96%;其发酵浓缩液对供试的6种植物病原菌均具有较强的抑菌作用,其中对水稻纹枯病菌的抑菌作用最强,其抑菌率为78.73%。
生防菌剂施用于田间后的温度、pH等生态因子都会严重影响生防菌的定殖、存活及有效性。本试验显示,在10~30℃条件下Y-S-Y12菌株及其发酵浓缩液对人参锈腐病菌均具有抑菌作用,其中20℃条件下的抑菌作用最强,菌株对菌丝生长的抑菌率为91.46%;发酵浓缩液对菌丝生长和孢子萌发的抑菌率分别为69.45%和81.69%。这与陈成 等[13]的40℃以下解淀粉芽孢杆菌菌株的抑菌活性最强的结果不吻合。在pH 5~11范围内,Y-S-Y12菌株及发酵浓缩液对人参锈腐病菌均具有抑菌作用,其中pH6.18的微酸性条件下的菌丝生长抑菌作用最强,抑菌率分别为92.50%和69.38%,这与陈成等[13]的pH在7~8范围内解淀粉芽孢杆菌菌株的抑菌活性最强的结果也不吻合。本文中的Y-S-Y12菌株对人参锈腐病菌抑菌活性最强的温度和pH值均与人参锈腐病菌适合生长的温度和pH值[14-15]相吻合,这可能是Y-S-Y12菌株对人参锈腐病的防效较高的主要原因之一。
[1] 张崇禧,郑友兰,孙立诚,等.吉林人参产业及科研的现状和特点[J].人参研究,2001,13(2):5-8.
[2] 白容霖.我国人参锈腐病综合防治研究进展[J].植物保护,1990(2):40-43.
[3] Sun Ick Kim.Characteristics of occurrence and cultural,chemical control of Ginseng root rot[D].South Korea:Chungnam National University,2006:5-7.
[4] Yoshida S,Hiradate S,Tsukamoto T,et a1.Antimicrobial activity of culture filtrate of Bacillus amyloliquefaciens RC-2 isolated from mulberry leaves[J].Phytopathology,2001,91:181-187.
[5] Chen X H,Koumoutsi A,Scholz R,et al.Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42[J].Nature Biotechnology,2007,25:1007-1014.
[6] 金海强,贾斌,李熙英.杨树腐烂病内生拮抗细菌鉴定及防治研究[J].中国森林病虫,2012,31(6):1-4.
[7] 权春善,王军华,徐洪涛,等.一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J].微生物学报,2006,46(1):7-12.
[8] 王小兵,骆永明,刘五星,等.花生青枯病内生拮抗细菌的鉴定、抗菌活性及其田间防效[J].中国生物防治学报,2011,27(1):88-92.
[9] 郝卫宁,李辉,胡美英,等.柑橘绿霉病拮抗细菌的筛选、鉴定及其抑制效果[J].中国生物防治学报,2011,27(2):284-288.
[10] 张荣胜,刘永锋,陈志谊.水稻细菌性条斑病菌拮抗细菌的筛选、评价与应用研究[J].中国生物防治学报,2011,27(4):510-514.
[11] 胡伟,赵兰凤,张亮,等.香蕉枯萎病生防菌AF11的鉴定及其定殖研究[J].中国生物防治学报,2012,28(3):387-393.
[12] 杨瑞先,陶玉凤,宋美仙,等.银杏内生细菌防治辣椒疫病研究[J].中国生物防治学报,2012,28(4):552-559.
[13] 陈成,崔堂兵,于平儒.一株抗真菌的解淀粉芽孢杆菌的鉴定及其抗菌性研究[J].现代食品科技,2011,27(1):36-39.
[14] 高书砚,王永发.人参锈腐病菌(Cylindrocarpon destructans)生物学特性的初步研究[J].吉林农业大学学报,1989(1):28-32.
[15] 贾斌,金海强,赵贞丽,等.人参锈腐病菌产孢条件研究[J].中国森林病虫,2013,32(1):1-3.
