耐高温马克斯克鲁维酵母菌剂固体发酵工艺优化
2015-12-17刘晓红缪礼鸿
陈 瑾,陈 丹,刘晓红,缪礼鸿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
耐高温马克斯克鲁维酵母菌剂固体发酵工艺优化
陈瑾,陈丹,刘晓红,缪礼鸿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
摘要:以干燥菌剂中的活菌数为指标,通过单因素实验和正交实验对耐高温马克斯克鲁维酵母HY32-1的固体发酵工艺进行优化。结果表明,最佳培养基为:以麸皮97.3%、糖蜜1%、酵母粉0.5%、脱脂奶粉0.5%,尿素0.1%、KH2PO40.5%、MgSO4·7H2O 0.1%为发酵基质,并采用3倍浓度YPD加富培养液代替固体发酵培养基中20%水分。菌剂的最佳发酵和制备条件为:发酵时间30 h、发酵温度37 ℃、培养基含水率50%,发酵后干燥温度45 ℃。优化后所制备的HY32-1固体菌剂活菌数高达 3.7×108cfu/g,比优化前的活菌数提高了77.9%。
关键词:马克斯克鲁维酵母;固体发酵;工艺优化
1引言
马克斯克鲁维酵母(Kluyveromycesmarxianus)是目前研究较为广泛的一种非传统酵母,因其耐高温、生长速率快、底物谱广等诸多优势而越来越多地应用于工业生物技术领域[1-2]。此外,马克斯克鲁维酵母还可以利用菊粉类原料、乳清、糖蜜以及木糖等多种非粮底物生产乙醇,是一种具有潜力的生物乙醇发酵菌株[3-5]。在发酵工艺方面,固态发酵由于其具有能耗低、废液少、产品分离成本低、不存在二次污染、发酵条件相对比较开放、设备要求简单等优点,被广泛用于生物农药、农副产品的综合利用以及酶制剂生产等方面[6-7]。因此,笔者对耐高温马克斯克鲁维酵母菌固体发酵条件及菌剂制备工艺进行了研究,为该菌种的应用提供了良好基础。
2材料与方法
2.1 材料
2.1.1实验菌种
耐高温马克斯克鲁维酵母HY32-1,由本实验室分离和保存。
2.1.2培养基
酵母菌种子液培养基:采用YPD培养基[8]。
基础发酵培养基:麸皮:97.3%(w/w)、糖蜜1%、酵母粉0.5%、脱脂奶粉0.5%,尿素0.1%、KH2PO40.5%、MgSO4·7H2O 0.1%。
加富发酵培养基:在基础发酵培养基的基础上分别用3倍、5倍浓度的YPD(蔗糖代替葡萄糖)代替培养基中20%水分,其它成分不变。
根据试验配方称取发酵培养基原料装入250 mL三角瓶中,装料量为100 g,121℃灭菌25min,冷却至室温备用。
2.2 实验方法
2.2.1酵母菌活化
将实验室保存的马克斯克鲁维酵母HY32-1接种于YPD固体培养基活化培养36 h,再转接至YPD液体培养基中,37 ℃恒温摇床170 r/min培养24 h。
2.2.2马克斯克鲁维酵母生长曲线的绘制
挑取YPD平板上的马克斯克鲁维酵母单菌落,接种至100 mL YPD液体培养基中,37 ℃恒温摇床170 r/min培养,每隔2 h取样,用分光光度计在600 nm波长条件下测定OD值,并绘制马克斯克鲁维酵母生长曲线。
2.2.3马克斯克鲁维酵母固体菌剂的制备工艺
将马克斯克鲁维酵母种子液按10%接种量接种到固体发酵培养基中,37 ℃静置培养30 h后,置45 ℃鼓风干燥箱中,干燥至含水率为12%左右时取样测定样品的活菌数。以每克发酵干料中测定的活菌计数,单位为cfu/g。
2.2.4单因素试验
单因素试验分别考察培养基组成及水分、发酵时间、干燥温度、干燥后菌剂的最终含水率对活菌数的影响等。
2.2.5正交试验
根据单因素的试验结果,选择发酵时间、含水率、培养基进行3因素2水平的正交试验,以活菌数为指标,确定马克斯克鲁维酵母菌剂的最佳发酵工艺参数。
表1正交试验因素与水平

水平A发酵时间/hB含水率/%C加富13045不加富240503倍
2.2.6酵母菌计数
酵母菌总菌数计数采用血球计数板技术法;活菌数计数采用稀释平板涂布法测定[8]。
酵母菌剂的复活条件及测数方法:实验组干燥后菌剂样品加至1%蔗糖水中,于37 ℃摇床170 r/min复活30 min;空白组干燥后菌剂样品加至无菌水中,于37 ℃摇床170 r/min培养30 min。分别取样测定样品酵母菌活菌数。
3结果与分析
3.1 马克斯克鲁维酵母生长曲线的绘制
马克斯克鲁维酵母HY32-1生长曲线如图1所示,其中0—4 h为延滞期,此时期酵母菌繁殖缓慢,所以OD值较低;4—10 h为生长对数期,此时期酵母菌生长繁殖旺盛,有较高的代谢活力;10—12 h为稳定期,此时期菌体数量保持平稳或略有增加。因此,选择发酵时间为10—12h的菌液作为固体发酵的种子液。

图1 马克斯克鲁维酵母 HY32-1生长曲线
3.2 发酵时间与发酵温度对活菌数的影响
按10%的接种量将HY32-1种子液接种于基础培养基中,混匀后分别在37 ℃和40 ℃下培养20 h、25 h、30 h和35 h,结果见图2。由图2可知,37 ℃培养时的酵母菌活菌数明显比40 ℃下培养的活菌数高;并且随着发酵时间的延长,活菌数总体上呈上升趋势。结合发酵的效率性,选择发酵温度为37 ℃,发酵时间为30 h。

图2 发酵时间和温度对酵母菌活菌数的影响
3.3 培养基及菌剂含水率对酵母菌活菌数的影响
分别接种10%酵母菌种子液至含水率为45%和50%的基础培养基中,37 ℃培养30 h后分别置40 ℃、42 ℃下干燥,干燥后的活菌数测定结果见表2。由表2可知,培养基含水率为50%、干燥温度为42 ℃时制备的菌剂活菌数最高。一般保存菌剂含水率在10%左右,当含水率低于5%时菌体会难以生存。
表2干燥温度对菌剂中活菌数的影响/×108cfu·g-1

样品编号含水率/%活菌数(干基)新鲜发酵料1号47.49.5922号51.210.45140℃干燥1号7.60.6982号8.00.57642℃干燥1号9.30.8002号9.51.055
注:1号含水率45%;2号:含水率50%。
3.4 干燥温度、时间及复活条件对菌剂活菌数的影响
按10%接种量将酵母种子液与基础固体发酵培养基混匀,于37 ℃发酵30 h后,分别于42 ℃、45 ℃干燥,每隔1 h测一次活菌数及含水率。由图3可知:随着干燥时间的延长培养基的含水率逐渐降低,相同的干燥时间内42 ℃干燥后的含水率比45 ℃干燥后高。由图4可知:45 ℃干燥后活菌数比42 ℃干燥后高,用1%蔗糖水复活的实验组活菌数比空白对照组高。干燥温度45 ℃,干燥时间1 h、复活30 min时酵母菌剂的活菌数最高。
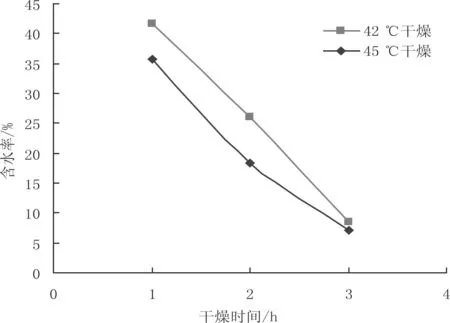
图3 培养基含水率与干燥温度和干燥时间的关系

图4 培养基含水率对活菌数的影响
3.5 加富培养对活菌数的影响
基础固体发酵培养基中分别用3倍、5倍YPD(蔗糖代替葡萄糖)培养液代替20%的水分,另一组为不加富的空白对照,接种量均为10%,37 ℃培养30 h,每隔15 h搅拌一次。发酵结束后在45 ℃干燥,测活菌数(1%蔗糖水复活,条件同上),所得结果如表3。由表3可知:加富5倍>加富3倍>不加富的对照,表明加富培养基能够有效提高酵母菌的活菌数,但考虑到培养基成本,选择3倍加富培养基进行正交试验。
表3基础培养基加富对活菌数的影响/×108cfu·g-1

试验号新鲜发酵品含水率/%活菌数(干基)试验号干燥品含水率/%活菌数(干基)0(CK)52.195.5430(CK)13.441.4213倍加富50.808.1303倍加富13.232.0805倍加富51.788.3995倍加富11.764.080
3.6 正交试验
采用L4(23)正交试验(表4)进一步优化发酵条件中发酵时间、含水率、加富,试验水平分别为发酵时间:30 h、40 h;含水率:45%、50%,YPD加富0倍(CK)、3倍,得到更优组合。由结果分析可知:试验的最优方案为A1B2C2,即发酵时间30 h,含水率50%,加富3倍,并且各因素的影响程度为:含水率>加富培养>发酵时间。

表4 正交试验 /×108 cfu·g-1
采用优化的条件A1B2C2培养酵母,即基础固体发酵培养基中加入3倍浓度YPD(蔗糖代替葡萄糖)代替20%水分、含水率50%,37 ℃培养30 h后45 ℃干燥至含水率为12%左右时,测得酵母菌的活菌数为3.7×108cfu/g(干基),比优化前的活菌数(2.08×108cfu/g)提高了77.9%。
4结论
通过单因素试验和正交试验,对耐高温马克斯克鲁维酵母HY32-1固体发酵条件的优化结果为:在含水率为50%条件下37 ℃下发酵30 h,然后在45 ℃条件下最终干燥至含水率为12%左右。适宜的固体发酵培养基各营养成分质量分数分别为:麸皮97.3%、糖蜜1%、酵母粉0.5%、脱脂奶粉0.5%、尿素0.1%、KH2PO40.5%、MgSO4·7H2O 0.1%、3倍YPD(蔗糖代替葡萄糖培养液代替20%水分。培养结束后马克斯克鲁维酵母HY32-1的活菌达到3.7×108cfu/g,比优化前的活菌数提高了77.9%。
参考文献:
[1]高教琪,韩锡铜,孔亮,等.马克斯克鲁维酵母在工业生物技术中的应用[J].中国生物工程杂志,2014,34(2):109-117.
[2]李新玲,顾瑞霞,闫辉,等.马克斯克鲁维酵母的筛选鉴定与应用[J].中国奶牛,2013,15:44-46.
[3]Savitree L,Chutima S,Wichien Y.Production of fuel ethanol at high temperature from sugar cane juice by a newly isolatedKluyveromycesmarxianus[J].Bioresource technology,2007(12):3367-3374.
[4]Naveen K Pessani,Hasan K Atiyeh,Mark R Wilkins,et al.Simultaneous saccharification and fermentation of Kanlow switchgrass by thermotolerantKluyveromycesmarxianusIMB3:The effect of enzyme loading,temperature and higher solid loadings[J]. Bioresource technology,2011(22):10618-10624.
[5]陈文静,柏永昊,缪礼鸿,等.一株马克斯克鲁维酵母菌的生长及酒精发酵特性分析[J].中国酿造,2013(7):77-81.
[6]韩冰,王莉,李十中,等. 先进固体发酵技术 (ASSF) 生产甜高粱乙醇[J].生物工程学报,2010,26(7): 966-973.
[7]谷军,张晓彦,原韬,等.生防用枯草芽孢杆菌固态发酵工艺的研究[J].生物技术,2013,23( 1):86-89.
[8]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
Optimization of the solid-state fermentation process for the multiplication of a thermotolerantKluyveromycesmarxianusstrain
CHENJin,CHENDan,LIUXiao-hong,MIAOLi-hong
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023,China)
Abstract:In order to improve the production of active cells by Kluyveromyces marxianus HY-32, the proportion of medium component and the treatment conditions were optimized by single factor test and orthogonal test. The result showed that, a maximal yield of cell amount could be obtained in the enrichment medium, which contains 96.4% wheat bran, 1% molasses, 0.5% yeast extract, 0.1% urea, 0.5% KH2PO4, 0.1% MgSO4·7H2O, and with 20% moisture replaced by three times YPD medium. The best treatment conditions were as follows: fermentation temperature 37 ℃, medium moisture 50%, culture time 30 h and drying at 45 ℃. Compared with the initial conditions, the optimized medium and treatment process resulted in a 77% increase in the active cells, which improved from 2.08 × 108cfu / g to 3.7 × 108cfu / g.
Key words:Kluyveromyces marxianus;solid-state fermentation;process optimisation
DOI:10.3969/j.issn.2095-7386.2015.02.003
文章编号:2095-7386(2015)02-0010-04
通信作者:胡中泽(1968-),男,教授,E-mail: huzz1968@126.com.
作者简介:牛芳(1990-),女,硕士研究生E-mail: 1239686554@qq.com.
收稿日期:2015-01-28.
中图分类号:TQ 939.97
文献标识码:A
