1-十一烯酰溶血磷脂的选择性合成与表征
2015-12-17刘杨静胡志雄余小波齐玉堂张维农
刘杨静,胡志雄,2,余小波,齐玉堂,张维农,2
(1. 武汉轻工大学 食品科学与工程学院,湖北 武汉 430023; 2. 农产品加工湖北省协同创新中心,湖北 武汉 430023)
1-十一烯酰溶血磷脂的选择性合成与表征
刘杨静1,胡志雄1,2,余小波1,齐玉堂1,张维农1,2
(1. 武汉轻工大学 食品科学与工程学院,湖北 武汉 430023; 2. 农产品加工湖北省协同创新中心,湖北 武汉 430023)
摘要:旨在建立一种选择性合成1-十一烯酰溶血磷脂的有效方法与途径。二丁基氧化锡与甘油磷脂酰胆碱形成复合物,在异丙醇溶剂体系中与十一烯酰氯反应,选择性合成得到1-十一烯酰溶血磷脂。产物纯化后经高效液相色谱、红外光谱、电喷雾电离质谱等手段进行表征。产物经表征后确证为1-十一烯酰溶血磷脂,且反应的选择性可达90%以上。该方法成本低廉、操作简便、条件温和、易纯化且得率高,所得产物1-十一烯酰溶血磷脂的结构中含有“点击反应”活性的端烯基,在生物、医药、高分子、材料等领域中具有重要应用价值与潜力。
关键词:1-十一烯酰溶血磷脂;合成;甘油磷脂酰胆碱;二丁基氧化锡
1引言
磷脂是构成生物膜的主要物质,也是生命的基础物质之一[1~3]。溶血磷脂是由磷脂分子中一个酰基链被水解成羟基后得到的产物,分为1-脂肪酰-2-溶血磷脂和2-脂肪酰-1-溶血磷脂两类。溶血磷脂具有与磷脂类似的化学性质,例如良好的乳化性、增溶性等,可广泛用于食品、化妆品、农用化学品、医药等行业[4~5]。此外,作为生物膜中的第二信使,溶血磷脂具有多种生物活性[6~7],在许多的生理过程如血管形成[8]、中枢神经系统的运转[9]、繁殖过程[10]等均起着十分重要的作用。然而,溶血磷脂在生物膜中的含量极低,从生物膜中分离提取溶血磷脂非常困难,目前主要采用生物酶解法或化学法合成。酶法合成具有定位性强、反应条件温和、化学试剂使用少、反应副产物少等优点[11],但磷脂酶水解过程影响因素较多[12~14],反应条件难以控制且酶制品成本较高,不适于规模化制备高纯度溶血磷脂。
化学合成法成本较低,且原料较易得到,因而具有一定优势,目前合成溶血磷脂的起始原料主要有D-甘露醇、环氧丙烷、甘油酸等,这些合成路线过程冗长、步骤复杂,得率较低。最近,以甘油磷脂酰胆碱(GPC)为起始原料的反应路线受到广泛关注,该方法可合成出构型与天然溶血磷脂一致的溶血磷脂,还可根据需要灵活调节脂肪酰链的长度。但是,由于GPC在常见有机溶剂中溶解度较低,所以选择合适的溶剂与催化剂体系对于合成溶血磷脂非常关键。Chada等[15]以GPC为原料、氯化镉为催化剂,在DMF或其他极性溶剂中合成得到1-脂肪酰-2-溶血磷脂,但该方法中所用的催化剂为重金属元素化合物,排放到环境中不易降解而在食物链中富集[16]。
笔者以GPC为起始原料,在二丁基氧化锡/异丙醇催化反应体系中对1-十一烯酰溶血磷脂的合成进行了探索,并通过高效液相色谱、红外光谱、电喷雾电离质谱对产物进行了表征。目标产物1-十一烯酰溶血磷脂结构中具有端烯基,可以发生巯基-烯类“点击化学”反应,有望在食品、医药、生物、高分子、材料等领域中拓展溶血磷脂的应用价值与潜力,相关类型化合物的合成国内尚未见报道,笔者将为相关溶血磷脂的合成提供可靠的途径与方案。
2材料与方法
2.1 实验材料与试剂
甘油磷脂酰胆碱L-α-Glycerophosphorylcholine(纯度99%)购自湖北康宝泰精细化工有限公司;二丁基氧化锡DBTO(纯度99%)、十一烯酰氯(纯度98%)均购自上海晶纯实业有限公司;异丙醇、三乙胺、正庚烷、丙酮、乙酸均为分析纯试剂;甲醇为美国Merk公司色谱级试剂;正己烷、异丙醇均为天津市科密欧化学试剂有限公司色谱级试剂;实验所用水均为二次蒸馏水。
2.2 主要仪器与设备
DF-101S集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂),SK3300超声波清洗器(上海科导超声仪器有限公司),旋转蒸发器RE52CS、恒温水浴锅B-220、SZ-93自动双重纯水蒸馏器(上海亚荣生化仪器厂),LC-20AT型号高效液相色谱仪(日本岛津公司)配有Alltech ELSD 2000ES蒸发光散射检测器(美国GRACE公司)及WSK-A全自动空气发生器(天津津分分析仪器有限公司),NEXUS670傅里叶红外光谱仪(美国尼高力仪器有限公司),Thermo LTQ XL 高效液相串联离子阱质谱仪(美国Thermo公司)。
2.3 实验方法
2.3.11-十一烯酰溶血磷脂的合成
取1 g GPC(3.9 mmol)与1.065 g二丁基氧化锡DBTO(4.3 mmol)于100 mL单口圆底烧瓶中,加入40 mL异丙醇后搅拌均匀。装上回流冷凝管,在85 ℃水浴下搅拌回流处理3 h,然后将混合溶液冷却至25 ℃,逐滴加入三乙胺TEA(0.65 mL)与0.952 8 g十一烯酰氯(4.7 mmol),加料完毕后继续室温下反应1 h。
2.3.2产物的分离纯化
反应完成后,向反应液中加入水/正庚烷(40/40,mL)两相体系进行萃取,弃去上层油相,醇水相继续使用正庚烷(25 mL)萃取三次,然后真空旋蒸挥干溶剂,向残留物中加入少量丙酮进行溶解,然后置于2—8 ℃的冰箱中进行重结晶,弃去上层丙酮清液,重结晶产物置于真空干燥箱中干燥即得产物。
2.3.3产物的高效液相色谱法(HPLC)分析
纯化后的1-十一烯酰溶血磷脂与GPC经甲醇溶解后,配制成浓度为1.7 mg/mL的甲醇溶液,在岛津LC-20AT型高效液相色谱仪上进行HPLC分析,检测器为Alltech ELSD 2000ES蒸发光散射检测器(美国GRACE公司)并配备WSK-A全自动空气发生器(天津津分分析仪器有限公司),蒸发光散射检测器内漂移管温度设定为80 ℃、空气流速为2.2 L/min。色谱条件:Diol二醇基硅胶色谱柱(4.6 mm×250 mm,5 μm),流动相A:正己烷/异丙醇/乙酸/三乙胺=84.4/14/1.5/0.08 (体积比),流动相B:异丙醇/水/乙酸/三乙胺=84.4/14/1.5/0.08 (体积比),二元梯度洗脱模式下0—25 min内由60%A+40%B梯度变化至100%B,然后使用100%B等度洗脱20 min,流动相流速为0.8 mL/min,进样量为5 μL。
2.3.4产物的表征
产物经分离纯化及干燥处理后,使用红外光谱、质谱进行表征。取适量样品与KBr碾磨压片,使用NEXUS670傅里叶红外光谱仪进行透射扫描,扫描范围为400—4 000 cm-1,扫描次数为16。产物的电喷雾质谱(electrospray ionization mass spectrometry,ESI-MS)分析采用直接进样进行测定,注射器流速为10 μL/min,喷雾电压为4.5 kV,离子源类型为正离子源,扫描范围为m/z50—600。
3结果与讨论
3.1 反应机理
以具有与天然溶血磷脂相同手性结构的GPC为起始原料,将GPC经DBTO活化后,在异丙醇中经酰氯酯化制备溶血磷脂。由于GPC与DBTO配合物的反应活性优于异丙醇,并在离去时由于空间位阻效应主要生成1位酰化产物,从而具有较好选择性。当采用十一烯酰氯作为酰化试剂时,所得产物为1-十一烯酰溶血磷脂,其反应机理如图1所示。
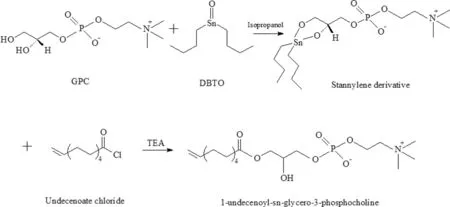
图1 1-十一烯酰溶血磷脂的反应机理图
3.2 1-十一烯酰溶血磷脂的合成与纯化
二丁基氧化锡(DBTO)在邻二醇衍生物的选择性合成中有着广泛应用,如Michael等[17]将其用于邻二醇的选择性磺酰化合成中;Wagner等[18]将其用于糖衍生物的选择性催化合成中。1-十一烯酰溶血磷脂的合成过程中,GPC与DBTO复合物的形成对于终产物的得率影响非常大,而GPC在常见的非极性溶剂中溶解性较差,所以相应得率也会很低,如在特丁基甲醚、甲苯中按方法2.3.1反应时,其转化率只有3%—12%左右,而在甲醇、异丙醇中反应,其转化率可达42%和90%以上,甲醇作溶剂时的转化率相对较低的原因可能是在酯化反应时会与GPC的烷基锡缩合物发生竞争作用。进一步采用其它常见溶剂试验,结果表明,转化率的大小顺序为:氯仿<乙腈<二氯甲烷<四氢呋喃<二甲亚砜,转化率均小于25%,故本实验选择异丙醇作为溶剂效果最佳。
常见用于酯化反应的脂肪酸衍生物主要有羧酸、酰氯、酸酐、甲酯等,本实验以十一烯酸、十一烯酰氯为原料按方法2.3.1进行反应,结果表明十一烯酸无法得到目标产物,即使采用4-二甲氨基吡啶(DMAP) 代替三乙胺作催化剂,同样没有改善。反应混合物采用水/正庚烷两相体系进行萃取时,产物1-十一烯酰溶血磷脂由于极性较强,主要分配于醇水相中,DBTO及过量酰氯与异丙醇生成的十一烯酸异丙醇酯主要分配于正庚烷相中,经多次萃取及丙酮重结晶后即可得到纯度较高的1-十一烯酰溶血磷脂。
3.3 1-十一烯酰溶血磷脂的HPLC分析
GPC与溶血磷脂类物质结构中无生色团,在紫外光区的吸收非常弱,尽管1-十一烯酰溶血磷脂分子结构中含有一个烯键,但采用紫外检测器进行检测时灵敏度仍不理想,故本实验采用高灵敏的通用型蒸发光散射检测器进行检测,经优化后液相色谱测定方法如方法2.3.3中所述。HPLC分析结果如谱图2所示,由图2可知,在二醇基硅胶色谱固定相保留作用下,GPC由于极性最强,保留时间最长,为22.44 min;而sn-1、sn-2 十一烯酰溶血磷脂极性相对较弱,因而保留比GPC相对较弱,保留时间分别为14.26 min、9.35 min;目标物色谱峰形对称,与其它杂质成分分离效果非常完美。根据峰面积进行归一化分析,所得产品纯度很高,可达90%以上。
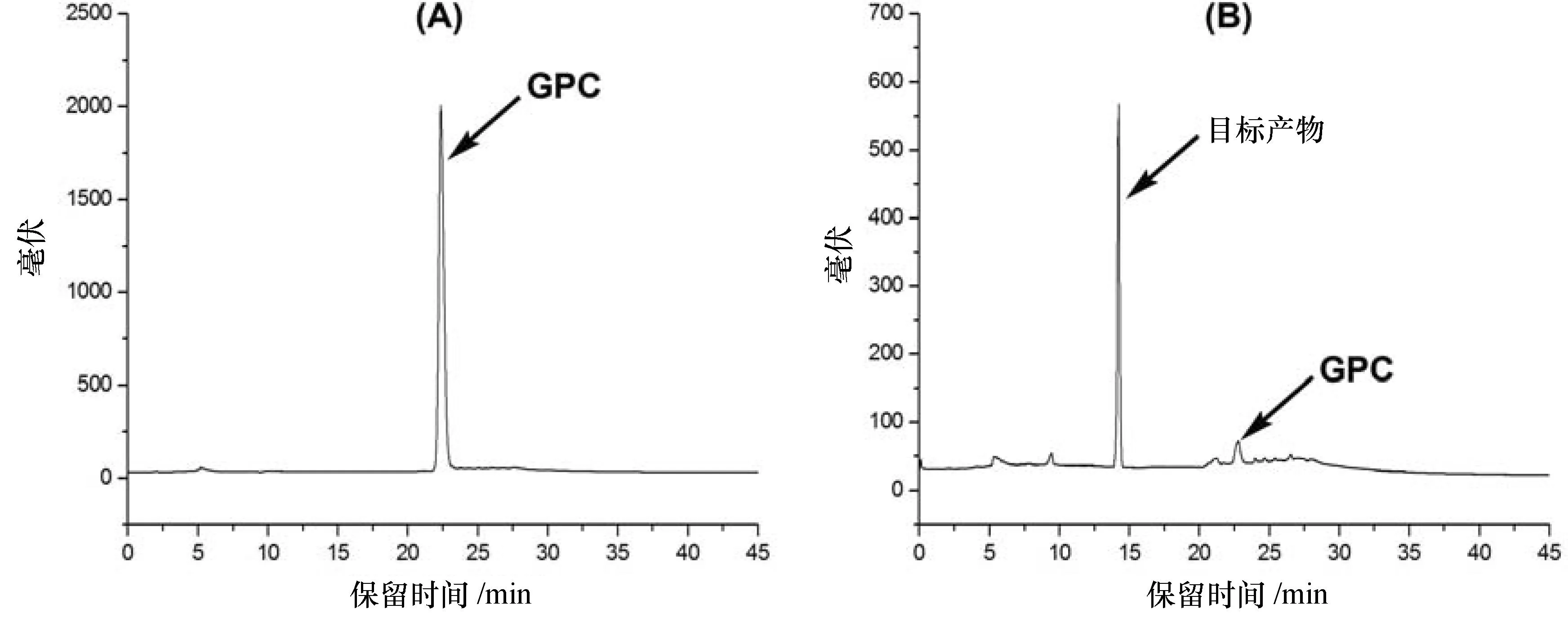
图2 GPC与1-十一烯酰溶血磷脂样品的高效液相色谱图
3.4 1-十一烯酰溶血磷脂的红外光谱表征
反应产物经方法2.3.2进行分离纯化并干燥后,与KBr碾磨压片,使用NEXUS670傅里叶红外光谱仪进行透射扫描,所得红外扫描结果如图3中实线所示。为了比较反应前后基团的变化情况,反应原料GPC也在相同条件下进行红外扫描,结果如图3中虚线所示。
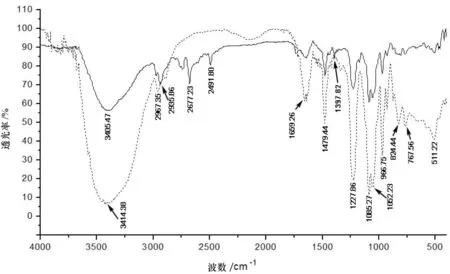
图3 1-十一烯酰溶血磷脂样品(实线)与GPC(虚线)的红外光谱图
红外光谱结果显示:1-十一烯酰溶血磷脂产物与GPC在3 400 cm-1左右均有较强的吸收峰,该峰为—OH的伸缩振动吸收峰,相比较而言,1-十一烯酰溶血磷脂在3 405.47 cm-1处的吸收峰强度远小于GPC在3 414.38 cm-1处的吸收峰强度,这与GPC中1位的—OH经十一烯酰氯酯化后使得羟基数减少的情况相一致。另外,1-十一烯酰溶血磷脂产物谱图中2 973.85 cm-1、2 935.86 cm-1为饱和脂肪烃链中—CH2的C—H的伸缩振动吸收峰,该吸收峰的强度比GPC谱图中2 957.35 cm-1处的吸收峰强度明显增强,说明其分子结构中碳链长度较GPC明显增长,亦即十一烯酰氯已成功与—OH进行反应。1-十一烯酰溶血磷脂样品谱图中1 730.37 cm-1处的吸收峰为C=O基团的振动吸收峰,1 397.82 cm-1处的吸收峰为C=C—H面内弯曲振动的吸收峰;而GPC谱图中均未见对应吸收峰。综合以上分析可知,1-十一烯酰溶血磷脂已通过该方法成功合成。
3.5 1-十一烯酰溶血磷脂的质谱定性分析
为了对产物的结构进一步定性分析,纯化后的样品在HPLC分析时进行分流收集,将收集到的目标峰直接进样进行ESI-MS分析,图4为产物收集液的一级、二级质谱结果,其中一级质谱图4(A)中丰度最强的质荷比424.11的质谱峰为1-十一烯酰溶血磷脂的M+H准分子离子峰;质荷比258.03的质谱峰为失去1位的十一烯酰基后形成的碎片离子峰;质荷比183.93的质谱峰为3位碳上连接的(CH3)3N(CH2)2PO4-基团断裂后形成的碎片离子峰。
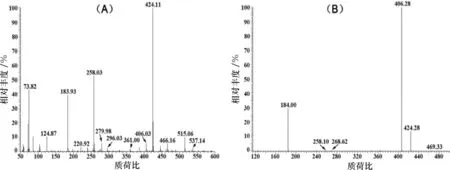
图4 1-十一烯酰溶血磷脂样品ESI-MS一级(A)、二级(B)电喷雾电离质谱图
以质荷比为424.11的离子作为母离子,得到二级质谱图如图4(B)所示,其中丰度最强的质荷比406.28处的质谱峰为准分子离子失去-OH以及结合H后形成的碎片离子峰,质荷比184.00的质谱峰为(CH3)3N(CH2)2PO4-基团断裂后形成的碎片离子峰,再次印证了关于目标产物中存在(CH3)3N(CH2)2PO4-基团的判断。由以上ESI-MS一级质谱及二级质谱的结果分析可知,所合成的产物与1-十一烯酰溶血磷脂的质谱特征相符。
4结束语
笔者以二丁基氧化锡与GPC在异丙醇溶剂体系中形成复合物,然后经十一烯酰氯酯化,选择性合成得到1-十一烯酰溶血磷脂,产物得率可达90%以上。该方法成本低廉、操作简便、条件温和、易纯化且得率高,纯化后的产物经高效液相色谱、红外光谱、电喷雾电离质谱等手段进行表征、确证。所得产物1-十一烯酰溶血磷脂的结构中含有“点击反应”活性的端烯基,在生物、医药、高分子、材料等领域中具有重要应用价值与潜力。
参考文献:
[1]Barenholz Y, Cevc G. Physical chemistry of biological interfaces[M]. Marcel Dekker:New York, NY USA,2000:171-242.
[2]Goetzl E J, An S. Diversity of cellular receptors and functions for the lysophospholipid growth factors lysophosphatidic acid and sphingosine 1-phosphate[J]. Federation of American Societies for Experimental Biology Journal,1998,12(15):1589-1598.
[3]Dowhan W. Molecular basis for membrane phospholipids diversity: Why are there so many phospholipids[J]. Annual Review of Biochemistry,1997,66:199-232.
[4]Reblova Z, Pokomy J. Phospholipids: Characterization, Metabolism and Novel Biological Applications[M]. AOCS Press: Champain, IL USA,1995:378-383.
[5]Dennis E A, Brown H A, Deems R A, et al. Functional lipodomics[M]. CRC Press: Boca Raton FL USA,2006:1-15.
[6]Moolenaar W H. Development of our current understanding of bioactive lysophospholipids[J]. Annals of the New York Academy of Sciences,2000,905:1-10.
[7]Torkhovskaya T I, Ipatova O M, Zakharova T S, et al. Lysophospholipids receptors in cell signaling[J]. Biochemistry(Moscow),2007,72(2):125-131.
[8]Karliner J S. Mechanisms of cardioprotection by lysophospholipids[J]. Journal of Cellular Biochemistry,2004,92(6):1095-1103.
[9]Chun J. Lysophospholipids in the nervous system[J]. Prostaglandins and Other Lipid Mediators,2005,77(1-4):46-51.
[10]Parrill A L. Lysophosphospholipid interactions with protein targets[J]. Biochimica Biophysica Acta,2008,1781:540-546.
[11]Paola D’Arrigo, Stefano Servi. Synthesis of Lysophospholipids[J]. Molecules,2010,15(3):1354-1377.
[12]范勋涛, 阮长春. 大豆溶血磷脂的制备及其对面包品质的影响[J]. 食品工业科技, 2009(3):193-196.
[13]孙万成. 磷脂酶A1水解卵磷脂的研究[J]. 中国粮油学报,2007,22(2),66-70.
[14]李国宾, 李维琳, 毛涛,等. 大豆粉末磷脂的酶解工艺及产物性能研究[J]. 中国粮油学报,2007,22(2),36-39.
[15]Chada J S. Preparation of crystalline L-α-glycerophosphoryl-choline-cadmium chloride adduct from commercial egg lecithin [J]. Chemistry and Physics of Lipids, 1970,4(1):104-108.
[16]Ichihara K, Iwasaki H, Ueda K, et al. Synthesis of phosphatidylcholine: An improved method without using the cadmium chloride complex of sn-glycero-3-phosphocholine[J]. Chemistry and Physics of Lipids,2005,137(1-2):94-99.
[17]Michael J, Martinelli, Rajappa Vaidyanathan, et al. Catalytic regioselective sulfonylation of a-chelatable alcohols: scope and mechanistic insight[J]. Journal of the American Chemical Society,2002,124(14):3578-3585.
[18]Daniel Wagner, Julien P H Verheyden, John G Moffatt. Preparation and synthetic utility of some organotin derivatives of nucleosides[J]. Journal of Organic Chemistry,1974,39(1):24-30.
Selective synthesis and characterization of 1- undecenoyl -sn-glycero-3-phosphocholine
LIUYang-jing1,HUZhi-xiong1,2,YUXiao-bo1,QIYu-tang1,ZHANGWei-nong1,2
(1. School of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China;
2.Hubei Collaborative Innovation Center for Processing of Agricultural Products, Wuhan 430023, China)
Abstract:To establish a method for the selective synthesis of 1-undecenoyl-sn-glycero-3 -phosphocholine. A practical selective synthesis of 1-undecenoyl-sn-glycero-3 -phosphocholine has been established through the selective acylation of the complex of L-α-Glycerophosphorylcholine and dibutyltin oxide (DBTO) by undecenoate chloride. The purified product has been analyzed and identified by high performance liquid chromatography (HPLC), infrared spectrum (IR) and electrospray ionization mass spectrum (ESI-MS). The product has been proved to be 1-undecenoyl-sn-glycero-3-phosphocholine, and the selectivity of reaction up to 90%. The proposed method can provide many advantages such as low cost, simple operation, mild reaction conditions, high yield and easy product purification process. The product 1-undecenoyl-sn-glycero-3-phosphocholine contains a “click chemistry” active alkenyl group which will guarantee its wide application value and potential in the field of biology, medicine, polymer and materials.
Key words:1-undecenoyl-sn-glycero-3-phosphocholine; synthesis; L-α-Glycerophosphoryl- choline; dibutyltin oxide
基金项目:湖北省教育厅科学技术研究计划重点项目(D20141705).
DOI:10.3969/j.issn.2095-7386.2015.02.016 10.3969/j.issn.2095-7386.2015.02.014
文章编号:2095-7386(2015)02-0070-04 2095-7386(2015)02-0060-05
通信作者:石雄(1968-),男,教授,E-mail:stonehero@163.net. 王丽梅(1980-),女,副教授,博士,E-mail:wanglimeiyx@163.com.
作者简介:杨培凯(1989-),男,硕士研究生,E-mail:278851511@qq.com. 朱才会(1991-),男,本科生,E-mail:1044582163@qq.com.
收稿日期:2014-12-05. 2015-02-03.
中图分类号:TQ 460.31
文献标识码:A
