耐高温酵母菌高氨氮同化率菌株的筛选和发酵条件研究
2015-12-17曹玉飞缪礼鸿
曹玉飞,缪礼鸿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
耐高温酵母菌高氨氮同化率菌株的筛选和发酵条件研究
曹玉飞,缪礼鸿
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
摘要:通过比较测定酵母菌发酵上清液中残存的氨氮含量的方法,从假丝酵母(Candida)、酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)和东方伊萨酵母(Issatchenkia orientalis)4个属共56株耐高温酵母菌中筛选得到6株氨氮同化率为70%以上的酵母菌株,其中酿酒酵母1株,假丝酵母属5株;通过进一步复筛,获得1株氨氮同化率高达81.1%的产朊假丝酵母(C.utilis)SG607。不同属的酵母菌以及同种酵母菌不同菌株之间对氨氮的同化率均有明显差异。发酵实验结果表明,在培养基碳/氮比为15:1,发酵时间为24 h时,产朊假丝酵母对氨氮的同化率最高。
关键词:酵母菌;氨氮同化率;发酵条件
1引言
国内饲用蛋白资源一直匮乏,尤其是随着畜牧业的发展,导致饲用蛋白资源的缺口快速增大[1,2],而酵母中存在氨氮同化现象,即可以直接将无机氮转化成有机氮[3-7]。酵母营养价值高,含有丰富的蛋白质(约占细胞干重的45%-60%),维生素B、矿物质、核酸以及丰富的酶类和生物活性物质,如辅酶A、辅酶Q、尿酸酶、谷胱甘肽[8]等,是一种制备单细胞蛋白的理想菌种,且产朊假丝酵母(Candidautilis)、酿酒酵母(Saccharomycescerevisiae)和克鲁维酵母(Kluyveromycesfragilis)已被美国FDA认证为食品添加剂酵母[9],可以广泛用作饲用酵母蛋白的生产菌种[10]。在酵母单细胞蛋白发酵过程中往往添加大量的无机氮作为氮源[11-15],但对不同酵母菌的氨氮同化能力却缺少较深入的研究。本文对不同酵母菌的氨氮同化能力进行了比较筛选和发酵条件研究,为酵母菌吸收利用氨氮生产单细胞蛋白及相关领域的应用提供基础。
2材料和方法
2.1 材料
2.1.1菌种
供试菌种中,产朊假丝酵母(C.utilis)1807,购自中国工业微生物菌种保藏管理中心;马克思克鲁维酵母(K.marxianus)32920, 2.1549均购自中国科学院微生物菌种保藏中心;安琪耐高温酿酒活性干酵母(S.cerevisiae) TRADY(以下简称TRADY)购自安琪酵母公司。其余52株酵母菌株为本实验室分离并保藏。
2.1.2主要试剂
3,5-二硝基水杨酸、苯酚、氢氧化钠均购自国药集团化学试剂有限公司;98%浓硫酸、硫酸钾、五水硫酸铜、硼酸、亚硝基铁氰化钠均购自天津市科密欧化学试剂有限公司。以上试剂均为分析纯。
2.1.3仪器与设备
JJ-CJ-2FD洁净工作台:苏州市金净净化设备科技有限公司;DHG-9140A电热恒温鼓风干燥箱和DNP-9082型电热恒温培养箱:上海精宏实验设备有限公司;HZQ-Q全温振荡器:哈尔滨市东联电子科技开发有限公司;WFG 7200型可见分光光度计:尤尼柯(上海)仪器有限公司。
2.1.4培养基
酵母菌种子培养基:YPD液体培养基(葡萄糖20g,蛋白胨10g,酵母粉10g,水1 000 mL;配制固体培养基时添加2.0%(W/V)的琼脂粉)。
酵母菌发酵培养基:蔗糖6.0 g,硫酸铵0.8 g,酵母粉0.5 g,KH2PO41.0 g,MgSO4·7H2O 0.5 g,水1 000 mL,补加微量元素组成:H3BO3,1.6×10-5M; MnCl2,5.1×10-6M;FeCl3,3.7×10-6M;ZnSO4,3.5×10-6M;KI,6.0×10-7M ;Na2MoO4,4.1×10-6M;CuSO4,4.0×10-7M。
2.2 方法
2.2.1酵母菌种子液培养方法
将供试酵母菌株接种到YPD固体培养基上,37 ℃培养24 h。取经活化的菌种接种到装有100 mLYPD液体培养基的250 mL三角瓶中,37 ℃、170 r/min条件下培养24 h。以5%的接种量接种到装有100 mL酵母菌发酵培养基的250 mL三角瓶中,37 ℃、170 r/min条件下培养24 h。
2.2.2发酵培养基中不同添加物对酵母菌总数的影响
将复合微量元素液、玉米浆、豆芽汁、土豆汁和复合维生素液分别加入酵母菌发酵培养基中,37 ℃、170 r/min条件下培养24 h,采用血球计数板法测定其酵母菌的总菌数[16]。
2.2.3不同发酵时间和碳氮比对酵母菌氨氮同化率的影响
按5%的接种量将培养好的酵母菌种子液接种到发酵培养基中,37℃、170r/min条件下培养,分别取发酵12 h、24 h、36 h、48 h和60 h的发酵液,4 000 r/min条件下离心10min,测定上清液中氨氮含量和残糖含量,并计算氨氮同化率和糖利用率。


2.2.4测定方法
残糖测定:采用3,5-二硝基水杨酸法测定[17]。
氨氮含量:采用苯酚-次氯酸盐法测定[18-19]。
生物量测定:将发酵液在4 000 r/min条件下离心10 min后得到的沉淀洗涤3次,置于恒温干燥箱中,80 ℃烘至恒重,称量并计算[20]。
总菌数测定:采用血球计数板法测定。
粗蛋白测定:采用凯氏定氮法测定,见国标GB/T6432-96。
3结果与分析
3.1 高氨氮同化率酵母的初筛
供试的56株酵母菌均可以在40 ℃生长良好,具有耐高温特性,分别对它们进行发酵并测定对氨氮的同化率。测定结果表明,未接种的发酵培养基中氨氮含量为169.52 mg/L。由表1所示,酿酒酵母共3株,它们的氨氮同化率差异很大,从1.53%到70.9%均有分布;马克思克鲁维酵母共17株,它们的氨氮同化率基本分布在30%到55%之间;热带假丝酵母共23株,它们的氨氮同化率基本分布在60%到80%之间;东方伊萨酵母共10株,它们的氨氮同化率基本分布在4%到10%之间;2株产朊假丝酵母的氨氮同化率差异较大;1株季也蒙酵母和1株C.palmioleophila的氨氮同化率分别为53.8%和48.5%。通过初筛共得到6株氨氮同化率到达70%以上的酵母菌进入复筛试验。
由表1可以看出:(1)不同属酵母菌的氨氮同化率分布差异较大,I.orientalis的氨氮同化率分布处于较低的水平,即为10%以下;K.marxianus氨氮同化率分布处于一般的水平,即为30%到55%之间;Candida酵母属的氨氮同化率分布处于较高的水平,即为60%到80%之间。(2)同属不同种酵母菌的氨氮同化率差异较大。本研究比较测定了假丝酵母属的四个不同种的酵母菌对氨氮的同化率,其中C.tropicalisHG3-1氨氮同化率为70.4%,C.utilisSG607氨氮同化率为80.7%,C.guilliermondiiYN-1和C.palmioleophilaBK-9的氨氮同化率分别为53.8%和48.5%,4个种间的差异较大。(3)同种不同菌株的酵母菌之间氨氮同化率存在明显差异。K.marxianus2.1549的氨氮同化率为25.6%,而K.marxianusWZ-1的氨氮同化率达69.0%。C.tropicalisBK-8氨氮同化率为45.2%,而C.tropicalisAA-3的氨氮同化率为76.5%,两株酵母菌的氨氮同化率相差31.3%。
表156株酵母菌的氨氮同化率测定结果

序号菌种菌株编号分类发酵后上清氨氮含量/mg·L-1氨氮同化量/mg·L-1氨氮同化率/%1WHH-32WHH-53安琪酿酒酵母(Saccharomycescerevisiae)166.92.621.5550.7118.270.1108.660.935.94BM2-55HY3-26YP2-37YP1-68DL2-29TC2-310TC1-111WZ-1123292013WZ-214BM2-415BM1-1162.154917YP2-218BM2-319HG4-220BM1-2马克思克鲁维酵母(Kluyveromycesmarxianus)106.762.837.177.991.654.0104.365.238.598.670.941.894.075.544.5100.968.640.5103.266.339.152.5117.069.0116.253.331.587.482.148.499.570.041.389.679.947.1126.143.425.698.271.342.195.673.943.697.871.742.387.671.948.3

续表
3.2 高氨氮同化率酵母菌株的复筛
对6株氨氮同化率较高的酵母菌株进行摇瓶复筛,结果见表2。通过复筛获得1株最高氨氮同化率为81.1%的菌株C.utilisSG607。
表26株高氨氮同化率酵母的复筛实验(每个菌株3瓶重复)

菌株发酵前氨氮含量/mg·L-1发酵后上清液氨氮含量/mg·L-1氨氮同化率/%HG-2120.4±3.149.1±3.171.1±1.9HG4-1120.3±1.049.2±1.071.0±0.6HG-1124.2±0.845.3±0.873.3±0.5HG3-1125.2±0.944.3±0.973.9±0.5SG607137.5±0.432.0±0.481.1±0.5YP2-1121.8±2.147.7±2.171.9±0.9
3.3 发酵培养基中不同添加物对酵母菌总数的影响
培养基中酵母菌的总菌数可以表示其生物量高低和长势强弱。在酵母菌发酵培养基的基础上,添加5种不同营养成分进行摇瓶发酵,结果如图1所示。由图1可知,添加复合微量元素液后,C.utilisSG607菌株的总菌数最高,高达1.39×108mL-1。故复合微量元素液为最佳添加物。

图1 5种添加物对酵母菌总菌数的影响
3.4 不同发酵时间和碳氮比对酵母菌的氨氮同化率的影响
培养基的碳氮比对酵母菌的生长有很大的影响,从而影响酵母菌的氨氮同化率。由图2和图3可以看出,在碳/氮比为15:1发酵时间为24 h时, SG607菌株的糖利用率达到97.5%,氨氮同化率达到80.3%,为9个不同碳氮比发酵培养基中氨氮同化率最高。故确定酵母菌发酵培养基碳氮比为15:1,发酵时间为24 h。
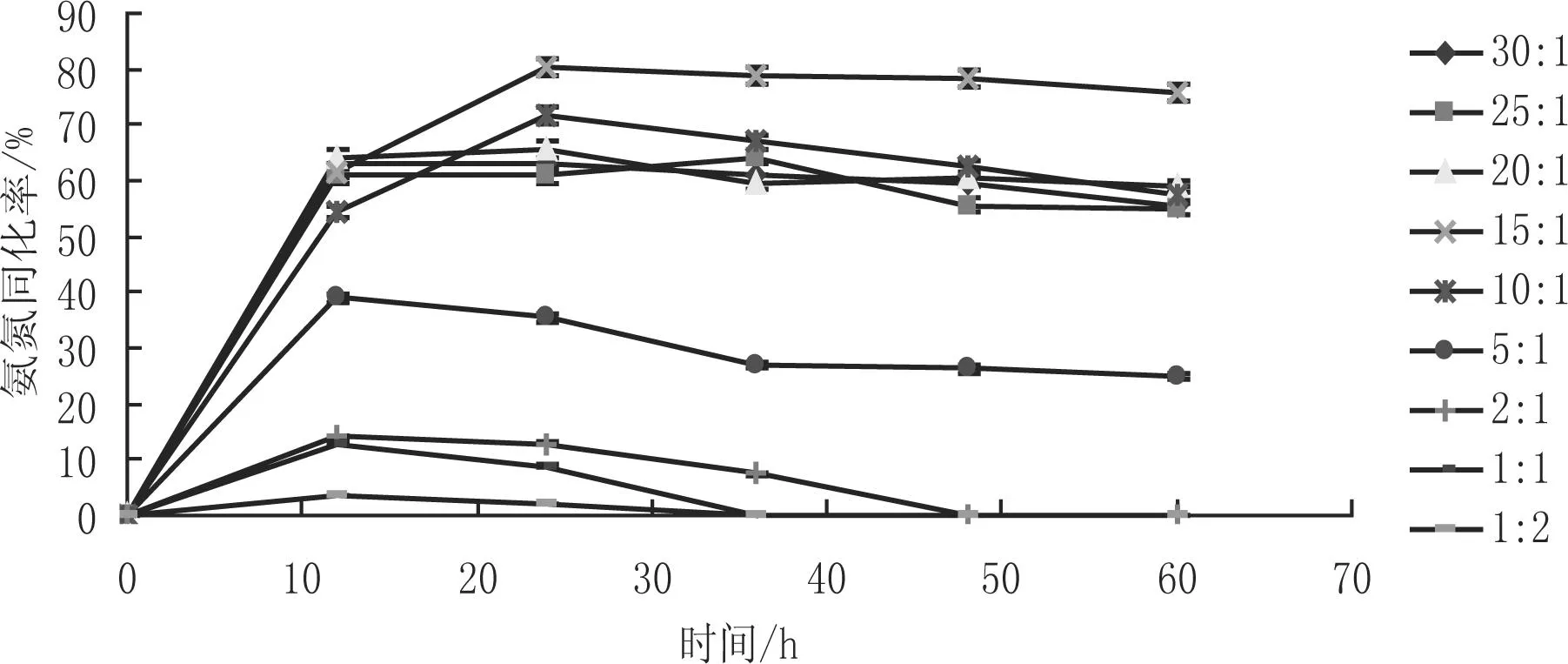
图2 不同的碳氮比及发酵时间对酵母菌氨氮同化率的影响

图3 不同的碳氮比及发酵时间对酵母菌糖利用率的影响
4结论
通过摇瓶初筛和复筛实验,本研究从56株酵母菌中筛选获得1株氨氮同化率高达81.1%的产朊假丝酵母菌株 SG607,该菌株比目前广泛使用的产朊假丝酵母1807菌株的氨氮同化率有显著提高,在酵母蛋白饲料发酵及处理环境中高氨氮有机废弃物等领域具有潜在的应用价值。酵母菌对氨氮的同化率与发酵条件有关,当培养基的碳氮比为15∶1,发酵时间为24h时, 产朊假丝酵母对氨氮的同化率最高。
参考文献:
[1]任道群,唐玉明,姚万春.一株高产蛋白饲料菌株的选育及生物特性研究[J].安徽农业科学,2011,39(10);5917-5919.
[2]金红春,兰时乐,胡毅,等.棉粕发酵前后营养成分变化研究[J].饲料工业,2011,32(13);19-23.
[3]Boris Magasanik. Ammonia Assimilation bySaccharomycescerevisiae[J]. Eukaryotic Cell,2003,2(5);827-829.
[4]Annr Holmes,Alan Collings. Ammonium Assimilation byCandidaalbicansand Other Yeasts: Evidence for Activity of Glutamate Synthase[J]. Journal of General Microbiology (1989),135,1423-1430.
[5]Christophe Roca,Jens Nielsen,et al. Metabolic Engineering of Ammonium Assimilation in Xylose-FermentingSaccharomycescerevisiaeImproves Ethanol Production[J]. Applied and Environmental Microbiology,2003,68(9);4732-4736.
[6]Yuanming Hu,Terrance G Cooper,et al. TheSaccharomycescerevisiaeLeu3 Protein Activates Expression of GDH1,,a Key Gene in Nitrogen Assimilation[J]. Molecular and Cellular Biology,1995,15(1);52-57.
[7]杨瑞娟,吴雪昌. 酿酒酵母体内氮的代谢作用[J]. 农机化研究,2008,1(1);35-39.
[8]Liang G B,Liao X Y,Du G C,et al.A new strategy to enhance glutathione production by multiple H2O2-induced oxidative stresses inCandidautilis[J].Bioresour Technolgy,2008,100(1);350-355.
[9]张倩倩,管于平,刁爱坡,等. 产朊假丝酵母培养条件的优化研究[J]. 中国调味品,2013,5(38);43-48.
[10]励飞,梅雪臣,缪礼鸿,等.一株发酵木薯酒糟的的热带假丝酵母菌株的分离和营养分析[J].中国酿造,2012,31(7);62-65.
[11]何海燕,罗萍萍,兰景丽,等.葡萄渣发酵生产高生物量饲料酵母的研究[J].中国饲料,2012,(18);25-27.
[12]M. Ibrahim Rajoka.Production of single cell protein through fermentation of a perennial grass grown on saline lands with Cellulomonas biazotea[J], World Journal of Microbiology & Biotechnology 2005(21);207-211.
[13]Vanajakshi Jalasutram,Sangeetha Kataram. Single cell protein production from digested and undigested poultry litter byCandidautilis: optimization of process parameters using response surface methodology[J],,Clean Techn Environ Policy (2013) 15;265-273.
[14]Ibrahim M, Rajoka1 M A. Tariq Kiani,et al. Production of single cell protein from rice polishings usingCandidautilis,World Journal of Microbiology & Biotechnology,2004(20);297-301.
[15]Minkevich I G,Sobotka M.Continuous Growth ofCandidautilisunder Periodic Change[J].Folia Microbiol1990(35);251-265.
[16]赵斌,何绍江.微生物学实验[M]. 北京:科学出版社,2002.
[17]赵凯,许鹏举,谷广烨,等. 3,5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学,2008(29);534-536.
[18]徐晨东,易蕴玉,全文海.利用苯酚-次氯酸盐反应测定铵离子方法的探讨[J].无锡轻工大学学报,1998,17(1);34-38.
[19]Weatherburn M W.Phenol-Hypochlorite Reaction for Determination of Ammonia[J]. Analytical Chemistry1967,39(8);971-974.
[20]何海燕,覃拥灵,李楠,等.利用甘蔗糖蜜发酵生产酵母单细胞蛋白的菌种选育[J],粮食与饲料工业,2006,12(3);28-29,41.
Screening of thermotolerant and high ammonia assimilation rate yeast strains and study on fermentation conditions
CAOYu-fei,MIAOLi-hong
(School of Biological and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023,China)
Abstract:In this study, six yeast strains of ammonia assimilation rate more than 70% were screened out from 56 strains of high temperature resistant yeast including Canadida, Saccharomyces cerevisiae,Kluyveromyces marxianus and Issatchenkia orientalis by the comparison of residual ammonia nitrogen content in the supernatant of yeast fermentation. One of them belong to Saccharomyces cerevisiae, the other five strains belong to Candida tropicali. Through further screening, one strain of Candida utilis named SG607 with ammonia nitrogen assimilation rate as high as 81.1% was screened out. There were significantly different on assimilation rate of ammonia among different genera of yeasts and different strains of one yeast species. The fermentation experiment results showed that the Candida tropicali strain could reached the highest rate of ammonia assimilation when the ratio of carbon and nitrogen in the medium was 15:1, and the fermentation time was 24h.
Key words:yeast; ammonia assimilation rate;fermentation condition
DOI:10.3969/j.issn.2095-7386.2015.02.007 10.3969/j.issn.2095-7386.2015.02.002
文章编号:2095-7386(2015)02-0031-05 2095-7386(2015)02-0006-04
基金项目:湖北省教育厅科学技术研究计划重点项目(D20141705). 车用生物燃料技术国家重点实验室开放基金资助项目(KFKT2013015);湖北省重大科技创新计划项目(2013ABA008).
通信作者:王丽梅(1980-),女,副教授,博士,E-mail:wanglimeiyx@163.com. 缪礼鸿(1965-),男,教授,E-mail:miaowhpu@126.com.
作者简介:平晟 (1993-),男,本科生,E-mail:1044582163@qq.com. 陈瑾(1989-),女,硕士研究生,E-mail:cjmayday@126.com.
收稿日期:2015-02-03. 2015-03-23.
中图分类号:TQ 929
文献标识码:A
