固定化葡萄糖异构酶的微波活化及其性质研究*
2015-12-16张甫生胡国洲田美玲李曼珊阚建全
张甫生,胡国洲,田美玲,李曼珊,阚建全
(西南大学 食品科学学院,重庆,400715)
葡萄糖异构酶(Glucose isomerase,简称 GI),能将D-木糖、D-葡萄糖、D-核糖等醛糖转化为相应的酮糖,是工业上大规模制备果葡糖浆的关键转化酶[1-2]。因果葡糖浆具有溶解度高、保湿性好、抗结晶性好及风味浓郁等特点,现作为甜味剂已逐步取代了蔗糖的地位[3-4]。随着果葡糖浆使用量增长,国内外市场上对葡萄糖异构酶的需求也在不断增加;然而葡萄糖异构酶在应用过程中存在酶活性低、再生困难、寿命短及价格昂贵等问题,极大地限制了其工业化应用,也增加了实际生产成本,成为制约果葡糖浆产业发展的瓶颈问题。为此,国内外企业及研究机构都迫切地期望通过酶改性技术,达到提高酶活、延长酶寿命、降低生产用酶量的目的。
近年来,微波处理等作为食品工业杀菌与钝酶的加工手段渐入人们视野[5-6]。在应用微波对酶进行处理的过程中发现,一些较低强度的微波处理能迅速地提高酶的活性,如Yu等对微波活化脂肪酶进行研究,发现与普通加热相比,480 W的微波处理可使诺维信脂肪酶活性提高1.5倍[7];Lukasiewicz等研究显示,微波处理可使γ-淀粉酶的初始反应速率最大可提高2.5倍[8];Roy等研究表明微波的非热效应可使蛋白酶初始反应速率提高2.1~4.7倍,同时与pH及盐离子等还有协同增效的作用[9]。此外,微波处理还可以使纤维素酶[10]、S-腺苷高半胱氨酸水解酶[11]、α-半乳糖苷酶[12]及 β-葡糖苷酶[12]等酶的活性增强。这就显示在适当条件下微波处理对食品中酶具有活化效果,可以对酶进行活化改性,来提高酶活。但上述这些激活研究大多集中于对单一游离酶活性提高方面,未进一步涉及其酶学性质等方面变化。
在微波处理对葡萄糖异构酶活化方面,除本团队前期报道微波处理激活游离葡萄糖异构酶[13]外,目前尚未见其他相关的研究报道。因酶在经过固定化之后,固定化酶的活性中心、空间结构和电荷状态等发生改变[2,4],微波处理对固定化后葡萄糖异构酶的影响也定会有所改变。因此,本文以固定化葡萄糖异构酶为研究对象,探讨微波处理对其活性及相关酶学性质的影响,以期为微波处理对固定化酶活化改性提供理论基础,并推动微波处理等非热加工技术在酶改性领域中的合理应用。
1 材料与方法
1.1 材料与试剂
葡萄糖异构酶(≥10万U/g),武汉银河化工有限公司;固定化葡萄糖异构酶,以活化硅胶为载体自制(酶活125 U/g)。
咔唑、半胱氨酸盐酸盐、葡萄糖、Na2HPO4、NaH2PO4、果糖、H2SO4、高氯酸、MgSO4、CoCl2等均为分析纯,成都科龙试剂有限公司;硅胶(300目),青岛海洋化工厂分厂。
1.2 设备与仪器
MAS-Ⅱ型微波快速制样系统(工作功率0~1 000 W,工作温度25~250℃),上海新仪公司;UV-2450型紫外分光光度计,日本岛津公司;PB-10精密pH计,赛多利斯科学仪器(北京)有限公司;FA2004型电子天平,上海精科天平;SHZ-82A恒温水浴振荡器,江苏金坛市恒丰仪器制造有限公司;DK-8D型三孔电热恒温水槽,上海齐欣科学仪器有限公司。
1.3 方法
1.3.1 固定化葡萄糖异构酶的制备
取5 mg/mL葡萄糖异构酶酶液30 mL,加入1 g干燥活化硅胶(硅胶活化参考 Song的方法[14]),于25℃水浴振荡器(170 r/min)中振荡24 h,然后用去离子水充分洗涤,抽滤得到固定化葡萄糖异构酶样品,于4℃保存备用。
1.3.2 固定化葡萄糖异构酶酶活力测定
采用半胱氨酸-咔唑法[3]。反应体系为:0.2 mol/L pH7.0磷酸缓冲液10 mL,2 mol/L的葡萄糖混合溶液10 mL(含有0.05 mol/L Mg2+和0.01 mol/L Co2+,下同),0.4 g固定化酶。混合液置于70℃水浴中,反应30 min后,迅速加入0.5 mol/L的高氯酸溶液2.5 mL终止反应,后用半胱氨酸-咔唑法测定果糖含量,根据果糖标准曲线计算固定化葡萄糖异构酶的酶活力。固定化酶酶活力单位定义:在该反应条件下,1 g固定化酶每分钟将1 μmol葡萄糖异构为果糖的微摩尔数为1个活力单位(U/g)。
1.3.3 微波处理对固定化葡萄糖异构酶活性增强的影响
以10 mL 2%固定化酶+10 mL 2 mol/L的葡萄糖底物混合溶液为待处理液(均以pH 7.0缓冲液配制,下同),以水浴加热处理为对照,并以其酶活为100%,在微波处理温度70℃和处理时间30 min的条件下,探讨不同功率(200、300、400、600、800 W)微波处理对葡萄糖异构酶活性增强的影响。
1.3.4 微波处理对固定化葡萄糖异构酶的最适反应温度的影响
在固定微波处理功率400 W和处理时间30 min的条件下,探讨不同微波处理温度(55、65、70、75、80、85、90℃)对固定化葡萄糖异构酶活性的影响,以最大酶活力为100%,分析其最适反应温度。
1.3.5 微波处理对固定化葡萄糖异构酶的最适pH的影响
在固定微波处理功率400 W、处理温度70℃和处理时间30 min的条件下,探讨不同pH(5.5、6.0、6.5、7.0、7.5、8.0、9.0)对固定化葡萄糖异构酶活性的影响,以最大酶活力为100%,分析其最适反应pH。
1.3.6 微波处理对固定化葡萄糖异构酶的Km值与Vmax的影响
以10 mL 2%固定化酶+10 mL一系列浓度(100、300、500、800、1 000、1 500 mmol/L)的葡萄糖底物混合溶液为待处理液,以水浴加热处理为对照,在固定微波处理功率400 W、处理温度70℃和处理时间30 min的条件下进行微波处理,测定固定化酶活性。根据经典的Michaelis-Menten动力学方程,运用Lineweaver-Burk作图[3](双倒数法)得到米氏方程,进而利用米氏方程计算微波加热处理条件下葡萄糖异构酶的Km和Vmax。
1.3.7 金属离子浓度对微波处理固定化葡萄糖异构酶活性的影响
在固定微波处理功率400 W、处理温度70℃和处理时间30 min的条件下,探讨底物溶液中不同Mg2+浓度(0、0.001、0.01、0.05、0.08、0.1 mol/L)和Co2+浓度(0、0.001、0.001、0.002、0.005、0.01 mol/L)对固定化葡萄糖异构酶活性的影响,以水浴对照初始酶活力为100%,比较分析底物中最适Mg2+和Co2+浓度。
1.3.8 微波处理固定化葡萄糖异构酶的稳定性分析
(1)固定化葡萄糖异构酶的热稳定性分析
在固定微波处理功率400 W,处理温度为30~90℃条件下保温处理酶液1 h,冷却到4℃后,测定固定化酶酶活,以最大酶活力为100%。分析比较微波加热处理和水浴加热对照处理下固定化葡萄糖异构酶的热稳定性。
(2)固定化葡萄糖异构酶的操作稳定性分析
在固定微波处理功率400 W、处理温度70℃和处理时间30 min的条件下进行微波处理,测定固定化酶活性。而后将固定化酶收集,用去离子水洗涤干净,置于4℃冰箱保存4 h后,再用同样的方法进行微波加热处理并测定其活性。重复试验15次,以初始酶活力为100%,比较固定化酶在微波加热和水浴加热条件下酶的操作稳定性。
1.4 数据分析
每组试验均重复3次,试验数据运用OriginPro 8.0和Excel 2010进行分析处理和图形绘制。
2 结果与分析
2.1 微波处理对固定化葡萄糖异构酶活性增强的影响
由图1可知,固定化葡萄糖异构酶活性在不同功率微波处理后,酶活力均有所提高,说明固定化葡萄糖异构酶在微波处理的条件下均被活化;但酶活力增幅呈现先增加后降低的趋势,微波功率为200~400 W时,固定化葡萄糖异构酶活性上升,并在400 W时达到最高为156.1 U/g,比对照水浴处理酶活(125.4 U/g)增加了24.5%;而当微波功率增至600 W、800 W时,固定化酶酶活增幅降低,与对照相比酶活分别仅增加18.0%和15.5%。这可能是因为适当的微波处理功率使酶中某些与酶活力相关的功能基团发生有序重排,从而使酶活力提高,而过高的处理功率使酶蛋白部分变性,进而导致酶活性降低或增幅降低[7]。
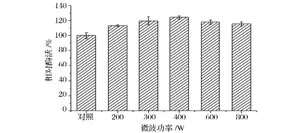
图1 微波处理对固定化葡萄糖异构酶活性增强的影响Fig.1 Effect of microwave treatment on enhancing activity of immobilized glucose isomerase
2.2 微波处理对固定化葡萄糖异构酶最适反应温度的影响
温度是影响葡萄糖异构酶活性的一个重要因素,在适宜的温度范围内,葡萄糖异构酶比较稳定,当偏离最适温度后,酶就会发生热变性而导致失活[15]。微波处理对固定化葡萄糖异构酶最适温度的影响见图2。
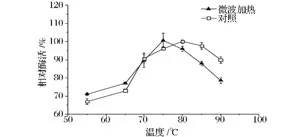
图2 微波处理对固定化葡萄糖异构酶最适反应温度的影响Fig.2 Effect of microwave treatment on optimal temperature of immobilized glucose isomerase
从图2可以看出,微波处理与水浴对照处理固定化葡萄糖异构酶的最适反应温度分别为75℃和80℃;与水浴对照相比,在微波处理下固定化酶的最适反应温度降低了5℃,且其最适温度范围(酶活>95%的温度范围)变小,水浴处理的固定化葡萄糖异构酶最适温度范围为75~85℃,而微波处理后固定化葡萄糖异构酶最适温度范围为75~80℃;这与前期游离酶的研究结果[13]正好相反,这可能与载体对固定化酶蛋白的保护作用有关,载体对酶蛋白分子构象完整性自动进行调整[1-2],阻碍了微波处理对酶结构的有序重排或加速无序结构,从而使最适反应温度与最适温度范围降低。而同时在较高的反应温度范围(80~90℃)内,微波处理固定化酶的活力比对照处理下降较快,可能是在高温条件下,微波处理更易使部分固定化葡萄糖异构酶失活所致[16]。
2.3 微波处理对固定化葡萄糖异构酶最适pH的影响
pH能影响酶分子活性部位上酸性或碱性氨基酸侧基的解离状态,从而影响酶活性中心与底物的结合或催化,进而影响酶活性[17];pH是影响酶活性的重要因素之一,当介质的pH值对最适宜值偏离较大时,还可导致酶的变性失活。由图3可以看出,微波处理并未改变固定化葡萄异构酶的最适pH范围,微波处理和水浴处理的固定化葡萄异构酶的最适pH范围均为7.0~7.5,且均在pH7时酶活力最高。
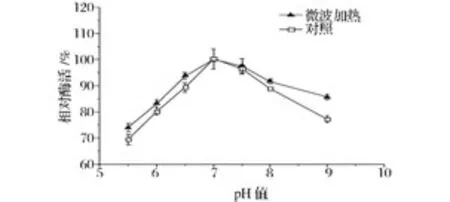
图3 微波处理对固定化葡萄糖异构酶最适pH的影响Fig.3 Effect of microwave treatment on optimal pH of immobilized glucose isomerase
2.4 金属离子浓度对微波处理固定化葡萄糖异构酶活性的影响
葡萄糖异构酶为金属离子依赖性酶,其活性中心有Mg2+、Co2+的结合位点,在适宜的Mg2+、Co2+浓度条件下,葡萄糖异构酶分子具有最佳的稳定构象和最高的活性[4]。不同金属离子浓度对固定化葡萄糖异构酶的影响,见图4(a)与4(b)。
从图4(a)与4(b)中可以看出,固定化葡萄糖异构酶的活性均随Mg2+与Co2+浓度增加,呈现先增加后稳定的趋势。对于Mg2+而言,微波处理与水浴对照处理的固定化葡萄糖异构酶的活性在Mg2+浓度为0.001~0.05 mol/L时,活性随Mg2+浓度增加而增加,浓度大于0.05 mol/L,酶活性趋于稳定;对于Co2+而言,固定化葡萄糖异构酶的活性在Co2+浓度为0~0.001 mol/L时,活性随Co2+浓度的增加而增加;浓度大于0.001 mol/L时,酶活性趋于稳定。因此,微波处理与水浴对照处理的最适Mg2+与Co2+浓度分别为0.05 mol/L和0.001 mol/L。此外,从图4(a)与4(b)中也可以看出,微波处理固定化酶的活性均较水浴对照处理高,这与2.1结果一致,再次证明微波处理对固定化葡萄糖异构酶有活化作用。

图4 Mg2+(a)和Co2+(b)浓度对微波处理固定化葡萄糖异构酶活性的影响Fig.4 Effect of Mg2+(a)and Co2+(b)on the activity of immobilized glucose isomerase treated by microwave
2.5 微波处理对固定化葡萄糖异构酶的动力学参数影响
由经典的Michaelis-Menten动力学方程,作图法可得到米氏常数(Km)、最大反应速率(Vmax)。经作图(图5a与5b)与计算得出,微波处理下固定化葡萄糖异构酶的Km为0.181 mol/L,Vmax为 8.1 ×10-4mol/(L·min);水浴对照处理固定化酶的Km为0.223 mol/L,Vmax为7.7×10-4mol/(L·min)。说明经微波处理的固定化葡萄糖异构酶与水浴对照处理的相比Vmax增大,Km降低,说明此时酶与底物亲和力增大,其在饱和浓度下的限制反应速度也增大。这可能是由于微波处理导致酶结构变化,使酶的底物的亲和力增加,葡萄糖异构酶与底物结合更容易,从而表现较高的催化能力[9,18]。
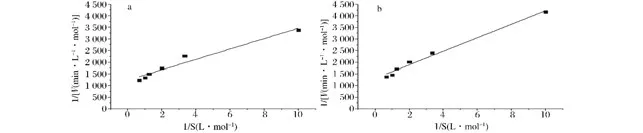
图5 微波处理(a)和水浴处理(b)固定化葡萄糖异构酶的动力学方程图Fig.5 Michaelis-Menten kinetics equation of immobilized glucose isomerase treated by microwave(a)and conventional heating(b)
2.6 微波处理固定化葡萄糖异构酶的稳定性分析
(1)固定化葡萄糖异构酶的热稳定性分析
温度它不仅可以影响酶蛋白的构象、参与酶促反应官能团的解离状态,而且还会影响到酶与底物的亲和力,酶-底物络合物的分解,甚至还会影响到酶与激活剂的亲和力等,且与pH值等相比,在加工过程更不易控制[19]。固定化酶的热稳定性是其在工业化应用中最重要的性质之一。固定化酶热稳定性比较分析见图6,从图6可以看出,微波加热条件下,固定化酶在70℃以下时,其残余酶活也都是保持在80%以上,呈持续上升状态;而当温度大于70℃后,固定化酶的残余酶活急剧下降,在90℃下降到55.54%;而在水浴加热对照条件下,固定化酶在80℃以下时,其残余酶活都是保持在80%以上,也呈持续上升状态,当温度大于80℃后,固定化酶活力也开始迅速下降,在90℃下降到81.44%。说明在较低温度 (微波处理<70℃,水浴处理<80℃)时,固定化酶的稳定性较好;而在较高温度下(微波处理>70℃,水浴处理>80℃)时,固定化酶活稳定性不高且酶活开始急剧下降;而在更高温度90℃时,微波加热固定化酶活比对照水浴处理下降得更多,稳定性显著低于对照处理固定化酶活,说明高温微波加热对固定化葡萄糖异构酶的稳定性有显著的影响,这可能是由于在高温下微波促进了酶从载体脱落减少了载体保护作用或微波其他非热效应所导致[11,16]。总体说来,虽然微波处理显著地降低了固定化葡萄糖异构酶在高温中的稳定性,但在<70℃时固定化葡萄糖异构酶的热稳定性表现良好且在一定范围内优于水浴对照处理。
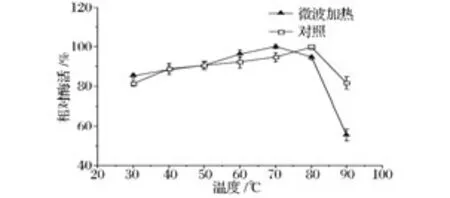
图6 固定化葡萄糖异构酶在微波处理下的热稳定性分析Fig.6 Thermal stability of immobilized glucose isomerase treated by microwave
(2)固定化葡萄糖异构酶的操作稳定性分析
固定化酶的操作稳定性也是其在工业化应用中最重要的性质之一[20]。固定化葡萄糖异构酶的操作稳定性分析结果见图7。
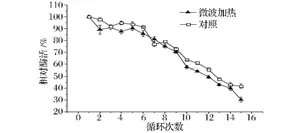
图7 固定化葡萄糖异构酶在微波处理下的操作稳定性分析Fig.7 Operating stability of immobilized glucose isomerase treated by microwave
从图7可以看出,固定化酶在使用次数较少时,表现出的较好的稳定性;在使用6次前,微波加热处理与水浴对照处理的酶活均保持在80%以上,在第6次使用时,两种处理酶活分别为85.66%和91.35%。但随着使用次数的增多,相对酶活缓慢地下降,在使用7次到15次之间时,酶活基本呈线性下降的趋势,在使用15次后,两种处理酶活分别为30.38%和41.66%。从总体上的变化趋势来看,微波处理并未显示改变固定化酶的操作稳定性;后期随着使用次数增多(>10次),微波处理固定化酶操作稳定性降低、酶活损失较大,这可能是由于多次微波处理易导致酶变性引起的[21]。总得说来,微波处理的固定化葡萄糖异构酶仍具有较好的操作稳定性,也能够满足实际生产需求,但比水浴加热条件下操作稳定性要略差些。
3 结论
不同微波功率对固定化葡萄糖异构酶的活性增强程度不同,与水浴对照相比,在最佳微波处理条件下,酶固定化葡萄糖异构酶活性可增加24.50%,说明适宜微波处理用于激活酶是可行的。在此活化过程中,微波处理降低固定化葡萄糖异构酶Km,增大Vmax,但对其最适 pH和最适金属离子浓度几乎没有影响;同时微波处理在一定程度上降低了固定化葡萄糖异构酶的最适反应温度、最适反应温度范围及高温的热稳定性、操作稳定性,但这些参数依旧较为理想,能够满足实际生产需求。
[1] YU H,GUO Y,WU D,et al.Immobilization of glucose isomerase onto GAMM support for isomerization of glucose to fructose[J].Journal of Molecular Catalysis B:Enzymatic,2011,72(1-2):73-76.
[2] GE Y,ZHOU H,KONG W,et al.Immobilization of glucose isomerase and its application in continuous production of high fructose syrup[J].Applied Biochemistry and Biotechnology,1998,69(3):203-215.
[3] Tukel S S,Alagoz D.Catalytic efficiency of immobilized glucose isomerase in isomerization of glucose to fructose[J].Food Chemistry,2008,111(3):658-662.
[4] Bhosale S H,Rao M B,Deshpande V V.Molecular and industrial aspects of glucose isomerase[J].Microbiological Reviews,1996,60(2):280-300.
[5] 张甫生,李蕾,陈芳,等.非热加工在鲜切果蔬安全品质控制中应用[J].食品科学,2011,32(9):329-335.
[6] Rawson A,Patras A,Tiwari B K,et al.Effect of thermal and non thermal processing technologies on the bioactive content of exotic fruits and their products:Review of recent advances[J].Food Research International,2011,44(7):1 875-1 887.
[7] YU D,WANG C,YIN Y,et al.A synergistic effect of microwave irradiation and ionic liquids on enzyme-catalyzed biodiesel production [J].Green Chemistry,2011,13(7):1 869-1 875.
[8] Lukasiewicz M,Marciniak M,Osowiec A.Microwave-assisted enzymatic hydrolysis of starch[C].Lugo:13th International Electronic Conference on Synthetic Organic Chemistry(ECSOC-13),2009-11-30.
[9] Roy I,Gupta M N.Non-thermal effects of microwaves on protease-catalyzed esterification and transesterification[J].Tetrahedron,2003,59(29):5 431-5 436.
[10] Nomanbhay S M,Hussain R,Palanisamy K.Microwave-assisted alkaline pretreatment and microwave assisted enzymatic saccharification of oil palm empty fruit bunch fiber for enhanced fermentable sugar yield[J].Journal of Sustainable Bioenergy Systems,2013,3(1):7-17.
[11] Porcelli M,Cacciapuoti G,Fusco S.Non-thermal effects of microwaves on proteins:thermophilic enzymes as model system[J].FEBS Letters,1997,402(2):102-106.
[12] Young D D,Nichols J,Kelly R M,t al.Microwave activation of enzymatic catalysis[J].Journal of the American Chemical Society,2008,130(31):10 048-10 049.
[13] 胡国洲,张甫生,胡鹏,等.微波处理对葡萄糖异构酶性质的影响[J].食品科学,2014,35(3):134-138.
[14] SONG Y,Kim J,Park C,et al.Enhancement of glucose isomerase activity by pretreatment with substrates prior to immobilization[J].Korean Journal of Chemical Engineering,2011,28(4):1 096-1 100.
[15] Bandish R K,Hess J M,Epting K L,et al.Glucose-tofructose conversion at high temperatures with xylose(glucose)isomerases from Streptomyces murinus and two hyperthermophilic Thermotoga species[J].Biotechnology and Bioengineering,2002,80(2):185-194.
[16] Devece C,Rodríguez-López J N,Fenoll L G,et al.Enzyme inactivation analysis for industrial blanching applications:comparison of microwave,conventional,and combination heat treatments on mushroom polyphenoloxidase activity[J].Journal of Agricultural and Food Chemistry,1999,47(11):4 506-4 511.
[17] Saha B C.Production,purification and properties of endoglucanase from a newly isolated strain of Mucor circinelloides[J].Process Biochemistry,2004,39(12):1 871-1 876.
[18] Saifuddin N,Raziah A Z.Enhancement of lipase enzyme activity in non-aqueous media through a rapid three phase partitioning and microwave irradiation[J].Journal of Chemistry,2008,5(4):864-871.
[19] Hartley B S,Hanlon N,Jackson R J,et al.Glucose isomerase:insights into protein engineering for increased thermostability[J].Biochimica et Biophysica Acta,2000,1 543(2):294-335.
[20] Tumturk H,Demirel G,Altinok H,et al.Immobilization of glucose isomerase in surface-modified alginate gel beads[J].Journal of Food Biochemistry,2008,3(2):234-246.
[21] YANG Z,NIU X,FANG X.et al.Enantioselective esterification of ibuprofen under microwave irradiation[J].Molecules,2013,18(5):5 472-5 481.
