高寒草甸植被层对于草地甲烷通量的影响
2015-12-16郭小伟杜岩功李以康张法伟刘淑丽欧阳经政曹广民
郭小伟,杜岩功,李以康,张法伟,林 丽,刘淑丽,欧阳经政,曹广民
(1.中国科学院 西北高原生物研究所,西宁810001;2.中国科学院大学,北京100049)
青藏高原正遭受全球气候变化和人类活动的双重影响,高海拔地区生态系统对于全球气候变化的响应敏感而又迅速[1]。青藏高原海拔高,其平均海拔4 000m以上,高原基准温度低,草地土壤发育时间短,是气候变化的敏感区和生态脆弱带。植被层是草地系统的重要组成部分,对于草地水分维持,保护土壤微生物和维持草地系统稳定性都有重要作用,而且这些条件对于土壤的甲烷吸收也是至关重要的[2]。植被层对于土壤的甲烷吸收有重要影响,而植被层本身又能释放甲烷[3],因此其对于草地甲烷通量具有两方面的作用。植被根系和根际土壤对于草地的通气性也有重要影响,且有些植物根系分泌的有机物可以被微生物所利用,微生物通过分解有机凋落物可以给植物供应无机营养离子,二者形成的共生关系有利于土壤中甲烷氧化菌的生存和代谢[4]。高寒草甸是青藏高原主要草地类型,约占青藏高原总面积的35%,在高原草地畜牧业中占有十分重要的地位[5],是青藏高原分布最为广泛的草地种类之一,因此具有较好的代表性。高寒草甸植被层对于高寒草甸功能维持和温室气体通量都有重要功能,但目前仅有一些关于高寒草甸整体甲烷通量或者是高寒草甸植物群落甲烷通量的报道,曹广民等[3]通过设置高寒草甸和裸地处理,得到高寒草甸植物群落是大气甲烷的源,其年甲烷排放量达0.2Tg;张裴雷等[6]进行的增氮试验显示增氮处理显著抑制草地土壤的甲烷吸收能力;魏达等[7]对不同的生态系统甲烷通量进行比较,得到了生态系统旱生和湿生条件决定了对CH4吸收和排放,各生态系统CH4吸收通量随当地年均温升高而升高的结论,但是高寒草甸各部分(植被层、土壤根系)的甲烷通量是多少?去除植被层的草地与完整草地相比甲烷通量变化怎样?裸地相比高寒草地甲烷吸收能力增加,但是其年季变化怎样?本研究通过设置完整草地(IHC)、去除地上部分的草地(RAB)和去除地上植被地下根系的裸地(RBB),在青藏高原海北州自2003年6月到2006年10月进行原位观测试验,旨在明晰去除地上植被层和去除所有植物对于草地甲烷通量的影响,并且利用它们的差值计算地上植被的甲烷通量和植物根系的甲烷通量。
1 材料与方法
1.1 研究区域地理位置
实验布置于中科院海北高寒草甸生态系统试验观测站内,其坐落在青藏高原东北隅,祁连山北支冷龙岭东段南麓的大通河河谷,位于101°19′E、37°37′N,站区平均海拔3 280m。年平均温度-1.7℃,最暖月为7月(9.8℃)和最冷月1月(-14.8℃),年均降水量618mm,主要集中生长季(数据来自中科院海北高寒草甸定位研究站)。
1.2 样地设置与样品采集
本研究从2003年6月到2006年10月在青海省海北州进行高寒草甸的原位观测实验。选择长期适应于高寒生态环境下形成的耐寒中生植物高寒矮嵩草草甸为研究对象,其植物群落以矮嵩草(Kobresia humilis)、羊茅(Festuca ovina)、垂穗披碱草(Elymus nutans)、早熟禾(Poa spp.)、恰草(Koeleria cristata)、藏异燕麦(Helictotrichon tibeticum)、小嵩草(Kobresia pygmaea)、苔草(Carex spp.)、二柱头麃草(Scirpus distigmaticus)、麻花艽(Gentiana straminea)、线叶龙胆 (Gentiana farreri)、矮火绒草(Leontopodium nanum)、美丽风毛菊(Saccssurea superba)、雪白萎陵菜(Potentilla nivea)等为主要种,植被覆盖度达95%以上。土壤为草毡寒冻雏形土,土壤草毡表层发育良好,没有发生剥蚀脱落现象,高寒矮嵩草草甸土壤具体特征见表1。
设置三个处理:天然高寒草甸(IHC)、去除地上生物量的草甸(RAB)和去除所有地上地下生物量的裸地(RBB)。于试验进行前一个月进行草地剪草和去除所有根系处理,每个处理设置三个重复,样地选择植物分布比较均匀,地形平坦的高寒草甸进行试验。在2003年8月份于观测样地旁边,植被长势相当的地方采用15cm×15cm样方法估计高寒草甸地上生物量,根钻法(每个重复3钻)估计0—40cm的高寒草甸地下生物量,用以计算单位生物量的地上植物和地下根系的甲烷通量。植物地上生物量甲烷通量通过天然高寒草甸(IHC)和去除地上生物量的草甸(RAB)相减计算,植物根系甲烷通量则是通过去除地上生物量的草甸(RAB)和裸地(RBB)间差值计算。考虑长期试验处理对于植物地上部分和根系生物量的影响,因此在计算植物地上部分生物量和根系甲烷通量时仅采用2003年6月—2004年5月的原位观测数据计算,而试验设置的三种处理甲烷通量仍使用2003年6月—2006年10月三年的原位观测数据。静态箱法测定温室气体通量,采用50cm×50 cm×50cm的箱体,箱体外包有白色塑料泡沫和白色纱布,不透明。植物生长季为5—9月,每月测定4次每周进行一次,每年10月到来年的4月为高寒草甸休眠季,休眠季每月测定2次,于月中和月末进行气体样品采集[3],气体采样时间间隔0,10,20,30min。
1.3 样品分析
气体测定采用气相色谱法(HP4890D,Agilent)。检测器为FID离子火焰化检测器,分离柱为SS-2m×2mm×13XMS(60/80),检测器温度为230℃,分离柱温度为55℃。标准气中CH4浓度为2.24 μl/L,最小检测限0.08μl/L[3-4]。
1.4 计算公式
通量计算公式[3]:

式中:F——温室气体通量;V——静态箱内空气体积;A——静态箱覆盖面积;Ct——t时刻箱内被测气体的体积混合比浓度;t——时间;ρ——标准状态下的被测气体密度;T0,P0——标准状况下的空气绝对摄氏温度和气压;P——采样地点的气压;T——采样时的绝对温度。
1.5 影响因子的测定
在进行温室气体通量测定的同时,测定土壤5cm温度(t1)、地表温度(t2)、箱内温度(t3)和空气温度(t4)、土壤湿度。温度测定使用JM 624便携式数字温度计,土壤湿度(0—10cm)测定使用TDR便携式水分测定仪。
1.6 数据处理
温室气体通量和土壤温度以及湿度的关系采用相关性分析,不同草地温室气体通量间差异比较采用单因素方差分析,本研究中所有统计分析均使用SPSS 20.0统计软件。
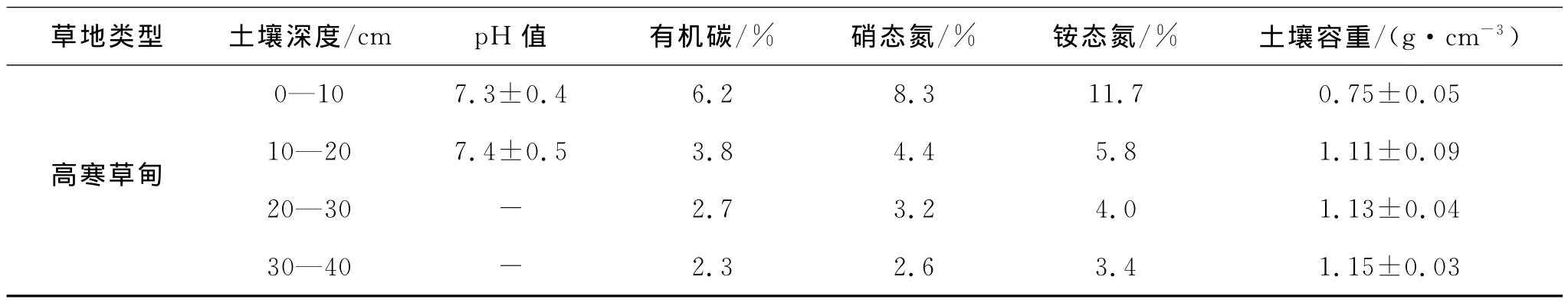
表1 2003年末高寒草甸土壤基本特征
2 结果与分析
2.1 草地植被层和根系对于草地甲烷通量的影响
自2003年6月到2006年10月的原位通量观测结果显示,完整草甸(IHC),去除地表生物量草甸(RAB)和去除地表与地下所有生物量的裸地(RBB)甲烷通量差异显著,单因素方差分析显示,三者的差异达到显著水平(P<0.05)。在2003年、2004年和2005年所有的处理甲烷通量均为负值,所以三种处理的草地在观测期间都表现出了大气甲烷汇的功能。在观测期间草地的平均甲烷氧化速率由高到低依次为:RBB[52.2±18.9μg/(m2·h)]>RAB[32.3±14.7μg/(m2·h)]>IHC[27.9±10.6μg/(m2·h)](图1)。
裸地(RBB)比去除地上生物量草甸(RAB)和完整草甸(IHC)具有更高的甲烷氧化能力。去除所有生物量的裸地RBB处理与天然高寒草甸IHC相比甲烷年吸收量多107.1%,而裸地RBB处理比去除地上部分的RAB处理年甲烷吸收量多28.2%,植被层和根系的去除大大增加了土壤的甲烷吸收能力。以年为重复测量数据进行的重复测量方差分析结果显示,各处理间差异和处理与年交互作用显著(P<0.01),说明完整草甸IHC处理、RAB处理和RBB处理间差异显著,各处理与年季交互作用差异显著。草地甲烷通量具有明显的季节特征,三个处理表现出相同的季节变化。

图1 三种处理草地的甲烷通量特征
三个处理的生长季甲烷通量要显著高于非生长季(P<0.01)(表2),生长季的甲烷吸收峰值出现在6月末或者7月,而冬季甲烷通量最低值出现在12月。完整草甸(IHC),去除地表生物量处理(RAB)和裸低生长季甲烷吸收总量占全年甲烷通量的36.9%,36.1%,38.0%,虽然高寒草地休眠季没有植被生长但是由于青藏高原地区休眠季持续7个月(10月到次年4月),大部分的甲烷吸收还是发生在休眠季。
IHC处理和RAB处理生长季甲烷平均通量的年季差异不显著,且没有明显的规律,但是在2003年、2004年、2005年、2006年生长季裸地处理RBB生长季平均甲烷通量为(-67.7±20.6)μg/(m2·h),(-60.7±18.5)μg/(m2·h),(-58.3±16.3)μg/(m2·h),(-48.9±22.6)μg/(m2·h),裸地的甲烷吸收能力逐年降低,其中除2004年和2005年生长季差异不显著外,其余年份间差异均达到显著水平P<0.05(图2)。
本研究中IHC处理为完整的高寒草甸,RAB为去除地上植被的草地,而RBB处理为去除地上地下生物量的裸地。应用他们之间的差异来计算地上植被层和植物根系的甲烷通量。结果显示草地地上植被和植物根系三年甲烷平均通量为正值,说明植物根系起到了甲烷源的作用。因多年处理会对植物地上生物量和地下根系造成影响,考虑到试验处理设置初期植物地上部分和地下部分能够更好地代表草地在自然状态下植物地上部分和根系甲烷通量,所以本研究以2003—2004年的三种处理来计算草地地上部分生物量和根系甲烷通量,根系在2003—2004年全年平均甲烷通量为(23.5±18.3)μg/(m2·h),其中生长季平均甲烷通量为(33.9±13.7)μg/(m2·h),休眠 季甲烷通量为(7.7±11.9)μg/(m2·h);而草地地上生物量在2003—2004年甲烷平均通量为(7.4±11.5)μg/(m2·h),生长季甲烷通量为(5.1±10.1)μg/(m2·h),休眠季(10.9±12.4)μg/(m2·h)(表2)。在2003年8月通过样方法和根钻法测得高寒草甸地上生物量为(465.8±10.3)g/m2,0—40cm 地下根系总生物量为(2118.7±30.6)g/m2,由此计算2003—2004年单位生物量的草甸地上部分甲烷通量为0.051μg/(g·h),单位生物量的植物根系甲烷通量为0.004μg/(g·h)。

图2 裸地生长季甲烷通量与环境因子间关系

表2 高寒草甸各部分甲烷通量 μg/(m2·h)
2.2 土壤湿度和土壤温度对于甲烷氧化能力的影响
土壤湿度和温度对于土壤中微生物和草地植被的生长都具有直接影响,本研究中在所有测量的温度中(地下5cm温度、地表温度、静态想温度和空气温度),5cm温度与草地的甲烷通量相关性最好,所以本研究采取土壤5cm温度和土壤湿度作为草地甲烷通量研究的主要环境因子。各种草地间土壤湿度差异明显,完整草甸IHC处理、去除地上部分RAB处理和裸地RBB处理全年平均土湿度分别为(40.3±5.8)%,(36.1±6.1)%,(31.2±7.78)%。RAB处理相比IHC处理土壤水分损失10.4%的土壤水分,两者差异达到显著水平(P<0.05)。RBB处理相比IHC处理土壤水分损失22.6%,两者差异也达到显著水平(P<0.05),所有处理的草地甲烷通量与土壤湿度相关性均达到显著水平(P<0.05)。
去除草地地上生物量和裸地处理对于草地5cm温度的影响未达到显著水平(图3),完整草甸IHC处理、去除地上部分RAB处理和裸地RBB处理其全年平均土壤5cm 温度分别为6.4±7.9℃,6.9±7.6℃,7.1±7.8℃。各处理间土壤5cm温度差异不显著。完整草甸IHC处理、去除地上部分RAB处理和裸地RBB处理5cm温度与草地甲烷通量相关性均达到显著水平(P<0.05)(图3)。土壤5cm温度和土壤湿度为草地甲烷通量的主要环境影响因子,完整草甸IHC处理草地甲烷通量与其对应的土壤5 cm温度和土壤湿度做回归分析,得到它们之间的回归方程:Y=-42.7-0.505T+0.509M(r2=0.159,P<0.01),其中T为温度;M为土壤湿度;去除地上生物量处理RAB处理与其对应的土壤5cm温度和土壤湿度做回归分析,得到它们之间的回归方程:Y=-87.8-0.136T+1.426M(r2=0.398,P<0.01);而裸地RBB处理与其对应的土壤5cm温度和土壤湿度做回归分析,得到它们之间的回归方程:Y=72.9-0.289T+0.454M(r2=0.089,P<0.01)。

图3 植物群落甲烷通量与环境因子间关系
3 讨 论
3.1 三种处理间甲烷通量差异
植被层对于草地生态系统的维持和发挥生态功能都是必不可少的,当植被受到气候和人类活动等因素干扰而退化时,植被层不能很好地保持水土,造成水土流失、土壤中微生态系统崩溃等不良后果[8]。关于植被层对于草地甲烷通量的研究比较少,有研究通过设置天然草地与裸地的对比,发现高寒草甸植物群落是大气甲烷的贡献者[3],而通过植被单位生物量甲烷通量计算其年甲烷排放量达0.863Tg[9]。本研究通过设置完整草甸、去除地表生物量的草甸和裸地,将植物群落的甲烷通量研究更加细化为植物地上部分、植物根系对于草地甲烷通量的作用。本研究显示植被地上部分和地下部分都是甲烷的贡献者,而草地甲烷吸收作用来自土壤中甲烷氧化菌的代谢,数量惊人的高寒草甸土壤中的甲烷氧化菌[10]是高寒草甸高甲烷氧化通量的原因。植物地上生物量、地下根系释放甲烷的原因主要有以下几个:(1)植物以未被发现的机制在细胞壁处,以及果胶处大量的一碳单位为底物合成甲烷,继而植物在有氧条件下释放甲烷[11-12];(2)植物体内有发达的维管束系统,在由下而上的运输水和无机物的同时,将土壤深层甲烷菌产生的甲烷通过植物管道系统排出土壤,土壤深层环境受到多层土壤的阻碍,因此形成的厌氧环境有利于甲烷菌生存,甲烷菌产生的甲烷可以经由植物的维管束系统运输到大气,由此观测到了甲烷的排放[13-14];(3)研究中裸地土壤湿度<去除地上部分植被草地<完整的草地,且均达到了显著差异(P<0.05),说明植被层的存在对于草地的保水作用是至关重要的,而土壤湿度通过作用于草地植物生长状况来影响植被的甲烷通量,土壤湿度影响土壤中微生物的数量和代谢速率,对于整个草地系统的甲烷通量影响更大,甚至可以改变草地的甲烷源汇功能[2],高寒草地土壤湿度一般与草地的甲烷氧化能力呈负相关[15],土壤湿度降低增加了土壤的通气性,使大气中的甲烷更容易到达土壤中甲烷氧化菌的位置,进而造成土壤甲烷氧化能力的增加;(4)植被层对于土壤5cm温度也有一定的作用,去除地上植被和地下根系的裸地土壤5cm温度为(7.1±7.8℃),要高于完整草地(6.4±7.9℃)和去除地上植被的草地(6.9±7.6℃),土壤5cm温度与草地甲烷氧化能力呈正相关[14],因此裸地的甲烷氧化能力就更高。
3.2 裸地甲烷通量的年季变化
草地的甲烷通量包括两部分:土壤吸收甲烷和植物排放甲烷,在去除所有植物(包括根系)后的裸地甲烷通量只剩下土壤甲烷通量,因此从去除植物甲烷排放通量的条件下,裸地相比完整草地表现为甲烷吸收能力增加。虽然裸地甲烷吸收能力显著高于去除地上植被的草地和完整草地,但是裸地处理生长季平均甲烷通量表现为逐年下降,其各年生长季平均甲烷通量为(-67.7±20.6)μg/(m2·h),(-60.7±18.5)μg/(m2·h),(-58.3±16.3)μg/(m2·h)和(-48.9±22.6)μg/(m2·h),在2003年、2004年、2005年、2006年裸地的甲烷吸收能力逐年降低,而去除地上生物量的草地和完整草地生长季甲烷平均通量的年季差异不显著,且没有明显的规律。裸地甲烷通量除2004年与2005年差异不显著外,其余年份间生长季甲烷平均通量差异均达到显著水平。在环境因子土壤5cm温度改变不大的情况下,土壤湿度逐年有所下降,按照土壤湿度与甲烷氧化能力负相关的规律[15],裸地的甲烷氧化能力应逐年增加,但事实却出现了相反的结论表现为逐年下降。其原因可能是由于土壤微环境的改变,即土壤微生物群落组成、数量的改变而导致的土壤中甲烷氧化菌氧化土壤孔隙处空气中甲烷能力减弱造成。裸地相比完整的草地没有了植被的保护作用,植被凋落物的缺失引起土壤有机营养物质的减少也使得微生物数量的减少[16],且有植物根系分泌物能够作为某些细菌的营养底物,与一些微生物形成了共生关系[4],当植被去除后微生物的生存和代谢受到土壤水热条件改变的影响,使微生物的数量和种群结构发生改变,当裸地环境改变到一定程度时这些微生物群落将彻底崩溃,此时土壤的甲烷吸收能力也逐渐丧失,因此去除草地植被使之成为裸地,虽然土壤的甲烷氧化能力显著而又迅速的提高,但是这种甲烷氧化能力的增强不能持久,裸地在失去植被保护后不能维持自身系统稳定,在水土流失、自身生态系统崩溃后,其甲烷氧化能力也逐渐减弱。
3.3 环境因子对于草地甲烷通量的影响
土壤5cm温度对于草地甲烷通量有显著影响[17],草地甲烷通量是土壤中甲烷菌代谢产生甲烷、甲烷氧化菌氧化甲烷、植物有氧释放甲烷以及混在空气中的甲烷通过植物体、土壤孔隙进入或离开土壤的诸多过程联合响应的。在此诸多过程中,产甲烷菌和甲烷氧化菌对于温度敏感程度是不一样的,甲烷产生过程对温度最敏感[18],产甲烷菌最适宜的温度是30~40℃,较低的土壤温度不但抑制产甲烷菌的活性,而且降低了参与产甲烷过程的其它微生物的活性[19]。自然条件下,高寒草甸地区植物生长季5—9月,0—30cm地温变化在4.4~18.5℃,远远低于土壤产甲烷菌活动最适宜温度,因此青藏高原地区单位面积高寒草地甲烷排放速率远低于热带森林、热带草原稻田等其他地区[20]。植物在有氧条件下能够排放甲烷,温度对于植物甲烷排放的影响是通过升温使植物新陈代谢增强,加速甲氧基自由挥发形成甲烷完成的[11];另一方面寒冷和过热对于植物的正常生长是一种胁迫条件,植物甲烷的产生或许是对一些胁迫条件的主动适应而进行的主动排放甲烷[21]。本研究中去除地上植被的草地和裸地土壤由于失去植被层的保护,其土壤温度高于天然草地,两种处理的草地甲烷氧化能力也高于完整的高寒草甸,这也反映了土壤温度升高,土壤甲烷氧化能力增强的规律,但是随着年限的增加,裸地处理甲烷氧化能力逐渐降低,可能与失去土壤保护后,裸地土壤温度变化幅度大而迅速,导致甲烷氧化菌数量减少,甚至死亡,最后即使裸地相比天然草地有更高的土壤温度,其甲烷氧化能力也不会高于天然高寒草甸。高寒草地的甲烷通量特征相对于高寒湿地的稳定排放更为复杂,甲烷通量是甲烷产生、消耗、传输等诸多过程的综合结果,因而影响这些过程的因素都会对草地甲烷通量产生影响。土壤水分含量对甲烷产生和消耗过程中产甲烷菌和甲烷氧化菌的数量及活性有重要的影响[10]。试验期间,矮嵩草草甸平均土壤湿度38.4%,没有达到厌氧环境,不利于CH4的产生,高寒草甸较低的土壤水分使得土壤中产甲烷菌和甲烷氧化菌在数量、活性动态平衡过程中,甲烷氧化菌占据了优势[4],继而使得高寒草甸成为大气甲烷的汇。土壤水分还影响土壤的通气性,影响甲烷菌产生的甲烷在离开土壤层之前被甲烷氧化菌氧化多少,并且影响多少含有甲烷的空气进入到土壤甲烷氧化菌的生存位置。土壤湿度增加使得土壤微生物上覆盖一较厚的水膜,从而降低了微生物的活性,同时阻碍了土壤中参与氧化消耗的甲烷的扩散,因为甲烷在水膜中扩散的速率比在土壤空气中的扩散速率低的多[22],这样就降低了土壤甲烷氧化速率,有时甚至系统向大气排放CH4,成为大气CH4的源,这就可以解释一些高寒草甸在生长旺季的零星甲烷排放现象[23]。水文条件对土壤甲烷通量的影响是通过改变土壤通气性和影响微生物活动来发挥作用的[24],而对植物的作用,土壤水分的增加使得植物新陈代谢速度增加,土壤中甲烷在蒸腾作用下与水汽一起排出土壤,在水分过高的高寒草甸或者湿地中由于过高水分胁迫下,植物在缺氧胁迫下也释放甲烷。
4 结 论
为明晰草地植被层对于高寒草甸甲烷通量的影响,本研究进行了为期3年的野外通量观测。结果显示完整草甸、去除地表生物量草甸和裸地甲烷通量差异达到显著水平(P<0.05),在2003年、2004年、2005年和2006年所有的处理甲烷通量均为负值,所以三种处理的草地在观测期间都表现出了大气甲烷汇的功能。在观测期间裸地的三年平均甲烷氧化速率显著高于去除地上生物量的草地和完整草地。根据三种处理计算出的草地地上部分和草地根系的甲烷通量非别为(7.4±11.5)μg/(m2·h)和(23.5±18.3)μg/(m2·h),二者甲烷通量均为正值说明植物地上部分和草地根系都起到了甲烷排放的功能。裸地的甲烷吸收速率逐年降低,除2004年和2005年生长季甲烷通量差异不显著外,其余年份生长季甲烷通量差异均达到显著水平(P<0.05)。在三年的原位观测期间,三种处理甲烷通量与土壤水分、土壤湿度相关性也达到显著水平(P<0.05)。受到时间因素的影响,本研究对于裸地的年季甲烷通量变化观测仅从2003年开始持续了3年,2006年其生长季甲烷氧化能力仅比2003年生长季降低27.8%,更确切的裸地甲烷通量年季变化结论还有待于开展一些时间跨度更为持久的原位通量观测试验。
[1] 孙鸿烈,郑度.青藏高原形成演化与发展[M].北京:广东科技出版社,1998.
[2] Smith C K,Coyea M R,Munson A D.Soil carbon,nitrogen,and phosphorus stocks and dynamics under disturbed black spruce forests[J].Ecological Applications,2000,10(3):775-788.
[3] Cao G M,Xu X L,Long R J,et al.Methane emissions by alpine plant communities in the Qinghai-Tibet Plateau[J].Biology Letters,2008,4(6):681-684.
[4] 胡启武,吴琴,李东,等.不同土壤水分含量下高寒草地CH4释放的比较研究[J].生态学杂志,2005,24(2):118-122.
[5] 韩道瑞,曹广民,郭小伟,等.青藏高原高寒草甸生态系统碳增汇潜力[J].生态学报,2012,31(24):7408-7417.
[6] 张裴雷,方华军,程淑兰,等.增氮对青藏高原东缘高寒草甸土壤甲烷吸收的早期影响[J].生态学报,2013,33(13):4101-4110.
[7] 魏达,旭日,王迎红,等.青藏高原纳木错高寒草原温室气体通量及与环境因子关系研究[J].草地学报,2011,19(3):412-419.
[8] 孟广涛,方向京,李贵祥,等.人工模拟降雨条件下3种多年生牧草水土保持能力分析[J].水土保持研究,2010,17(2):49-53.
[9] 郭小伟,韩道瑞,杜岩功,等.青藏高原高寒草甸优势植物种对大气甲烷行为分异机制[J].山地学报,2012,30(4):470-477.
[10] Zheng Y,Yang W,Sun X,et al.Methanotrophic community structure and activity under warming and grazing of alpine meadow on the Tibetan Plateau[J].Applied Microbiology and Biotechnology,2012,93(5):2193-2203.
[11] Keppler F,Hamilton J T,Brass M,et al.Methane emissions from terrestrial plants under aerobic conditions[J].Nature,2006,439(7073):187-191.
[12] Keppler F,Hamilton J T,McRoberts W C,et al.Methoxyl groups of plant pectin as a precursor of atmospheric methane:evidence from deuterium labelling studies[J].New Phytologist,2008,178(4):808-814.
[13] Nouchi I,Mariko S,Aoki K.Mechanism of methane transport from the rhizosphere to the atmosphere through rice plants[J].Plant Physiology,1990,94(1):59-66.
[14] Nisbet R,Fisher R,Nimmo R,et al.Emission of methane from plants[J].Proceedings of the Royal Society B:Biological Sciences,2009,276(1660):1347-1354.
[15] Wang S,Yang X,Lin X,et al.Methane emission by plant communities in an alpine meadow on the Qinghai-Tibetan Plateau:a new experimental study of alpine meadows and oat pasture[J].Biology Letters,2009,5(4):535-538.
[16] 姜红梅,李明治,王亲,等.祁连山东段不同植被下土壤养分状况研究[J].水土保持研究,2011,18(5):166-170.
[17] 杜睿,陈冠雄,吕达仁,等.内蒙古草原生态系统—大气间N2O和CH4排放通量研究的初步结果[J].气候与环境研究,1997,2(3):264-272.
[18] Segers R.Methane production and methane consumption:a review of processes underlying wetland methane fluxes[J].Biogeochemistry,1998,41(1):23-51.
[19] Conrad R.Soil microorganisms as controllers of atmospheric trace gases(H2,CO2,CH4,OCS,N2O,and NO)[J].Microbiological Reviews,1996,60(4):609-640.
[20] 沈壬兴,上官行健,王明星,等.广州地区稻田甲烷排放及中国稻田甲烷排放的空间变化[J].地球科学进展,1995,10(4):387-392.
[21] 张秀君,江丕文,董丹,等.植物排放甲烷的研究进展[J].云南植物研究,2010,32(2):177-182.
[22] Koschorreck M,Conrad R.Oxidation of atmospheric methane in soil:measurements in the field,in soil cores and in soil samples[J].Global Biogeochemical Cycles,1993,7(1):109-121.
