开菲尔粒增殖条件的优化研究
2015-12-16刘克营钟浩郭爱珍刘朋龙王亮
刘克营,钟浩,郭爱珍,刘朋龙,王亮
(1.江苏大学食品与生物工程学院,江苏镇江212013;2.天润乳业股份有限公司,乌鲁木齐830000)
0 引言
开菲尔粒是一种天然的发酵剂,其中乳酸菌最多,其次是酵母菌和醋酸菌[1]。开菲尔粒在发酵过程中容易造成发酵不均匀等问题,严重影响了开菲尔的风味和质构[2-3]。而纯培养发酵剂不仅连续传代活力不稳定,而且易发生杂菌污染或共生菌群失衡,产品的质量不稳定,从而使传统开菲尔饮品难以实现工业化生产[4]。而开菲尔粒冻干粉的使用可以有效解决以上难题,因此,开菲尔粒的生产至关重要。
目前,许多研究从不同的角度分析了不同的因素对开菲尔粒增殖的影响[5-11],但仍需要不断的探索和研究。本研究对开菲尔粒发酵过程中的物理因素、pH值、营养条件进行研究,从而找出最佳的开菲尔粒增值条件,扩大开菲尔粒冻干粉的生产,促进开菲尔产业的发展。
1 实验
1.1 材料
纯牛奶(市售),低脂牛奶(市售),脱脂牛奶(市售),开菲尔粒,胰蛋白胨LP0037,酵母提取物LP0021,蔗糖,乳糖,葡萄糖,氯化钠。
1.2 培养基
MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,KH2PO4为2 g,柠檬二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温80为1mL,MgSO4·7H2O为0.58 g,Mn-SO4·4H2O 为 0.25 g,蒸馏水1000 mL,pH值为6.2~6.4。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,蒸馏水1 000 mL,pH值为7.4。
1.3 仪器
SW-CJ系列洁净工作台(苏州安泰空气技术有限公司),QYC 200全温空气摇床,pH计,BPMJ-250F型霉菌培养箱,手提式不锈钢压力蒸汽灭菌器,BSA124S-CW电子天平,LSHZ-300型低温水浴培养箱。
1.4 方法
1.4.1 开菲尔粒的活化
将冻存的开菲尔粒取出,按2%的比例接种到灭菌乳中,在28℃,100 r/min条件下培养,每24 h,测发酵液的pH值,并将开菲尔粒重新接种到新鲜灭菌乳中。重复6 d。
1.4.2 开菲尔粒的增殖
1.4.2.1 物理因素对开菲尔粒增值的影响。
(1)清洗搅拌对开菲尔粒增值的影响。将4份灭菌乳放入三角瓶中,然后将开菲尔粒按2%的比例接种到灭菌乳中。①搅拌,100 r/min,28℃条件下,每24 h过滤出开菲尔粒,无菌水冲洗,用无菌滤纸吸干开菲尔粒表面水分称重。②搅拌,100 r/min,28℃条件下,每24 h过滤出开菲尔粒,用无菌滤纸吸干开菲尔粒表面水分称重。③不搅拌,28℃条件下,每24 h过滤出开菲尔粒,无菌水冲洗,用无菌滤纸吸干开菲尔粒表面水分称重。④不搅拌,28℃条件下,每24 h过滤出开菲尔粒,用无菌滤纸吸干开菲尔粒表面水分称重,最后再次接种到新鲜的灭菌乳中。如此重复6 d。
(2)开菲尔粒的大小对开菲尔粒增殖的影响。将直径为大于1 cm、0.5~1 cm和小于0.5 cm的开菲尔粒按2%的比例分别接种到灭菌乳中,100 r/min,28℃条件下培养,每24小时过滤出开菲尔粒,用无菌滤纸吸干开菲尔粒表面水分称重。如此重复6 d。
(3)不同的发酵条件对开菲尔粒增殖的影响。以发酵温度、接种量、搅拌速度、发酵时间为因素设计正交实验(表1),到时间后,用无菌滤纸吸干开菲尔粒表面水分后称重,然后再次接种到新鲜的灭菌乳中。如此重复6 d。
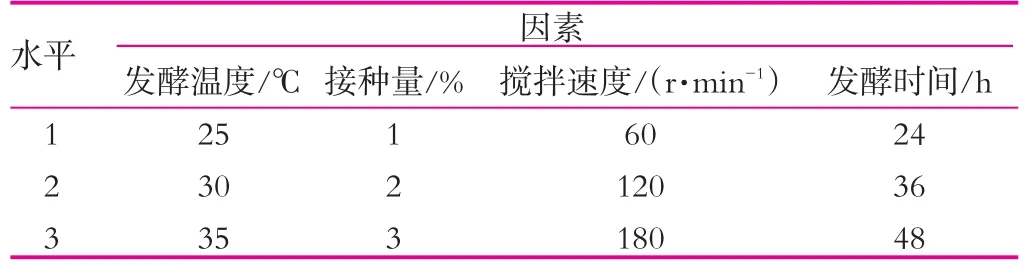
表1 正交实验(I)
1.4.2.2 pH值对开菲尔粒增殖的影响。
准备3份活化的开菲尔粒,分别做以下处理:①取一份接种到灭菌乳中,连续培养3 d不作处理,3 d后取出测定开菲尔粒的质量。②取一份接种到灭菌乳中,每天用浓度为0.1 mol/L氢氧化钠溶液调节发酵液的pH值至6.45,连续培养3 d,3 d后取出测定开菲尔粒的质量。③取一份接种到灭菌乳中,每天更换培养基,测定开菲尔粒的质量,其中培养条件均为30℃,120 r/min。
1.4.2.3 营养成分对开菲尔粒增殖的影响。
(1)不同的培养基质对开菲尔粒增殖的影响。将开菲尔粒按2%的比例接种到相同体积的灭菌乳,MRS培养液,LB培养液中搅拌培养,30℃(120 r/min)条件下培养,每24 h过滤出开菲尔粒,用无菌滤纸吸干开菲尔粒表面水分称重,如此重复6 d。
(2)不同碳源对开菲尔粒增值的影响。在灭菌乳中分别加入质量分数为1%的乳糖、葡萄糖、蔗糖,然后接种开菲尔粒,在最佳的条件下培养,30℃(120 r/min)条件下培养,每24 h过滤出开菲尔粒,无菌滤纸吸干开菲尔粒表面水分后称重,然后再次接种到新鲜的灭菌乳中,如此重复6 d。
(3)不同氮源对开菲尔粒增殖的影响。在灭菌乳中分别加入质量分数为1%的胰蛋白胨、酵母粉,然后接种开菲尔粒,在最佳的条件下培养,30℃(120 r/min)条件下培养,每24 h过滤出开菲尔粒,无菌滤纸吸干开菲尔粒表面水分后称重,然后再次接种到新鲜的灭菌乳中,如此重复6 d。
(4)正交实验。在上述实验得到的最佳的条件基础上,然后以碳源、氮源、脂肪和氯化钠为因素设计正交实验(表2),30℃(120 r/min)条件下培养,每24h过滤出开菲尔粒,无菌滤纸吸干开菲尔粒表面水分后称重,然后再次接种到相应的新鲜的灭菌乳中,如此重复6 d。
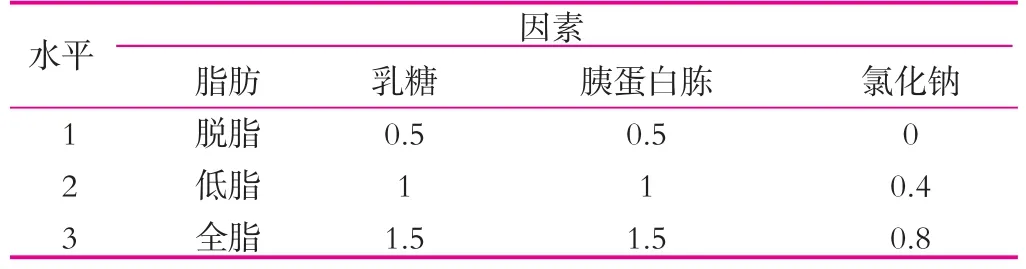
表2 正交实验(II) %
2 结果与分析
2.1 开菲尔粒的活化
开菲尔粒低温保存时,开菲尔粒中菌种活性保持很低的水平,在活化的过程中,菌种的活性逐渐达到最佳状态。由图1可以看出,随着活化的进行,发酵液的pH值逐渐降低,当开菲尔粒活化4次后,发酵液pH值在3.9左右波动,这说明开菲尔粒的活化状态已达到最佳状态。
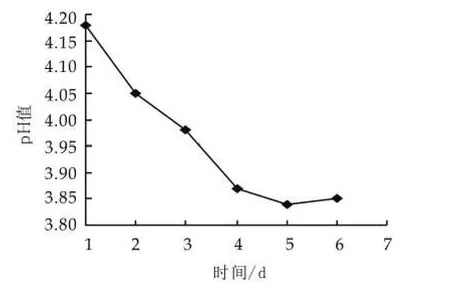
图1 开菲尔粒的活化
2.2 开菲尔粒的增殖
2.2.1 物理因素对开菲尔粒增殖的影响
(1)清洗搅拌对开菲尔粒增值的影响。开菲尔粒表面的清洗可以有效地避免开菲尔粒表面杂菌的污染,而搅拌也可以防止霉菌在开菲尔的表面生长[5]。虽然清洗和搅拌在防止污染方面起到一定的作用,但阻碍了开菲尔粒的增殖。由图2可以看出,搅拌有利于开菲尔粒的增殖,而清洗不利于开菲尔粒的增殖。
这是由于在搅拌的过程中,加大了发酵液中的氧气质量分数以及有利于营养成分分布均匀,从而加快了开菲尔粒中的酵母菌、乳酸菌和醋酸菌的生长,因此搅拌有利于开菲尔粒的增殖[12]。另外,开菲尔粒在增殖的过程中会在开菲尔粒的表面形成一层多糖物质,即为开菲尔粒的组成成分,而在清洗的过程中,这种多糖物质会被破坏,从而影响开菲尔粒的增殖。所以搅拌不清洗的效果是最好的,七天的培养使开菲尔粒的增殖率达到106%,增加了一倍。
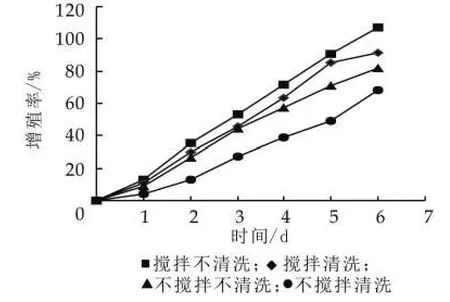
图2 搅拌清洗对开菲尔粒增殖的影响
(2)开菲尔粒的大小对开菲尔粒增殖的影响。开菲尔粒是由多糖物质、蛋白质和各种菌种组成的粒状发酵剂,而菌种在开菲尔粒的表面和内部都有分布[12-15]。开菲尔粒的增殖过程其实就是一个菌种的增殖和多糖物质的合成过程,而这个过程需要开菲尔粒内外菌种的共同作用来完成。开菲尔粒的表面积越大,越有利于开菲尔粒内部与外部营养物质的交流和产物的合成。从而加速菌种的繁殖和多糖物质的合成。另外,相同质量的开菲尔粒粒径越小,开菲尔粒的表面积就越大,相反开菲尔粒的表面积就越小。
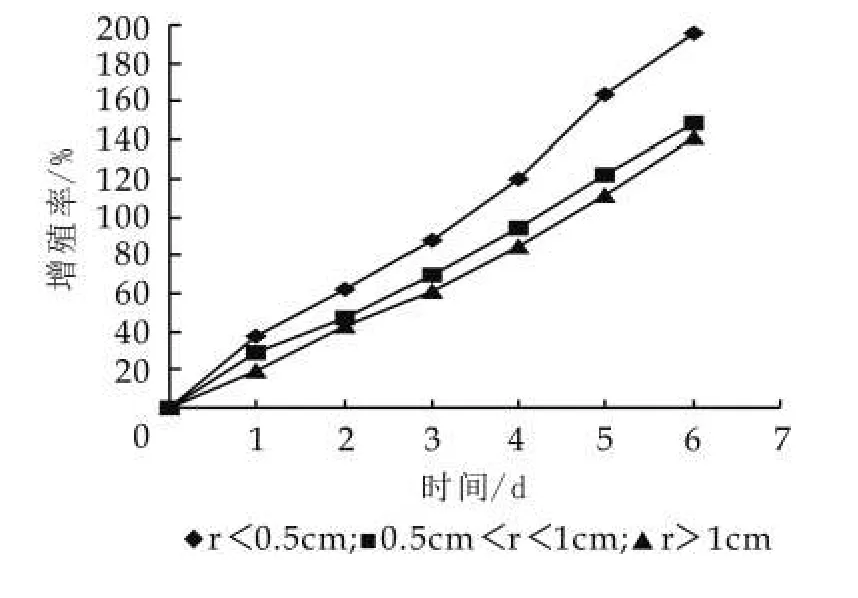
图3 粒径大小对其增殖的影响
由图3可以看出,开菲尔粒越小开菲尔粒的生长速度越快。当开菲尔粒的粒径小于0.5 cm时,连续培养7 d开菲尔粒增长率达到195.3%,而粒径超过1 cm的开菲尔粒的增长率只是141.4%。因此,开菲尔粒的大小对开菲尔粒增殖是有影响的,开菲尔粒越小越有利于开菲尔粒的增殖,越大越不利于开菲尔粒的增殖。当然也不是越小越好,要符合现实情况。
(3)不同发酵条件对开菲尔粒增殖的影响。在已得最佳条件下,进行发酵温度、发酵时间、搅拌速度和接种量正交实验,结果如表3所示。
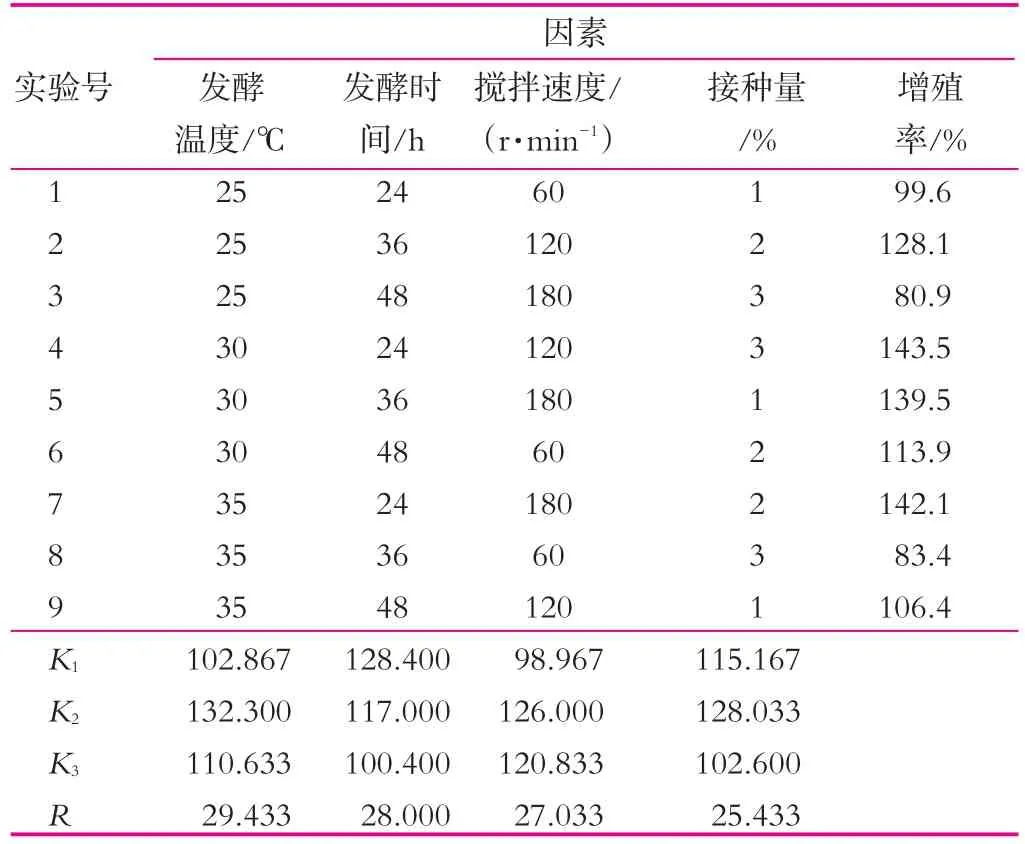
表3 各因素和接种量正交实验结果
由表3可以看出,4种不同的因素对开菲尔粒增殖的影响大小不同,其影响主次顺序是发酵温度>发酵时间>搅拌速度>接种量。通过表3中的极差分析可得出,开菲尔粒的最佳的增殖条件是发酵温度30℃,发酵时间24 h,搅拌速度为120 r/min,接种量2%。
2.2.2 pH值对开菲尔粒增殖的影响
开菲尔粒发酵前期,发酵液中营养成分充足,生长环境适宜,开菲尔粒中的菌种代谢旺盛,而随着发酵的进行,生长环境逐渐变的恶劣,减缓了菌种的增殖,同时因为酸性的增强,抑制了产粘细菌代谢产生粘性多糖,从而阻碍了开菲尔粒的增殖。由表4可以看出,相同条件下,3处理比1处理的增长率高30.3%,而2和3增长率相差仅6.5%。所以,pH值的变化也是影响开菲尔粒增殖的一个重要因素。
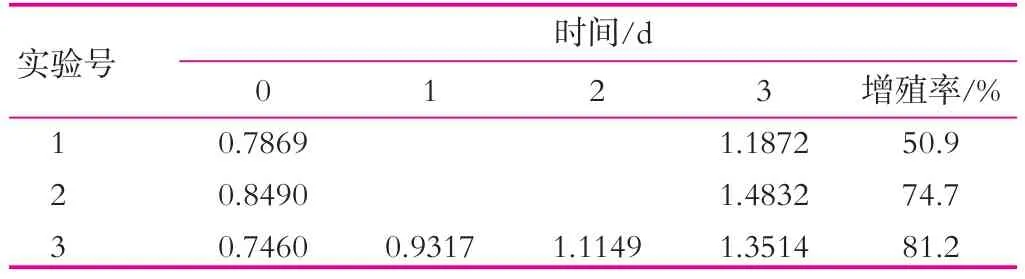
表4 pH值对开菲尔粒增殖的
2.2.3 营养成分对开菲尔粒增殖的影响
(1)不同培养基质对开菲尔粒增殖的影响。由图4可以看出,不同培养基影响开菲尔粒的增殖。其中灭菌乳是开菲尔粒增殖的最佳培养基,相同培养条件下,在灭菌乳中开菲尔粒的增殖率达到85%,MRS次之,LB培养基最差。这是由于开菲尔粒中主要包括乳酸菌和酵母菌,LB培养基虽然是基本培养基,但它不是最佳培养基,它只是为微生物提供基本的生存保证,在里面微生物得不到快速繁殖,而MRS培养基是乳酸菌培养基,它有利于乳酸菌的快速增殖,但是它不利于开菲尔粒中酵母菌的增殖,所以开菲尔粒的增殖速度虽然比在LB培养基中高,但还是不能满足要求。灭菌乳中各种营养成分充足,而且并不对某种菌进行选择性抑制,这使得乳酸菌和酵母菌都能在灭菌乳中进行快速繁殖,从而加速开菲尔粒的增殖。因此,在灭菌乳中,开菲尔粒的增殖率最高。
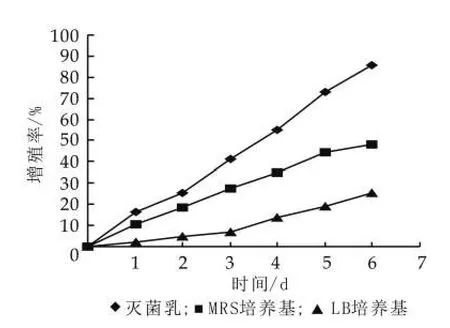
图4 培养基质对开菲尔粒增殖的影响
(2)不同碳源对开菲尔粒增殖的影响。开菲尔粒中菌种的组成是多样的,而不同的菌种对碳源需求是不同的,本试验取了三种基本的糖(乳糖、葡萄糖、蔗糖),研究不同的糖对开菲尔粒增殖的影响。由图5可以看出,不是所有的糖对开菲尔粒的增殖有促进作用,相同条件培养,乳糖对开菲尔粒增殖有明显的促进作用,葡萄糖对开菲尔粒的增殖的也有促进作用,但效果不如乳糖,而蔗糖对开菲尔粒增殖的作用最小,在一定程度上会抑制开菲尔粒的增殖。
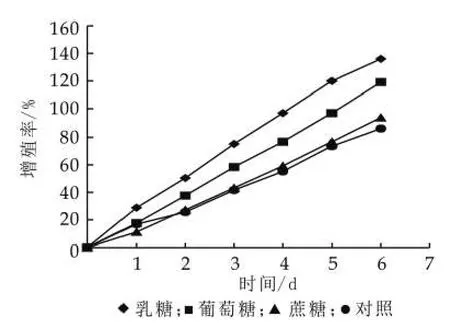
图5 不同碳源对开菲尔粒增殖的影响
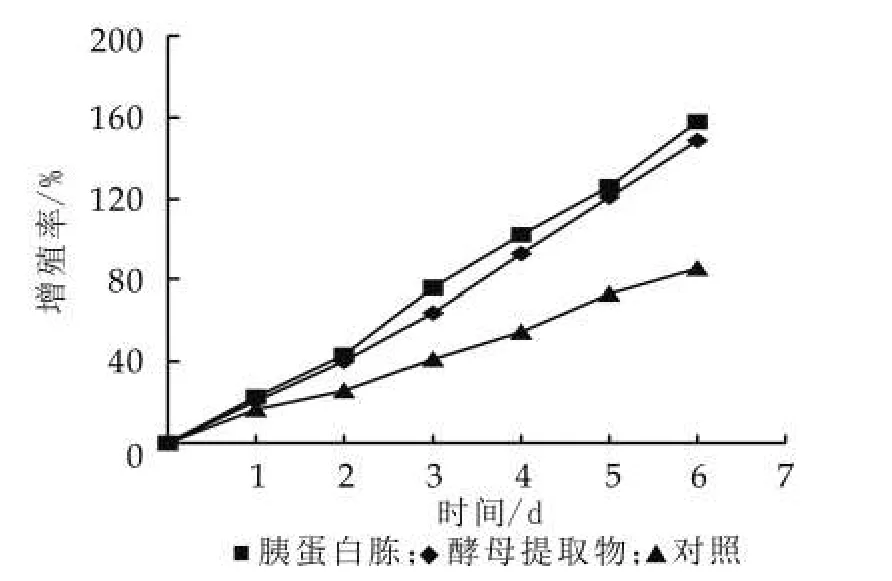
图6 不同碳源对开菲尔粒增殖的影响
(3)不同氮源对开菲尔粒增殖的影响。在培养初期,开菲尔粒中的乳酸菌利用乳中氨基酸和蛋白质,快速反应,产生大量的酸,从而导致了发酵液中氨基酸和蛋白质的不足,抑制了产粘菌种的繁殖和代谢,进而影响了开菲尔粒的增殖[5]。本文以胰蛋白胨和酵母提取物为两种氮源物质,以期选出一种对开菲尔粒增殖最佳的氮源。由图6可以看出,酵母提取物和胰蛋白胨对开菲尔粒都有促进作用,而添加胰蛋白胨的效果比添加酵母提取物的效果要好。这符合Anine Schoevers等的研究成果,他们发现在促进开菲尔粒增殖方面,胰蛋白胨的效果优于酵母提取物[6]。
(4)正交实验。在已得最佳条件下,进行脂肪质量分数、乳糖质量分数、胰蛋白胨质量分数和氯化钠质量分数的正交实验,结果如表5所示。
由表5可以看出,4种不同的因素对开菲尔粒增殖的影响大小不同,其影响主次顺序是脂肪质量分数>氯化钠质量分数>胰蛋白胨质量分数>乳糖质量分数。通过表5中的极差分析可得出,开菲尔粒的最佳的增殖条件是脱脂牛奶、乳糖0.5%,胰蛋白胨0.5%和氯化钠0.8%(均为质量分数)。由此可知,乳糖和胰蛋白胨的添加量并不是越多越好。按正交实验的最优水平进行实验,结果如图7所示。由图7可以看出,开菲尔粒的增殖率最低增加了31.08%,因此可知,正交实验结果准确。
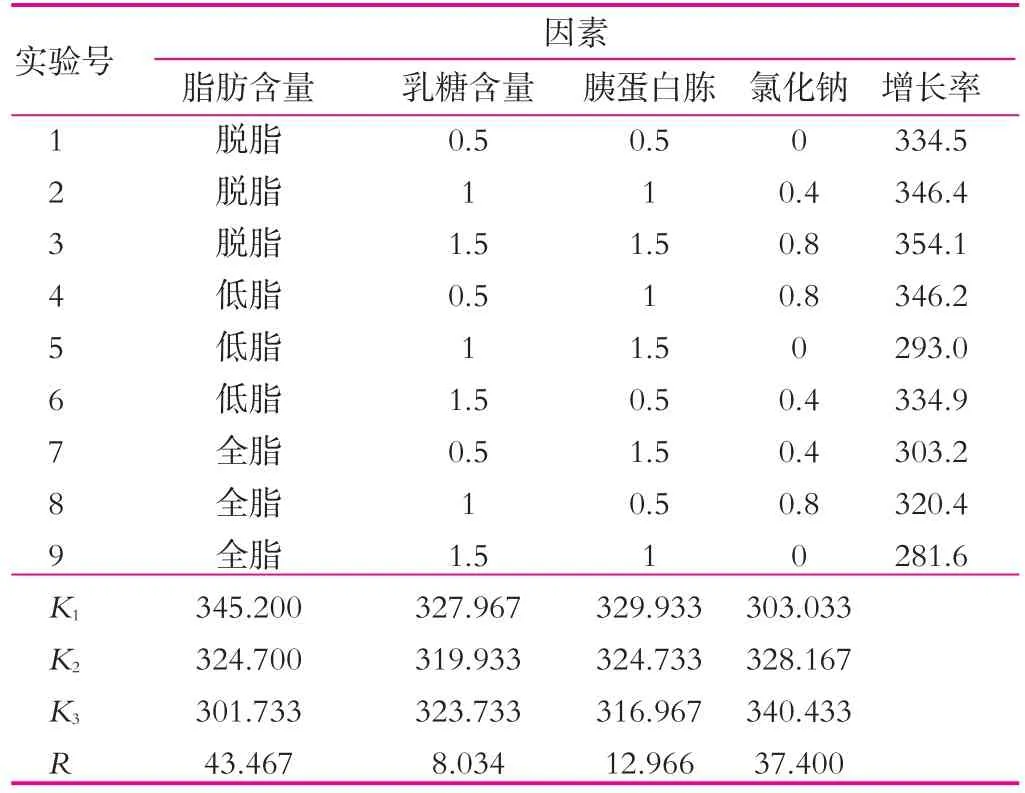
表5 脂肪、乳糖、胰蛋白胨和氯化钠正交实验结果 %
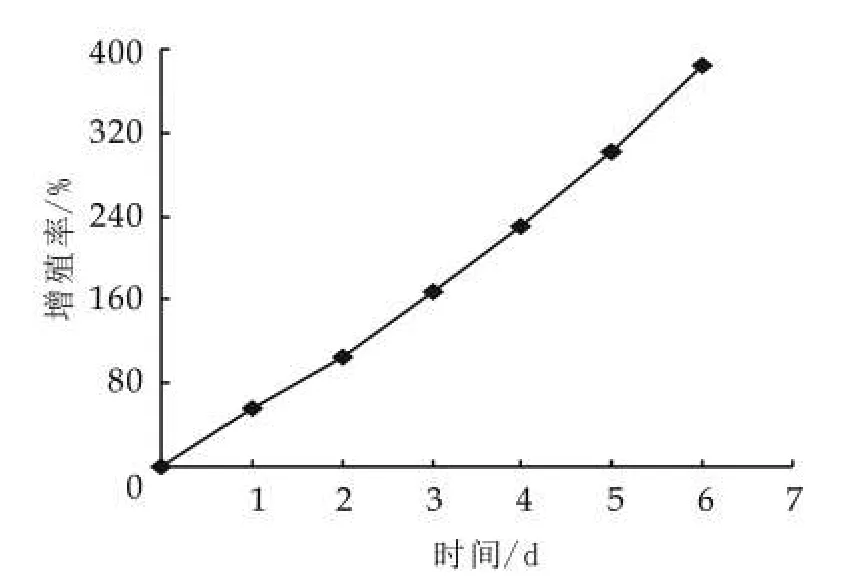
图7 最佳条件下开菲尔粒的增长
3 结论
本研究发现,开菲尔粒在连续接种培养3天时达到最高的活性状态,发酵液的pH值稳定在3.9左右。另外,通过对增殖工艺(清洗搅拌,粒径大小)和增殖条件(培养温度、培养时间、接种量、搅拌速度)进行单因素和正交试验得出,清洗减缓了开菲尔粒的增殖速度,搅拌有利于开菲尔粒的增殖;当粒径小于0.5 cm时开菲尔粒的增殖速度最快;而且还得出当发酵温度为30℃,发酵时间是24 h,搅拌速度为120 r/min和接种量为2%时,开菲尔粒的增殖速度最大。
另外,研究发现,相同条件下培养,调节发酵液pH值的变化可使开菲尔粒的增长率比不做处理的开菲尔粒的增长率高出23.8%,而这比更换培养基的对照组仅仅低了6.5%。由此可得出,连续3 d发酵的过程中,营养成分的变化并不是主要的因素,pH值的变化才是影响开菲尔粒增殖的主要因素。
关于营养成分对开菲尔粒增殖的影响。通过单因素试验得出,牛奶是开菲尔粒增殖的最佳营养基质;胰蛋白胨的效果比酵母粉的效果好;乳糖对促进开菲尔粒增殖的效果最好,葡萄糖次之,而添加葡糖糖的效果不明显,甚至在一定程度上削弱了开菲尔粒的增殖速度。另外,通过正交试验得出,当使用脱脂牛奶,胰蛋白胨添加量为0.5%,乳糖添加量为0.5%以及氯化钠添加量为0.8%时,开菲尔粒的增殖率最高,接近普通牛奶发酵增殖率的2倍。
最后,利用所得最佳条件进行开菲尔粒的增殖实验,结果显示,开菲尔粒的增殖率比实验过程中的最佳水平高出31个百分点,增殖效果明显。
[1]WITTHUHN R C,SCHOEMAN T,BRITZ T J.Characterisation of the microbial population at different stages of Kefir production and Kefir grain mass cultivation[J].International Dairy Journal,2005,15(4):383-389.
[2]金世琳.古老而新型的酒精性发酵乳饮料[J].饮料工业,1999,2(1):16-21.
[3]张列兵,刘鹏,周伟明,等.开菲尔粒基质和产生开菲尔基质的微生物[J].中国乳品工业,1996,24(6):42-44.
[4]张列兵,刘鹏,程涛,等.酸牛奶酒(Kefir)工艺学研究进展评论[J].中国乳品工业,1996,24(2):20-22.
[5]任雅丽,李博,籍保平,等.培养条件及营养元素对开菲尔粒增殖的影响[J].食品科学,2007,27(12):512-517.
[6]SCHOEVERS A,BRITZ T J.Influence of different culturing conditions on kefir grain increase[J].International journal of dairy technology,2003,56(3):183-187.
[7]GORSEK A,TRAMSEK M.Kefir grains production—An approach for volume optimization of two-stage bioreactor system[J].Biochemical Engineering Journal,2008,42(2):153-158.
[8]王蕊,高翔,孔令伟.影响开菲尔粒(Kefir grains)增殖因素的研究[J].食品科技,2009(6):12-16.
[9]HABIBI N,SOLEIMANIAN-ZAD S,ZEINODDIN M S.Optimization of kefir grains production by using taguchi technique and mini-fermentation[J].World Applied Sciences Journal,2011,12(5):613-618.
[10]GHASEMLOU M,KHODAIYAN F,GHARIBZAHEDI S M T.Enhanced production of Iranian kefir grain biomass by optimization and empirical modeling of fermentation conditions using response surface methodology[J].Food and Bioprocess Technology,2012,5(8):3230-3235.
[11]GAO J,GU F,RUAN H,et al.Culture Conditions Optimization of Tibetan Kefir Grains by Response Surface Methodology[J].Procedia Engineering,2012,37:132-136.
[12]高莉莉,葛春美,韩俊华,等.Kefir奶的制作工艺及标准[J].中国乳品工业,2003,31(3):22-25.
[13]赵琦,陆苏丹.波兰的Kefir生产[J].上海奶牛,1992(2):34-35.
[14]GARROTE G L,ABRAHAM A G,DE ANTONI G L.Chemical and microbiological characterisation of kefir grains[J].Journal of Dairy Research,2001,68(04):639-652.
[15]张列兵,苑伍申.开菲尔粒表面超微结构及微生物在开菲尔粒表面分布的研究[J].中国乳品工业,1998,26(1):14-15.
