盐涝互作对甜菜出苗率及幼苗的影响
2015-12-16付婷婷赵维维徐燕阁王风霞刘冉冉时伟伟宋杰
付婷婷,赵维维,徐燕阁,王风霞,刘冉冉,时伟伟,宋杰
(山东师范大学生命科学学院/逆境植物重点实验室,济南250014)
盐涝互作对甜菜出苗率及幼苗的影响
付婷婷,赵维维,徐燕阁,王风霞,刘冉冉,时伟伟,宋杰*
(山东师范大学生命科学学院/逆境植物重点实验室,济南250014)
研究了1和120 mmol/L NaCl以及水淹处理对两个甜菜品种(系)Y-86-5-1(以下简称Y-86)和Y-77-6-3(以下简称Y-77)出苗率及幼苗生物量、叶绿素含量以及离子含量的影响。结果表明,120 mmol/LNaCl处理对Y-86的出苗率没有显著影响,却降低Y-77的出苗率。1和120 mmol/L NaCl盐度下水淹对Y-86的出苗没有显著影响,而120 mmol/L NaC l盐度下水淹处理明显降低Y-77的出苗率。盐分降低两个品种的地上和根系干重以及叶绿素含量,尤其是Y-77。盐分显著增加两个品种叶片Na+含量,降低K+含量,尤其是Y-77。1和120mmol/L N aC l盐度下水淹降低Y-86和Y-77的地上和根干重,尤其是Y-77的根干重。水淹对Y-86叶片叶绿素含量没有显著影响,却明显降低Y-77的叶绿素含量。水淹对Y-86叶片Na+含量无显著影响。1 mmol/L NaC l盐度下水淹对Y-77叶片Na+含量无显著影响,而120 mmol/LNaC l盐度下水淹增加Y-77叶片Na+含量。水淹降低Y-86和Y-77叶片K+含量。两个品种相比,Y-86比Y-77对盐涝互作具有更强的适应性。
甜菜;盐涝;出苗率;生物量;叶绿素;离子
我国甜菜年播种面积为40万hm2~60万hm2,占糖料作物总播种面积的40%,是我国第二大糖料作物,甜菜糖占全国食糖总产量的15%~20%[1]。由于甜菜是制糖的主要原料,因此其在种植业结构调整中起着重要作用[2]。甜菜耐盐碱、耐干旱、耐严寒、适应性强。低盐浓度促进甜菜生长,高盐环境下甜菜生长受到抑制[3]。Ghoulam等[4]研究发现与其它耐盐植物一样,甜菜可以利用无机离子进行渗透调节,而耐盐性不同的甜菜在Na+积累方面无明显不同。除了无机离子,脯氨酸和甜菜碱等在甜菜渗透调节中也起到重要作用[5]。黄河三角洲约有43万hm2盐碱土,占其总面积的50.9%,这些盐碱土不适合普通农作物的生长[6]。由于黄河三角洲特殊的地理位置,形成了低湿地、季节性积水地,易造成洪涝灾害。目前有关甜菜耐盐性的筛选及抗盐机理研究,以及提高甜菜产量和含糖的措施方面,国内外作了大量的研究[2,7-8],但盐涝互作对甜菜影响却鲜见报道。
1 材料与方法
1.1试验材料
甜菜品种(系)Y-86-5-1(以下简称为Y-86)和Y-77-6-3(以下简称为Y-77),均由山东大学提供,种子晾干后存于4℃冰箱。
1.2植物的培养和处理
1.2.1出苗阶段挑选籽粒饱满的Y-86和Y-77的甜菜种子,分别播种于口径16 cm,高度13 cm盛有洗净河沙的塑料花盆中。试验设两个NaCl浓度梯度:1和120mmol/L(均以1/2 Hoagland溶液配制)。每个品种16盆,每盆播种10粒种子。每个品种(系)的8盆置于盛有以1/2的Hoagland配制的1和120mmol/LNaCl的小桶中,使液面高于沙面1~1.5 cm进行水淹处理,每个盐浓度4个重复。水淹5d后将花盆移出(以黄河三角洲盐碱地夏播为例,一般持续水淹不会超过5d),分别用1和120 mmol/L NaCl正常浇灌,每天记录出苗数。另外8盆作为对照不进行水淹处理,每天以1和120 mmol/LNaCl浇灌,每个浓度4个重复,每天记录出苗数。
出苗率=a/b×100%(其中a表示每盆出苗的总数,b表示每盆播种的种子数)。
1.2.2幼苗阶段挑选籽粒饱满的Y-86和Y-77的甜菜种子,分别播种于盛有洗净河沙的塑料盆中,每个品种(系)12盆,以1/2的Hoagland每天浇灌,间苗至每盆10株。
待幼苗长至两片真叶时,用1和120 mmol/L NaCl(均以1/2的Hoagland配制)分别对两个品种(系)幼苗进行水淹和正常沙培处理,每个处理3个重复。为了避免盐冲击,120 mmol/L NaCl处理的每天递增20 mmol/L,终浓度后处理21d测定Y-86和Y-77叶绿素、叶片离子含量以及地上和根的干重。
1.3测定方法
1.3.1甜菜幼苗地上部分及根干重的测定将Y-86和Y-77的地上部分与根分别收获,快速冲洗干净后用吸水纸吸干表面水分。于105℃条件下的烘箱中杀青15min,然后在80℃条件下将其烘干,至恒重,称干重(DW)。每处理3个重复。
1.3.2叶片无机离子的测定将Y-86和Y-77甜菜叶片快速冲洗干净后用吸水纸吸干表面水分,称取相同叶位的新鲜叶片,剪碎后放入试管,加入10 mL去离子水,封口,于沸水浴中浸提60 min,取滤液,将其定容至25 mL。用410型火焰光度计(英国Sherood公司)测定甜菜叶片Na+、K+含量,同时测定相同叶位叶片的含水量,离子含量最终换算成mmol/g DW。每处理3个重复。
1.3.3叶绿素含量的测定取Y-86和Y-77甜菜叶片(相同叶位),称取0.3 g,装入试管后分别加入5 mL二甲基亚砜及80%的丙酮,摇匀后,于65℃恒温水浴锅内提取叶绿素(至叶片变白),待其冷却后,以丙酮(80%)定容至25mL,用紫外可见分光光度计(T6新世纪分光光度计)测吸光度(663 nm及645 nm),叶绿素a、叶绿素b、以及叶绿素a+b含量。
所得数据采用SAS统计软件进行三因素显著性分析。
2 结果
2.1甜菜出苗率
Y-86(图1A)和Y-77(图1B)水淹5d均没有出苗,恢复正常浇水5d后才开始出苗。而正常浇水的在播种5~6d后均开始出苗,水淹延迟了甜菜出苗。

图1 盐涝互作对甜菜Y-86(A)和Y-77(B)出苗率的影响
无论水淹还是正常沙培处理条件下,盐分对Y-86的最终出苗率(处理28d)没有显著影响。1和120 mmol/LNaCl水淹与正常沙培相比,Y-86的最终出苗率(处理28d)没有明显差异(图1A)。
1mmol/LNaCl水淹与正常沙培相比,Y-77的最终出苗率没有明显差异。而120mmol/LNaCl条件下,与正常沙培处理相比Y-77水淹处理降低其最终出苗率。正常沙培条件下,盐分对Y-77的最终出苗率没有影响。水淹处理下,120 mmol/L NaCl却明显降低其最终出苗率(图1B)。
2.2甜菜地上部分和根干重
无论水淹还是正常沙培处理,120mmol/L NaCl均显著降低Y-86和Y-77地上部分干重,而且对两个甜菜品种影响趋势相似(图2A)。与Y-86相比,120mmol/L NaCl更明显地降低Y-77根的干重(图2B);1和120 mmol/L NaCl处理下,水淹降低Y-86和Y-77地上部分干重的趋势相似。而与Y-86相比,水淹更加明显地降低Y-77根的干重(图2B)。

图2 盐涝互作对甜菜Y-86和Y-77地上(A)和根干重(B)的影响
2.3甜菜叶片离子含量
无论水淹还是正常沙培,Y-86和Y-77叶片Na+含量均随盐浓度升高而增加,Y-77增加的更明显(图3A)。K+含量随盐浓度升高而降低,Y-77降低的更明显(图3B)。1和120 mmol/LNaCl处理下,水淹对Y-86叶片Na+含量均没有影响。120 mmol/LNaCl处理下,水淹增加Y-77叶片Na+含量。1和120mmol/LNaCl处理下,水淹降低Y-86和Y-77叶片K+含量。与Y-86相比,Y-77降低的更明显(图3)。
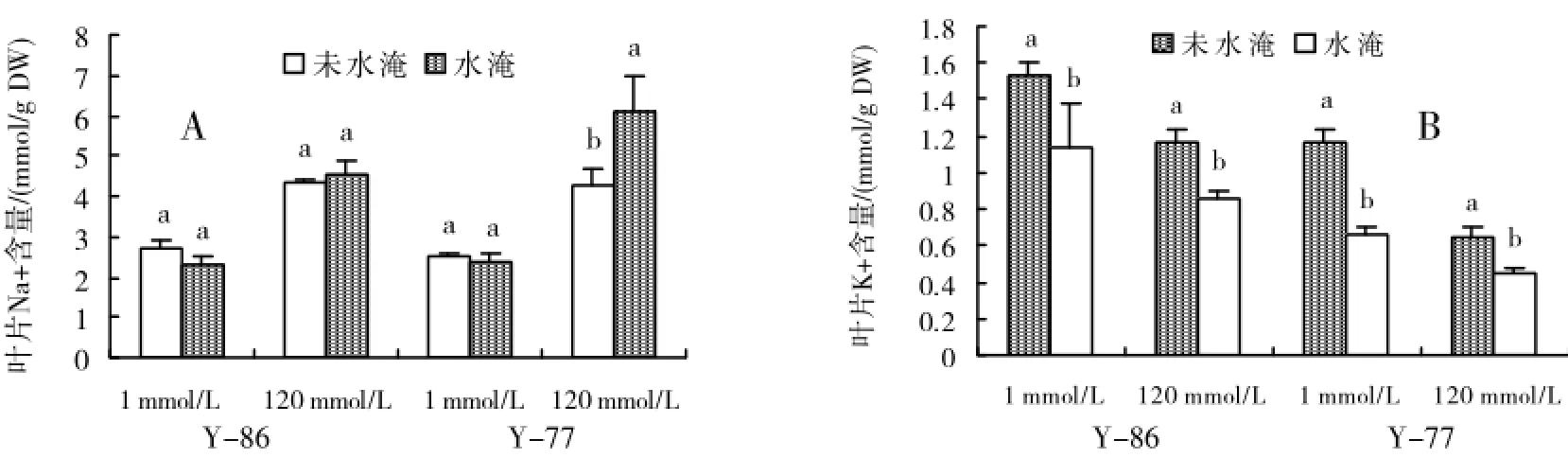
图3 盐涝互作对甜菜Y-86、Y-77叶片Na+(A)和K+(B)的影响
2.4叶绿素含量变化
无论水淹还是正常沙培,Y-86和Y-77的叶绿素a(图4A)、叶绿素b(图4B)和叶绿素a+b(图4C)含量随盐浓度增加而降低。与Y-86相比,120mmol/LNaCl显著降低了Y-77的叶绿素a、b和a+b的含量。1和120 mmol/L NaCl处理下,水淹对Y-86叶绿素a、b和a+b含量无显著影响,却显著降低Y-77的含量(图4)。

图4 盐涝互作对甜菜Y-86和Y-77叶绿素a(A)、叶绿素b(B)及叶绿素a+b(C)含量的影响
3 讨论
盐分和水涝都是影响植物生长的环境因子。水淹降低作物的产量或引起死亡,包括一些耐盐的作物[9]。刘镇等[10]研究不同供水量对疏叶骆驼刺种子出苗的影响时发现,水分虽然是种子萌发的主要限制因子,在达到一定的供水量后,种子的萌发率和出苗率并不会随供水量的增加而升高。相反,由于氧在水中溶解度较低,水分过多会使土壤缺氧,严重地影响植物的生长[11]。研究发现,由于水淹土壤中氧的通量比正常土壤的氧小32万倍,水淹后土壤的氧浓度降低,植物消耗的氧无法得到有效的补充,引起植物体内的缺氧[12]。甜菜Y-86和Y-77种子在水淹的5d时间内均没有出苗,而恢复正常浇水后Y-86和Y-77均可以出苗,说明水淹对甜菜种子出苗有延缓作用(图1)。对于Y-86,单纯盐处理对其出苗率无影响。前期水淹组出苗率低于未水淹组,尤其是120mmol/L处理时。但水淹对最终出苗率无显著影响,说明Y-86种子对盐涝互作有较强的适应性。对于Y-77,单纯120mmol/L盐处理降低其出苗率,表明Y-77抗盐能力较弱。120mmol/L盐处理时,水淹的出苗率也低于未水淹处理的,说明Y-77对盐及水淹的耐性不如Y-86。
Y-86和Y-77盐涝互作后,地上和根的干重均下降,Y-77地下部分干重较Y-86下降程度大。植物水淹后,土壤中O2含量下降,使O2在植物内运输的难度加剧,但在一些植物中,会通过细胞凹陷断裂形成的空腔运输到地上部分和根部,称之为通气组织,水淹诱导了通气组织的产生[13]。研究发现水淹情况下,相较于植物茎、叶中产生的通气组织,植物根中产生更多通气组织[14]。Y-86根干重受影响较小,是否是由于其根中产生较多的通气组织,保证代谢所需的O2含量需要进一步验证。
植物对水淹及盐渍的适应性表现在形态及生理两个方面,如通气组织的形成、不定根的产生及有关有机物及无机离子的吸收[11,15]。盐及水淹互作促进茎及叶片中Na+、Cl-的积累[15],可能首先促进Na+或Cl-向茎运输,进而抑制茎的生长[11,15]。Song等[16]研究发现,水淹处理时盐地生境盐地碱蓬(Suaeda salsa)有大量不定根产生而潮间带生境盐地碱蓬没有不定根发生;水淹处理提高潮间带生境盐地碱蓬叶片中Na+含量,对盐碱地生境盐地碱蓬无明显影响,但水淹对两种生境盐地碱蓬叶片K+/Na+均无显著影响。说明潮间带生境盐地碱蓬对水淹具有较好的耐性,而盐地生境盐地碱蓬具有很好的避涝性。盐涝互作后地上部分Na+含量增加是由于Na+净转运速率的升高,使植物生长缓慢,影响其生物量[17-18]。研究发现,盐涝互作后,甜菜叶片中Na+含量随盐度增加而升高,过多Na+的运输到代谢旺盛的地上部分,限制了K+的吸收。Y-88相较于Y-77叶片中Na+含量较低,说明Y-86的根对离子的积累可能具有更好的调控能力。K+能显著促进植物幼苗生长,增加幼苗叶片生长量,增加叶片干、鲜重[19]。水淹降低Y-86和Y-77叶片K+含量。与Y-86相比,Y-77降低的更明显(图3)。Y-77地上与根干重的显著下降可能与其K+含量明显下降有一定关系。

表1 甜菜地上和地下部分干重、叶片离子含量和叶绿素含量的三因素分析结果
叶绿素含量的多少在一定程度上反映了植物光合作用强度的高低,从而影响植物的生长[20]。罗振等[21]发现,棉花在苗期受到涝渍胁迫后,叶片的叶绿素含量降低。盐涝互作中,盐对甜菜叶绿素含量影响较大(表1)。甜菜Y-86水淹组与未水淹组的叶绿素a、b及a+b含量无显著性差异,说明水淹对Y-86幼苗光合色素没有造成明显的影响;Y-77水淹组与未水淹组的叶绿素a含量差异性显著,说明盐分和水淹对其造成双重胁迫。与Y-86相比,水淹使Y-77地上与根干重显著下降。说明水淹时Y-77地上与根干重显著下降与其叶绿素含量的明显降低有关。
综上表明,与Y-77相比,盐涝互作时Y-86具有较高的出苗率,而且在苗期较好地维持离子稳态以及叶绿素含量的相对稳定。因此,甜菜Y-86比Y-77对盐涝互作具有更强的适应性。
[1]周建朝.甜菜科学种植指南[M].北京:中国农业出版社,2009.
[2]陈业婷,李彩凤,赵丽影,等.甜菜耐盐性筛选及其幼苗对盐胁迫的响应[J].植物生理学通讯,2010,46(11):1121-1128.
[3]Marschner H.Mineral nutrition of higher plants(Second Edition)[M].Academic,London,1995.
[4]Ghoulam C,Foursy A,Fares K.Effects of salt stress on growth,inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars[J].Environmental and Experimental Botany,2002,47:39-50.
[5]Hanson AD,Wyse R.Biosynthesis,translocation,and accumulation of betaine in sugar beetand its progenitors in relation to salinity[J].Plant Physiology,1982,70:1191-1198.
[6]关元秀,刘高焕,刘庆生,等.黄河三角洲盐碱地遥感调查研究[J].遥感学报,2001,5(1):46-52.
[7]耿贵,周建朝,陈丽,等.氯化钠胁迫下甜菜不同品种(系)种子发芽率和幼苗生长的差异[J].中国糖料,2004(2):14-18.
[8]於丽华,耿贵,崔平,等.甜菜种质资源耐盐性的初步筛选[J].中国糖料,2013(4):39-41.
[9]Lu SG,Tang C,Rengel Z.Combined effects ofwaterlogging and salinity on electrochemistry,watersoluble cations and water dispersible clay in soilswith various salinity levels[J].Plantand Soil,2004,264:231-245.
[10]刘镇,曾凡江,刘波,等.不同供水量和种子处理对疏叶骆驼刺种子出苗的影响[J].草叶学报,2010,19(6):93-99.
[11]Barrett-Lennard EG.The interaction between waterlogging and salinity in higher plants:causes,consequences and implications[J]. Plant and Soil,2003,253:35-54.
[12]Armstrong W,Drew MC.Root growth and metabolism under oxygen deficiency[A].In:WaiselEA,KafkafiY,eds.Plant roots:the hidden half[C].New York,NY,USA:Marcel Dekker,2002:729-761.
[13]Voesenek LACJ,Pierik R,Millenaar FF,etal.How plants copewith complete submergence[J].New Phytologist,2006,170(2): 213-226.
[14]伍卡兰,彭逸生,郑康振,等.五种红树植物通气组织对人工非潮汐生境的响应[J].生态学报,2010,30(24):6927-6934.
[15]Carter JL,Colmer TD,Veneklaas EJ.Variable tolerance ofwetland tree species to combined salinity and waterlogging is related to regulation of ion uptake and production of organic solutes[J].New Phytologist,2006,169:123-134.
[16]Song J,ShiGW,Gao B,et al.Waterlogging and salinity effects on two Suaeda salsa populations[J].Physiologia Plantarum,2011, 141(4):343-351.
[17]Barrett-Lennard EG,van Ratingen P,Mathie MH.The developing pattern of damage in wheat(Triticum aestivum L.)due to the combined stresses of salinity and hypoxia:experiments under controlled conditions suggestamethodology for plant selection[J]. Australian Journal of Agricultural Research,1999,50:129-136.
[18]Kriedemann PE,Sands R.Salt resistance and adaptation to root-zone hypoxia in sunflower[J].Australian Journal of Plant Physiology,1984,11(4):287-301.
[19]陈昆,刘世琦,张自坤.水培条件下钾对大蒜幼苗生长及根系活力的影响[J].北方园艺,2011(1):20-23.
[20]陈健妙,郑青松,刘兆普,等.麻疯树幼苗生长和光合作用对盐胁迫的响应[J].生态学报,2009,29(3):1356-1365.
[21]罗振,董合忠,李维江,等.盐渍和涝渍对棉苗生长和叶片某些生理性状的复合效应[J].棉花学报,2008,20(3):203-206.
Interactive Effects between Salinity and W aterlogging on Sugarbeet Seed ling Emergence and Early Grow th
FU Ting-ting,ZHAOWei-wei,XU Yan-ge,WANG Feng-xia,LIU Ran-ran,SHIWei-wei,SONG Jie*
(Key Laboratory of Plant Stress,College of Life Science,Shandong Normal University,Jinan 250014)
Effects of salinity and waterlogging on seedling emergence,seedling biomass,leaf chlorophyll content and leaf ion contentwere studied with two sugarbeet cultivars Y-86-5-1(presents as Y-86 in the paper)and Y-77-6-3(presents as Y-77 in the paper).The results showed that120 mmol/L NaCl had no significant effect on seedling emergence of Y-86,but decreased emergence of Y-77.Waterlogging had no significant effect on seedling emergence of Y-86 regardless of provided NaCl concentration butmarkedly decreased the emergence of Y-77 at 120 mmol/L NaCl.Salinity reduced shoot and root dry weight and chlorophyll content in leaves of the two cultivars,especially in Y-77.Salinity significantly increased Na+content and reduced K+content in leaves of two cultivars,especially in Y-77.Waterlogging significantly decreased shoot and root dry weight of Y-86 and Y-77 at 1 and 120 mmol/L NaCl,especially for root dry weight in Y-77.Waterlogging had no significant effect on the content of leaf chlorophyll in Y-86,butmarkedly decreased that value in Y-77.Waterlogging had no significant effect on the leaf Na+content of Y-86 regardless of NaCl concentration.For Y-77Waterlogging had no significant effect on the leaf Na+content at 1 mmol/L NaCl butmarkedly increased that value at 120 mmol/L NaCl.Waterlogging reduced leaf K+content in both Y-86 and Y-77.In conclusion,Y-86 is better adapted to salinity and waterlogging interaction compared to Y-77.
sugarbeet;interaction between salinity and waterlogging;seedling emergence;chlorophyll content;ion content
S566.3
A
1007-2624(2015)04-0011-04
10.13570/j.cnki.scc.2015.04.004
2015-02-07
付婷婷(1987-),女,山东省临沂市兰陵县人,山东师范大学研究生院,在读硕士研究生,主要从事植物抗逆机理的研究工作。
宋杰,Email:songjieever@163.com
