节能型海带育苗新技术——黑暗流水储存配子体
2015-12-15梅俊学侯旭光李信华
梅俊学, 侯旭光, 李信华
(1.山东大学(威海)海洋学院, 山东 威海 264209; 2.寻山集团有限公司, 山东 威海 264316)
目前的海带夏苗的室内培育是一种集约式的生物培养方式。这种方式在海带夏苗生产上, 关键是低温条件。低温加上较弱的光照, 可以抑制杂藻的繁生,防止某些病害的发生, 并控制海带幼体的生长, 以待自然水温的下降。所以在育苗生产中给予幼苗的低温并不是其生长发育所需要的最适温。如果生产上能给予幼苗最适培养条件, 从采孢子到孢子体达到1~2 cm的出库标准, 大体只要45 d左右时间。但如果8月上旬采苗后, 在最适条件进行培养, 那么到9月下旬, 幼苗就能长到出库大小。但是, 这时正是自然水温的高温期。自然水温要下降到幼苗能出库所要求的19℃以下, 在北方海区最早也要到l0月中旬。幼苗既然不能出库下海暂养, 室内培育条件又满足不了幼苗生长的需要, 就可能发生烂苗。所以在现行的海带夏苗培育方法中, 不得不用低温控制幼苗的生长, 减少病害的发生[1-5]。
为解决以上几个问题, 20世纪80年代孙国玉等试验了“改进的海带夏苗培育法”。当幼苗发育到一定时期, 将苗帘放在-1~4℃的低温静水中, 保存20~70 d。取出后在流水的育苗室内培育。这种方法的优点是,在低温储藏时期无需换水, 因此节约了用于降温的电费、化肥以及人工。但是由于投资大、操作繁琐等缺点, 这项技术没有被生产企业采用[6-9]。
“海带配子体克隆育苗技术”可在一定程度上解决降温成本问题。此项技术包括大规模培养配子体、配子体切段、配子体附着、幼苗培育等步骤。这种育苗方法具有品种纯度高、育苗时间短、不受季节限制、成本低等优点。但是仍有一些技术难点, 如克隆大量配子体需要的纯净海水、快速配子体克隆分离、附苗方法、发育诱导等, 制约了该技术的广泛应用[10-12]。
本项目研究的方法通过完全闭光来抑制配子体生长发育, 能够有效解决上述问题。无需另建冷库,利用现有的育苗设施, 在海带育苗中的适当时间,将苗帘集中存放, 将育苗水温从 6.5~8.0℃提高到10.0~10.5℃, 从而达到节约能源、节约人工的目的。
1 材料与方法
本试验的材料是山东威海各海带育苗场普遍选用的杂交品系, 当地俗称“笨牛”。附着基为山东普遍使用的红棕绳帘和福建普遍使用的维尼纶帘。试验地点在寻山集团有限公司所属青渔滩海带育苗车间。本车间育苗能力1亿株, 共13排串联的育苗池,每排3个池, 每池150~160个育苗帘。在其他试验中,为了将试验池水温调节至高于其他池, 将室内靠东面的一排池的供水渠截开, 成为专用供水池。池内水流部分来自经过沉淀、过滤、制冷和添加营养盐后的海水, 水温6.5~8.0 ℃, 与其他普通育苗池所用海水相同, 另一部分海水是直接从海区抽取的自然海水, 水温 22~27℃, 使试验用供水池的水温调节至(10±1)℃。
由于海带的配子体微小, 雌配子体只有一个细胞, 直径11~22 µm, 雄配子只有6~8个细胞组成, 而且聚集在一起, 很难准确计数。所以用它们产生的幼孢子体, 即海带苗的数量代表配子体的成活率。每次试验结束时, 从育苗帘上随机剪取 1 cm苗绳 9段,计数大于 0.2 cm的健康苗, 数据用 SPSS进行ANOVA分析。
1.1 静水黑暗条件下维尼纶和红棕绳帘上储存配子体
2009年 8月 13日随常规生产采孢子, 密度为160倍显微镜视野中 15~20个游动孢子, 在 8℃、800~2 000 lx光照强度下培育配子体。至第12天时,取红棕绳和维尼纶帘各12张, 折叠后分别放入6个体积50 L的塑料桶中, 每桶4张帘子, 桶内注满6.5℃育苗用海水, 加盖, 然后将塑料桶置于(6±0.5) ℃储水池中。在这样的黑暗静水条件下储存14 d后, 在傍晚将帘子移回常规海带育苗池内。恢复光照后的前3天维持800~1 500 lx的弱光照, 随后的光照强度随育苗库内其他苗帘一起调节, 一般为 1500~4000 lx,育苗池内的流动海水温度在6.5~8℃。直至10月12日测量和记录孢子体苗平均长度和密度。同一育苗库内的其他苗帘作为对照组, 它们均没有经过黑暗处理, 始终在流水的育苗室内。在试验组黑暗处理期间, 对照组水温6.5~8.0℃, 光照强度800~2 000 lx。试验总共持续60 d。
1.2 流水黑暗条件下红棕绳帘上储存不同发育时期的配子体
试验组红棕绳帘150张, 分别在3个育苗池中,每池50张。2010年8月11日, 随常规生产采孢子, 密度为 160倍显微镜视野中 15~20个游动孢子, 在(10±0.5)℃、500~2 000 lx光照强度下培养。培育至第6天、第8天和第10天时, 分别将一个池内的50张帘子垛叠 3~4层, 然后用两层黑色塑料布将育苗池覆盖, 使附着在苗帘上的配子体处于黑暗、流水环境中, 水温(10±0.5)℃。14 d后, 在傍晚移除黑塑料布, 将堆放的苗帘分散放回原来的水池中, 使黑暗处理过的配子体次日开始接受光照, 光照强度在初始的3天内从500~750 lx提高到1500~2000 lx, 随后的光照强度随苗库内其他苗帘一起调节, 一般为1 500~4 000 lx, 育苗池内的流动海水温度在10~11℃。直至10月12日测量和记录孢子体苗平均长度和密度。对照组培育条件同1.1。
1.3 红棕绳帘上配子体在流水黑暗条件下储存不同时间
黑暗处理开始时间为采孢子后第 8天, 黑暗处理时间为12、14和16 d, 其他条件与1.2相同。
1.4 流水黑暗条件下储存配子体用于规模育苗生产
2013年 8月 13日做中试规模试验, 红棕绳帘2000张, 采孢子后第 8天时开始黑暗处理, 处理时间12 d, 其余操作同1.2。至10月12日试验结束。
2 结果
2.1 静水条件下维尼纶和红棕绳网帘黑暗储存配子体
黑暗储存结束时在显微镜下观察发现, 维尼纶帘配子体色素褪去, 但是细胞结构仍完整; 红棕绳帘上的部分配子体失去色素, 结构完整; 部分配子体解体死亡。恢复光照后第4天, 配子体的色素重新出现。恢复光照8 d时, 幼孢子体出现在苗帘上。试验结束后时, 两种育苗器上的海带苗(≥0.2 cm)平均密度分别为49株/cm和19株/cm, 而对照组为54株/cm,方差分析表明, 三者的差异显著(表1)。

表1 红棕绳和维尼纶育苗帘黑暗静水中存储配子体后出苗数以及方差分析Tab.1 Sporeling density (sporelings/cm rope) of gametophytes treated in dark on palm and synthetic panels and results of one-way ANOVA
2.2 流水黑暗条件下红棕绳帘上储存不同发育时期的配子体
黑暗处理开始时配子体分别为6 d、8 d和10 d,它们分别代表未成熟(即仍处于营养生长阶段)、部分成熟(部分处于营养生长阶段, 部分开始生殖阶段,偶尔见幼孢子体)和成熟(大部分配子体进入生殖阶段, 幼孢子体在每个显微镜视野中均可见到)的配子体。尽管在黑暗处理后配子体失去色素, 但是仅有少量配子体死亡。恢复光照第8天时, 在3个试验组的苗帘上都出现幼孢子体。试验结束后时, 3组处理的苗帘上幼苗(≥0.2 cm)的平均密度分别为 59株/cm,64株/cm 和 58株/cm, 而对照组为61株/cm。方差分析表明, 3个试验组和对照组的差异不显著(表2)。3组均达到国家GB/T 15807-1995三类苗帘标准。
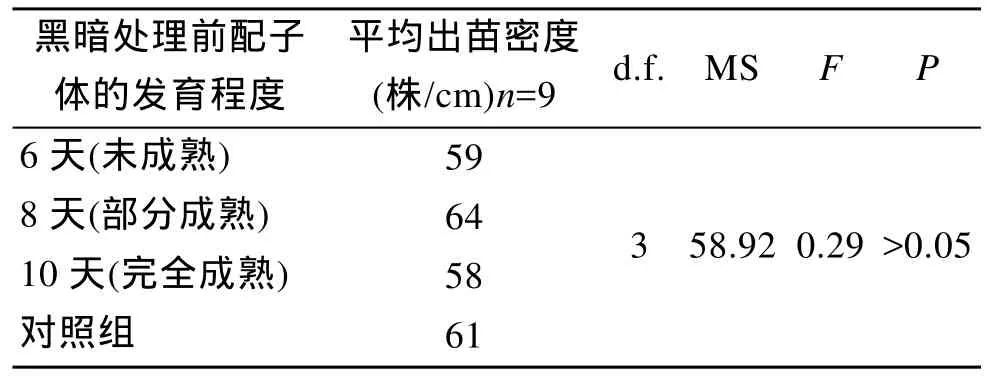
表2 不同发育时期的配子体在黑暗处理后出苗数以及方差分析Tab.2 Sporeling density (sporelings/cm rope) of gametophytes treated in dark for 14 days at different developmental stages and results of one-way ANOVA
2.3 红棕绳帘上配子体在流水黑暗条件下储存不同时间
试验结束后时, 3组处理的苗帘上幼苗(≥0.2 cm)的平均密度分别是66株/cm, 64株/cm, 47株/cm, 而对照组为61株/cm。方差分析表明, 3个试验组和对照组的差异显著(表3)。黑暗处理时间16 d的一组大于0.2 cm的苗少, 只有47株/cm, 但是小于0.2 cm的幼苗高达51株/cm。黑暗处理12 d和14 d的苗帘达到国家GB/T 15807-1995三类苗帘标准。
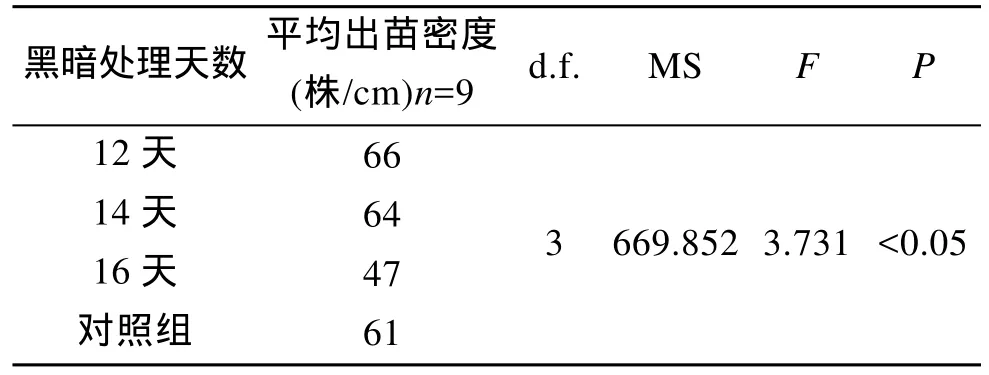
表3 黑暗处理配子体不同时间后出苗数以及方差分析Tab.3 Sporeling density (sporelings/cm rope) of gametophytes treated in dark for 12, 14 and 16 days at 8th day of development and results of one-way ANOVA
2.4 流水黑暗条件下储存配子体用于规模育苗生产
幼苗(≥0.2 cm)平均 82 株/cm, 幼苗(≥1.5 cm)平均18株/cm, 所有苗帘均达到国家GB/T 15807-1995二类苗帘标准。
3 讨论
从表1可以看出, 即使在静水中, 海带配子体也具有忍受黑暗的能力, 本项结果与海带属其他种的研究结果相似[13]。但是与维尼纶帘相比, 红棕绳帘上配子体的存活率较低, 可能是红棕绳中的渗出物对海带配子体产生了伤害。在试验2的流水条件下, 渗出物被水流带走, 因此配子体得以存活。
表2、表3和规范育苗生产结果表明, 在流水条件下, 12 d和 14 d的黑暗处理、育苗水温提高到(10±0.5)℃, 对配子体的存活、发育以及形成孢子体的能力并没有显著的不利影响。这样的配子体能够培育出合格的海带夏苗。黑暗处理16 d时, 因为在光照下培育时间过短, 导致孢子体没有足够时间发育至国家标准要求的长度。
根据上述研究结果, 可以将现行的海带育苗过程做如下改进: (1)按常规方法采孢子; (2)整个育苗过程的水温从目前的6.5~8℃提高到(10±0.5) ℃; (3)在采孢子8 d后, 将苗帘集中存放, 3~4层为一叠, 加盖黑色塑料布遮光; (4)黑暗处理12~14 d后, 在傍晚移除覆盖物。恢复光照后的头 3天缓慢提高光照, 从500~750 lx提高到1 500~2 000 lx; (5)其他管理措施同传统育苗方法。
改进后的技术有以下优点: (1)育苗水温从6.5~8℃提高到 10℃, 因此节约制冷费用; (2)黑暗储存配子体时, 苗帘3~4层垛叠摆放, 因此可以节约2/3到3/4的用水量; (3)储存期间无需人工管理, 因此节约人工; (4)没有复杂的操作和技术, 容易掌握; (5)不需要另加投资。该技术的创新点: (1)模仿海带在自然界的生活环境, 是本技术依据的理论基础。自然海水中海带放散孢子在春季和秋季, 水温为 10~20℃, 孢子的萌发和配子体的形成和发育也在这个温度范围内。但是由于配子体生长缓慢, 而且是在水平面上生长,容易被生长较快且直立生长的海藻如水云、浒苔等覆盖, 不能得到足够的光照而停止发育, 也可以说进入休眠状态。等到晚秋, 当覆盖的杂藻死亡并流失后, 海带配子体才有机会得到光照, 恢复生长和发育。在被覆盖期间, 配子体所处的条件是流水、黑暗。这是本技术的理论核心。(2)与孙国玉等的“改进的海带夏苗培育法”相比。此方法的理论基础是, 生活在极地海洋里的海带类的藻体, 由于低温(-1.6~4℃),它们的代谢作用进行的极端缓慢, 在漫长昏暗的极夜期间存活着, 待极昼到来时又继续旺盛地生长繁殖。因此, 这种方法建议, 将配子体移入0~-2℃的静止海水中置冷库存储 20~120d或 8℃储存 20~30d。在海带苗出库下海前约50d, 由冷库移入育苗库中按常规育苗法培育成合乎标准的幼苗。本方法的重点是低温、静水和无光。但存在的问题是: ①处理后的配子体仍移回育苗库按常规的育苗法培育, 即 6.5~8.5℃培育约40~50 d, 仍需要昂贵的降温费用。②对苗帘的洁净度要求较高。因为在静水中储存, 积累有害物质是不可避免的, 因此在采集孢子前, 需要对红棕绳苗帘进行额外的处理。③需要将苗帘在育苗库和冷库间搬运, 增加了人工。④低温、静水不符合海带在自然条件下的生活状态。在海上, 海带自然放散孢子并形成的配子体的季节是春季和秋季, 自然水温是15℃左右, 而且是流水条件。因此低温静水条件下配子体存活率较低。⑤另外建冷库, 额外投资较大, 而且冷库利用率低, 每年只有两个月时间有用[6-9]。(3)与海带配子体克隆育苗技术相比。此方法的理论基础是, 分离后单独培养的雌、雄配子体都能形成无性繁殖系(克隆), 即丝状体。将大量单独培养的雌雄丝状体切碎后混合培养, 仍然会分别产生雌雄配子, 并受精后形成孢子体, 也就是海带幼苗。这项技术存在的问题是: ①培养条件导致配子体畸形发育。在正常条件下雌配子体是单细胞, 而雄配子体是由少数细胞组成的简单丝状体。在人工的雌雄配子体分离培养条件下, 都长成复杂的分枝体和簇状体, 甚至发生孤雌生殖或孤雄生殖, 并可能染色体加倍。这样很难得到大量正常健康的配子体和孢子体幼苗。②畸形的配子体导致附苗不牢固, 不均匀。③目前的配子体克隆分离、发育诱导技术都还不成熟, 需要进一步完善[10-12]。
[1]曾呈奎, 孙国玉, 吴超元.海带的幼苗低温渡夏养殖试验报告[J].植物学报, 1955, 4(3): 255-264.
[2]曾呈奎, 吴超元, 孙国玉.温度对海带孢子体的生长和发育的影响[J].植物学报, 1957, 6(2): 103-130.
[3]曾呈奎, 吴超元, 任国忠.温度对海带配子体生长发育的影响[J].海洋与湖沼, 1962, 4(1-2): 22-28.
[4]Lüning K, Pang S J.Mass cultivation of seaweeds:current aspects and approaches[J].Journal of Applied Phycology, 2003, 15: 115-119.
[5]单体锋, 刘峰, 刘启顺, 等.海带幼苗低温渡夏技术的回顾与展望 [J].中国农业科技导报, 2011,13( 2) : 129-134.
[6]孙国玉.改进夏苗培育法的建议[J].福建水产科技,1981, 1: 35-36.
[7]孙国玉, 杨振芝, 沈世泽.改进的夏苗培育法研究——再论海带育苗系统中脱苗和烂苗原因分析及其预防措施[J].海洋科学, 1984, 3: 38-42.
[8]孙国玉, 沈世泽, 杨振芝, 等.改进的夏苗培育法研究——三论海带育苗系统中脱苗和烂苗原因分析及其预防措施[J].海洋科学, 1986, 10(5): 24-27.
[9]缪国荣, 陈家鑫, 刘启顺.一碘苯氧乙酸在海带夏苗培育中的应用[J].水产学报, 1983, 7: 25-30.
[10]李志凌, 张全胜, 杨迎霞, 等.海带配子体克隆大规模培养术的研究[J].齐鲁渔业, 2003, 5: 1-3.
[11]李大鹏, 吴超元, 刘晚昌, 等.海带单倍体无性繁殖系育苗技术的研究[J].海洋学报, 2003, 25(5):141-145.
[12]张全胜, 唐学玺, 张培玉, 等.海带配子体克隆育苗生产中采苗技术的研究[J].高技术通讯, 2005, 15(1):89-92.
[13]Lüning K.Critical levels of light and temperature regulating the gametogenesis of three Saccharina species (phaeophyceae) [J].Journal of Phycology, 1980, 16:1-15.
