橡胶试验方法(五十六)
——摘自日本《ゴム試驗法》
2015-12-15王作龄张卓娅编译
王作龄,张卓娅 编译
橡胶试验方法(五十六)
——摘自日本《ゴム試驗法》
王作龄,张卓娅 编译
6.2.4 医用橡胶制品安全性评价
6.2.4.1 医用橡胶制品安全性评价目的
关于医疗用具制造(进口)通过申请时应附上的生物学安全性资料,历来根据(医疗用具制造(进口)通过申请所需要的生物学试验准则)(1995年6 月27日药机第99号)进行受理。
随着该准则的废除,《医疗用具的生物学安全性评价的基本想法》(医药审发第0213001号,2003 年2月)作为医疗器械市售前安全性评价的一环,表示了关于生物学有害作用(毒性,危害性)的风险评价和生物学安全性评价试验方法的基本想法。与此同时,作为《关于用于评价医疗器械生物学安全性的试验方法》体现了试验方法的具体内容。
6.2.4.2 医疗器械的生物学安全性评价
医疗器械的生物学安全性评价,原则上根据国际标准ISO 10993(医疗器械的生物学评价9系列进行。根据各个医疗器械的接触部位和接触时间选择所需要的评价项目,然后再对各评价项目参考ISO 10993-2以后的各试验方法辅导等选择适宜的试验法,对安全性进行评价。
另外,对于系列中的各试验法辅导,多数情况列出了每个评价项目的多个试验法。进行试验时必须选择适宜的试验法。而且由于国际标准随着科学技术的发展逐步在进行修订,因此在试验时必须考虑最新的国际标准,选择适宜的试验方法。
原材料和医疗器械的生物学安全性评价,必须按照ISO 14971(适用于医疗器械—风险管理的医疗器械)所表示的风险分析方法进行。即对于医疗器械的安全性必须特定已知的或者可预见的危害性,推断各种危害性的风险。医疗器械的安全性可由后续进行的风险评价进行评价。
生物学的安全性评价以下述的信息资料或正文为标准,根据实施的安全性试验结果、医疗器械特有的安全性评价项目的试验结果、最新科技文献、其他非临床试验、包括市售后调查的临床经驻等,需要综合性的反复考虑风险和受益。
①关于原材料的信息资料;
②关于原材料、制造过程产生的混合物及其残余量的信息资料;
③关于抽提物的信息资料(如从最终制品抽提化学物质的定性、定量分析);
④关于分解产物的信息资料;
⑤关于其他成分及那些成分最终制品互相作用的信息资料;
⑥最终制品的性质、特征。
届时在符合以下项目时必须重新评价生物学的安全性。例如,根据毒性学的观点,抽提物的量在可以忽略不计的情况下,其毒为已知在可以接受的情况下等,以及在生物学的安全性中为等同的情况下,一定要重新进行试验等。
①供给部门或标准变更时;
②原材料的种类或配合量、生产工艺、成品的杀菌方法或一次包装形态变化时;
②储存中成品有变化时;
④成品使用目的有变化时;
⑤得到了可能引起有害情况的知识时。
6.2.4.3 评价项目的选择
关于对每个医疗器械的生物学安全性应评价项目的选择,根据以下所示的医疗器械的接触部位和接触时间的分类,原则上需要对表6-2-10所示的项目进行评价。另外,医疗器械适合多个时间分类时,对适用于更长时间分类的项目进行评价。再者,横跨多个接触部位的分类时,对适用于各个分类的项目进行评价(表6-2-10)。
(1)医疗器械按接触部位的分类
①非接触器械:不论直接或是间接都不接触患者身体的医疗器械
②身体表面接触器械
·皮肤:只与健康皮肤接触的医疗器械
·粘膜:与健全的口腔、食道、尿道等的粘膜器管接触的医疗器械
·损伤表面,与受伤的皮肤或粘膜器官接触的医疗器械
③连接体内和体外的器械
·间接的血液流道:在向血管注入药液等的医疗器械中由一点接触血管的器械
·组织/骨/齿质:与组织、骨和齿髓/齿质接触的医疗器械
·循环血液:与循环血液接触的医疗器械
④植入体内器械
·组织/骨:与组织和(或)骨接触的医疗器械
·血液:主要与血液接触的医疗器械
(2)按接触时间的分类
①暂时性的接触 接触时间为小时以内的医疗器械
②短、中期的接触 一次、多次或长时间使用,其接触时间从小时到一日内的医疗器械
①长期的接触 一次、多次或长时间使用,其接触时间超过一日的医疗器械
作为对表6-2-10所示项目的评价来说也可能代替已承认医疗器械的等同性评价或适宜的公布文献的评价等,虽然不一定要求实施表6-2-10所示的所有试验项目,但对代替的情况需要明确其准确性。
根据医疗器械的接触时间、接触部位、原材料的特性等,在参考表6-2-11的同时有必要对有关慢性毒性、致癌性、生殖与发生毒性和生物分解性的试验进行考虑。

表6-2-10 医疗器械的生物学安全性评价:第一次评价用指标
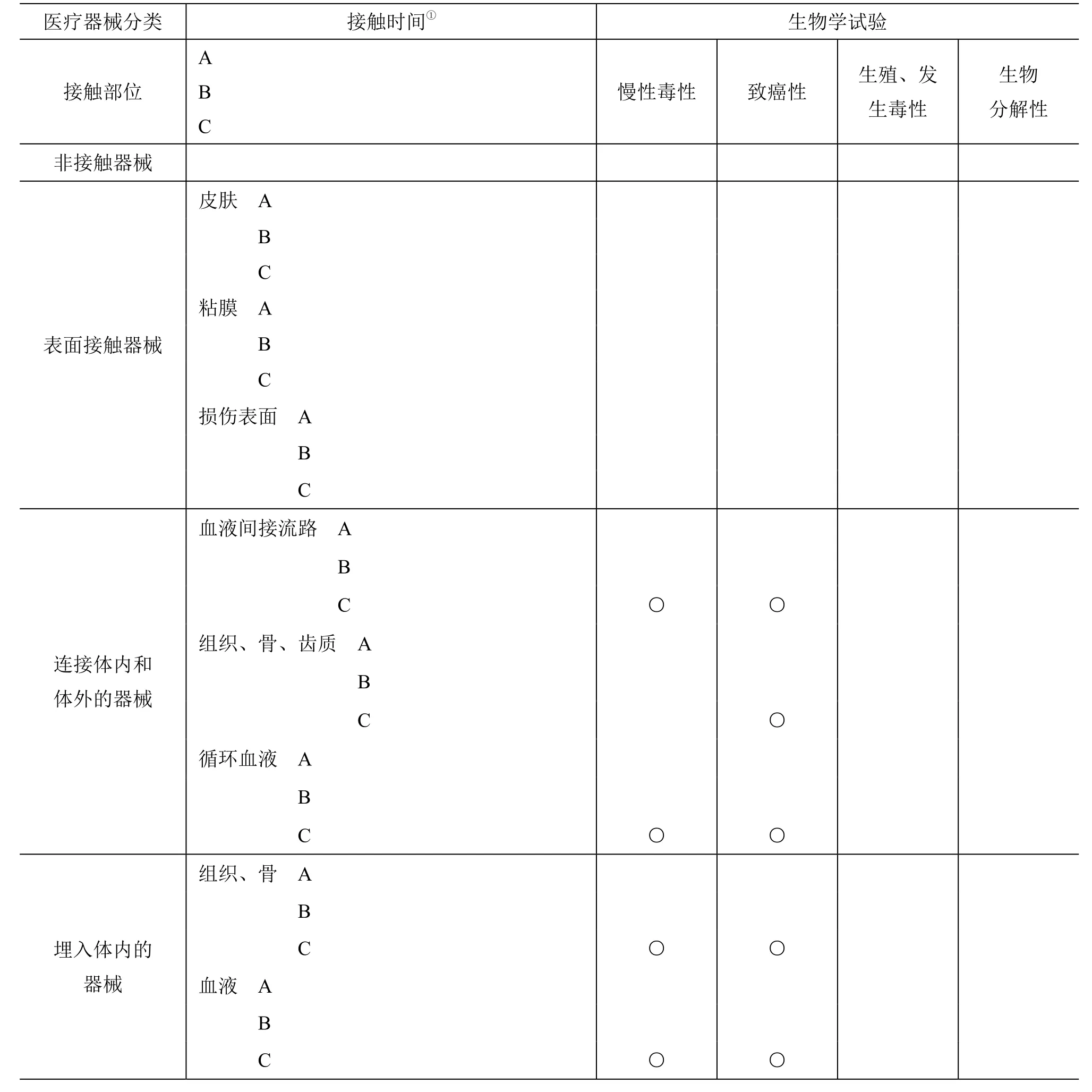
表6-2-11 医疗器械的生物学安全性评价:补充性评价用的指标
关于急性全身毒性、亚急性毒性或慢性毒性试验,如果埋植试验或使用模拟试验包括了这些毒性试验中所需要的观察项目和生物化学数据,则可以代替这些毒性试验。
仅用表6-2-10和表6-2-11所示的项目,有时也存在生物学的安全性评价不充分或者简单不适用的情况。因此,应充分考虑医疗器械的特性,研究评价项目。例如,像在使用复合树脂时的齿髓刺激试验或隐形眼镜时的镜片装用试验等,此处给出的试验就不够充分,或者根据毒性试验结果等怀疑免疫毒性时关于免疫毒性需要评价,或者像细胞组织医疗器械类,此处给出的试验简单,存在适用困难的情况。
6.2.4.4 试验方法
作为《关于医疗器械生物学安全性评价的试验方法》,对以下评价项目试验方法的具体操作步骤等进行简介。
细胞毒性试验
过敏性试验
遗传毒性试验
埋植试验
刺激性试验
全身毒性试验
发烧性试验
血液适合性试验
在ISO 10993系列中的各试验法指导内,关于评价项目存在多个试验法的情况,对于应如何从中选择,在与作为目的的医疗器械生物学安全性评价的意义关系中,应对试验的原理、灵敏度、选择性、定量性、再现性、试样的适用方法及其限制等进行考虑决定。例如,对于细胞毒性试验,过敏性试验和遗传毒性试验注意以下问题。
关于细胞毒性试验,在ISO 10993-5细胞毒性试验(体内试验法)中规定了抽出液的试验法(菌落法和微流量法)、间接接触法(琼脂多层法、过滤器扩散法)、直接接触法(直接接触的微流量法)。这些试验方法由于灵敏度和定量性不同,所以对于评价危害的危害性检测必须采用高灵敏度且具有定量分析的方法,如抽出液的试验法。
关于过敏反应试验和遗传毒性试验,特别取决于抽提溶剂,当试样溶液中的抽提物浓度低时,由于用于试验的抽提物的液量有限制,结果有可能显示假阴性。在关于ISO 10993-12抽提溶剂的规定中,为了测定风险评价用的危害性,考虑苛刻的抽提法也视为必要。为了评价医疗器械中所含的未知物质的毒性,必须选择抽提率高的溶剂。
作为实施医疗器械生物学安全性试验时的试样,可使用最终制品、最终制品的一部分原材料。关于用哪种试样进行试验,必须研究如何才能评价最终制品的安全性,显示其选择的科学性。
医疗器械多是由多种材料组合制造的,在其制造过程(也包括杀菌操作)中,有时材料进行化学变化。对于制造过程中材料进行化学变化的情况,必须使用从最终制品上切下的试样或者用同样条件制品的模拟试样进行试验。另对于制造过程中材料不进行化学性变化的情况,将原材料作为试样进行试验无妨碍。将原材料的部分化学物质变成新化学物质,而且这种新化学物质在材料中不进行化学变化时,不是将原材料或最终制品作为试样进行试验,而是对该化学物质进行试验,在试验实施上和评价上都合理的情况,可由该化学物质的试验代替原材料或最终制品的试验。
试验中使用动物时对动物的处理,根据有关动物保护法和动物福利的要求事项等致力于动物的福利工作。
6.2.5 家用橡胶制品的安全性评价
6.2.5.1 法律法规
1970年代,趁着多氯联苯被视为社会问题的机会,1974年实施了《关于化学物质审畜及制造等规则的法律》(化审法),1989年和2003年进行了修订。对于最新的化审法,注意到对人的健康影响也注意到对动植物的影响,而年产量在1吨以上,而且污染环境的可能性高,以及难分解高积累的化学物质,作为第1种、第2种特定化学物质和作为第1种、第2种,每3种监视化学物质进行注册的被视为生产和进口的监管对象。
另一方面,以由家用品引起的皮肤障碍成为社会性问题为契机,于1974午10月实施了《关于含有害物质家用品规定的法律》(家用品法)。在家用品法中,对于主要用于家用品的纤维加工剂,以皮肤过敏性、皮肤刺激性、细胞毒性等直接影响人的皮肤为主实行安全性评价,实施了有关用于家用品的规定。此外,对于家用品法,为了不产生新的皮肤过敏性患者,对于未满24个月的婴儿和幼儿用品,认为以不由化学物质加工的为原则。还有,家用品法的“化学物质”主要指一般消费者生活中使用的制品(家用品)含有可能损害人健康的物质,根据药事法、食品卫生法、毒物和剧毒物取缔法等已经接受监管的除外。
再者,根据产品责任法(PL法,1999年7月实行),由制品缺陷给消费者造成人力物力损失,生产厂家负有赔偿责任。而且报据也包括第三者认证的国际标准ISO 9001(1SO 9002)在内,进行包括安全性的质量管理的生产厂家,在日本也增加了。
此外,根据《关于特定物质向环境排放量的掌握及加强管理改善的法律(化学物质排放移动量申报制度、化学物质管理增进法)》(PRTR法,2001年1月实施),掌握、累计、公布何种化学物质从工厂等的发生源向环境(水系、大气)排放的量或以废弃物形式运出的量。
6.2.5.2 企业自主标准(指标)
关于家用品、一边与家用品法的规定并行,一边在湿抹布类、家用去霉剂、家用防霉剂。家用杀虫剂、家用洗洁剂,家用去污剂,一般消费者用香味除臭剂、隐形眼镜洗洁剂且保护保存剂等的企业中,按自主标准实施安全对策。
作为确保家用品安全性的基本想法,确立《家用品综合风险管理的想法》(1997年)。另外,作为《确保安全手工制作的手册》,即以每个家用品为对象,收集了研究发生损害的状况和损害健康的原因,可能发生新的损害健康的可能性等,用于制作自主标准时的手册得到发行。该手册是实施与制品使用实况相符的适宜的安全性评价,致力于加强对新自主标准的完备而列入了计划的产品手册。作为具体的例子,完成了关于防水喷雾器(1998年)、香味除臭剂(2000年),
家用除霉防霉剂(2002年)、杀虫剂(8005年)手册。
关于抗菌制品,按照《有关生活新功能加工制品恳谈会报告书(抗菌加工制品)》(抗菌制品规则,1998年12月),纤维评价技术协议会(SEK,1983年以纤维制品卫生加工协议会开始,1997年改称为纤维制品新功能评价协议会。2002年由于组织合并变成现在的称呼)制定了纤维制品的自主标准;抗菌制品技术协议会(SIAA,1998年以银等无机抗菌剂研究会为基础发展)制定了塑料制品的自主标准。即,对于抗菌剂的种类,可在大分类(无机类、有机类、天然有机类)、中分类(无机类/银类、有机类/季铵类、天然有机类/桧叶油类等)及细分类(具体的化学名称)三阶段中求得抗菌制品表示的种类。关于安全性评价,在评价对象中新追加了皮肤过敏性和细胞毒性。此外,通过消费者代表参加的委员会和SEK、SIAA的网页等加强企业与消费者关于抗菌制品抗菌效果、安全性、使用方法和操作注意事项等信息的交流。
6.2.5.3 化学物质等安全数据表(MSDS)和制品标记
MSDS是按照1992年在里约热内卢召开的地球高峰会议的议事日程21,当初作为国际承认的通过卫生福利省、通商产业省和劳动省的公告被日本采用的。
作为最近的工作,对于MSDS,在(修订劳动安全卫生法)(2000年4月实行)、《关于掌握和加强管理特定化学物质向环境的排放量的法律(化学物质管理加强法)》(PRTR法:2001年1月实行)、《毒物、剧毒物取缔法》(2001年实行)的三件法律中,日本最初设立了法律上的规定。与此同时,按照ISO 11014(1994年)的形式制定了JIS Z 7250(9000年),作为化学物质有害性等的信息源和信息传递手段正在增加MSDS的重要性。
但在日本,MSDS在生产厂家间为流通的信息,即使法律规定也没有义务向一般消费者宣布。对于消费者询问有关MSDS,也只有部分生产厂家自主同意公布,现状是几乎没有提供信息的。
为了使消费者确切了解产品可能危害健康及对危害健康防患于未然,要求生产厂家具体记载以下内容:①对自己公司的产品和同种产品,通过文献检索等调查过去危害健康的事例;②对自己公司的产品,自己试验得到或间接获取的针对用途的必要的毒性试验数据;③以毒性数据等为基础具体记载有害性信息等,充实MSDS的内容;④以MSDS为基础,具有记载使用注意事项、警告标记、应急处理、成分标记等易懂的产品标志内容。但是,现在经常看到的MSDS,不公布成分名称的、几乎不记载用于评价有害性信息等安全性所需信息的以及记载内容不完备的也相当多。
另一方面,家用品的标志内容也包括成分标志,由通商产业省根据《家用品质量标志法》进行规定。对于家用品,多数情况不具体记载加工方法或加工剂等的名称。例如,在抗菌制品中,标志抗菌剂名称的制品约为两成。标志抗菌剂名称或抗菌加工方法名称,能够推断抗菌剂的制品约为4成。但是,抗菌制品准则公布后,进入2000年按抗菌剂种类标志大分类,中分类名称表示的化妆品、袜子等也正在上市,今后期待着增加更加具体地记载标志内容的制品。(未完待续)
1)化学物質安全性規制ガイド企划委員会編:国内外におけゐ化学物質安全性規制ガイド改訂3版,日本能率協会マネジメソトセソタ一(1998)。
2)風間良英事務所:改訂3版 海外化学品規制法規集,化学工業日報社(2005)。
3)http∶//www.jetoc.or.jp/existinfo.html(化学物质安全情报セソタ一)。
4)鹿庭正昭:皮膚,35(增16),21(1993)。
5)鹿庭正昭,小嵨茂雄,中村晃忠,関東裕美,伊藤正俊,石原勝:衛生化学,30,126(1984)。
6)鹿庭正昭,小嵨茂雄,中村晃忠,関東裕美,伊藤正俊,石原勝:衛生化学,32,197(1986)。
7)Kaniwa,M.:J.Chromatogr.,405,263(1987)。
8)鹿庭正昭,五十嵐良明,小嵨茂雄,中村晃忠,臼田俊和,柴田啟子:衛生化学,34,325(1988)。
9)鹿庭正昭,小嵨茂雄,中村晃忠,関東裕美,伊藤正俊,石原勝:衛生化学,32,140(1987)。
10)厚生省藥務局医療機器開發課監修:医療用具及び医用材料の基礎的ぱ生物学的试验のガイドライン1995年解说。藥业日報社,東京(1996)。
11)中村晃忠:医療用具の生物学的評価(厚生省ガイドラインおよびISO 10993シリ一ズ),[バイオマテリアルと生体—副作用と安全性—],中山书店(1998)p.404.
10.3969/j.cn.12-1350(tq).2014.05.006
