子宫内膜样腺癌中低氧诱导因子-1α、-2α和Survivin的表达
2015-12-15艾小庆李永川刘玉嵚青措吉青海红十字医院妇三科青海西宁810000
艾小庆 李永川 刘玉嵚 青措吉 (青海红十字医院妇三科,青海 西宁 810000)
子宫内膜样腺癌中低氧诱导因子-1α、-2α和Survivin的表达
艾小庆李永川刘玉嵚青措吉(青海红十字医院妇三科,青海西宁810000)
〔摘要〕目的检测子宫内膜样腺癌术后组织中低氧诱导因子(HIF)-1α、2α和生存素(Survivin)的表达特征。方法64例子宫内膜样腺癌患者的临床资料和术后蜡块组织作为观察组,56例子宫脱垂行子宫全切术后的子宫内膜组织作为对照组。应用免疫组化SP法检测两组中HIF-1α、-2α和Survivin的表达。结果两组中HIF-1α、-2α和Survivin表达的阳性率差别显著。观察组中HIF-1α、-2α和Survivin的阳性率均与肿瘤最大径及肌层浸润深度密切相关,HIF-1α、-2α的表达与肿瘤的分化程度密切相关。线性相关分析显示观察组中HIF-1α和Survivin、HIF-2α和Survivin的表达具有正相关性。结论子宫内膜样腺癌术后组织中HIF-1α、-2α和Survivin高表达,三者对促进肿瘤的形成和进展均有重要作用。HIF-1α、-2α均与Survivin有协同正向作用。
〔关键词〕子宫内膜样腺癌;低氧诱导因子(HIF)-1α; HIF-2α; Survivin;免疫组化
低氧诱导因子(HIF)-1α和-2α是细胞为了适应低氧条件而产生的核转录因子,它在多种人类肿瘤中的表达升高〔1,2〕。HIF-1α和-2α的大量表达可以增加肿瘤细胞的侵袭性和降低肿瘤细胞对放、化疗药物的敏感性〔3〕。生存素(Survivin)与肿瘤的凋亡和形成有关,也是肿瘤进展中重要的调节蛋白〔4〕。本实验探讨子宫内膜样腺癌术后组织中HIF-1α、-2α和Survivin的表达特征,分析三者在不同临床病理特征中的差别及相关性。
1 资料与方法
1. 1一般资料2013年1月至2014年12月行子宫内膜样腺癌手术根治患者的临床资料及术后蜡块组织作为观察组,共64例,纳入均经病理医师按WHO中子宫内膜样腺癌的标准进行判定。年龄43~86岁,平均(62. 6±7. 6)岁。56例子宫脱垂行子宫全切术后的子宫内膜组织作为对照组,年龄45~87岁,平均(60. 9±7. 9)岁。两组一般资料差别无显著性。
1. 2 HIF-1α、-2α和Survivin的检测方法HIF-1α、-2α和Survivin抗体均应用0. 1 ml的浓缩液。先行预实验,选择最理想的配比浓度用在正式实验。两组正式实验中HIF-1α、-2α和Survivin的检测均应用免疫组化SP法,严格按说明书进行操作,减少误差,做好免疫组化的质控。
1. 3 HIF-1α、-2α和Survivin结果的判读标准HIF-1α、-2α和Survivin的阳性部位均定位在细胞质,以染成棕黄色为阳性细胞。选择上皮细胞集中的区域进行计数,选择10个高倍视野(400倍),计数阳性细胞的百分率,取平均值,以<10%定为阴性,以≥10%定为阳性。
1. 4统计学方法采用SAS6. 12软件进行χ2检验或线性相关分析。
2 结果
2. 1两组中HIF-1α、-2α和Survivin阳性率的比较两组中HIF-1α、-2α和Survivin阳性率差别显著(P<0. 000 1)。见表1。
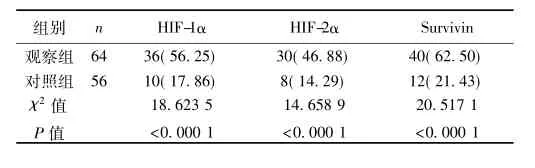
表1 两组中HIF-1α、-2α和Survivin阳性率比较〔n(%)〕
2. 2观察组中HIF-1α、-2α和Survivin在不同临床特征中的比较观察组中HIF-1α、-2α和Survivin的阳性率均与肿瘤最大径及肌层浸润深度密切相关,HIF-1α、-2α的表达与肿瘤的分化程度密切相关。见表2。
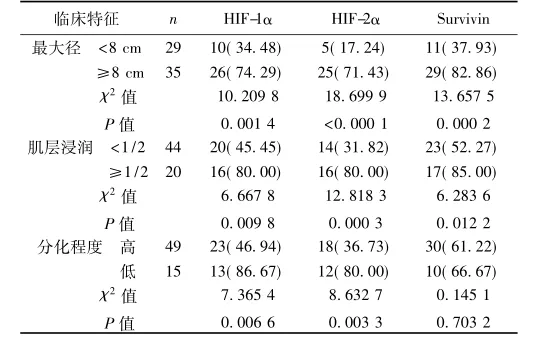
表2 观察组中HIF-1α、-2α和Survivin阳性表达在不同临床特征中的比较〔n(%)〕
2. 3观察组中HIF-1α、-2α和Survivin的相关性观察组中HIF-1α和Survivin(r = 0. 48,P = 0. 029 1)、HIF-2α和Survivin(r=0. 46,P=0. 018 0)的表达具有正相关性。
3 讨论
子宫内膜样腺癌是由子宫内膜发生的原发性上皮性恶性肿瘤,伴有腺体分化、具有浸润子宫肌壁及远处扩散的潜能。病变时肿瘤呈一系列组织分化,经典学说认为其由非典型复杂性增生转变而来,现在认为除了复杂性增生,单纯性增生伴有非典型增生的腺体也可能引起肿瘤的形成。腺体由单层或假复层柱状细胞被覆,并以其长轴垂直排列于基底膜上,肿瘤细胞核轻度增大并具有一定的极向。当腺体分化减少并被实性巢或成片的细胞取代时,肿瘤表达为低分化,也有学者〔5〕认为此时肿瘤为高级别的状态,侵袭性和恶性程度均明显升高。病变形成过程中,肿瘤表现为蛋白表达的失调,其中与缺氧相关的蛋白表达异常较为明显。HIF-1α、-2α是HIFs家族的重要成员,广泛存在〔6,7〕。目前认为HIF-1α、-2α是肿瘤生长的正向调节因子,其可能调节机制包括:①转录水平的上调和蛋白稳定;②蛋白的磷酸化水平〔8,9〕;③氧依赖的HIF-α降解;④配体的结合能力和在细胞内的定位。缺氧的条件对正常细胞的生长是不利的,然而对于肿瘤细胞,缺氧的条件则会对肿瘤细胞产生不同的影响。首先,缺氧的条件可以导致肿瘤细胞生长受到抑制,继而出现局部坏死等表现〔10,11〕。其次,肿瘤内部的一些缺血缺氧部位的细胞生长受到抑制〔12〕。HIF-1α、-2α高表达时可以引起血管内皮生长因子分泌增多,并可以引起肿瘤间质的血管生成增多,进而使肿瘤组织供氧增多,有利于肿瘤的生长〔13〕。Survivin基因定位于17q25,编码含有142个氨基酸,分子量16. 5 kD。其发挥作用是通过效应细胞蛋白酶受体1来调节凋亡进程的〔14〕。近年来显示Survivin的作用可能更多,如对肿瘤细胞增殖的调控作用,对血管生成的诱导作用等〔15,16〕。
本实验结果提示HIF-1α、-2α和Survivin高表达是促进肿瘤形成和进展重要因素。HIF-1α、-2α和Survivin高表达可以促进肿瘤的生长,使肿瘤的生长加速,肿瘤的体积增大。HIF-1α、-2α和Survivin高表达时可以促进肿瘤侵袭生长,使肿瘤的浸润能力增强。HIF-1α、-2α高表达时可以使肿瘤的分化低,肿瘤的异型性明显,细胞更幼稚。HIF-1α、-2α均可能与Survivin具有协同正向作用。HIF-1α/Survivin、HIF-2α/Survivin的协同作用可能和桥接通路有关〔17〕,如HIF-1α、-2α和Survivin均可以对血管内皮生长因子有明显作用,因此VEGF可能是其协同作用的中介蛋白〔18,19〕,但是具体机制有待更多实验研究证实。
综上,子宫内膜样腺癌术后组织中HIF-1α、-2α和Survivin高表达,三者对促进肿瘤的形成和进展均有重要作用。HIF-1α、-2α均与Survivin有协同正向作用。
4参考文献
1谢虎,李永忠,郭风劲,等.骨肉瘤中低氧诱导因子2α(HIF-2α)、骨桥蛋白(OPN)、血管内皮生长因子(VEGF)的表达及其临床意义〔J〕.中国实验诊断学,2011; 15(1): 117-9.
2王健,易继林,王炜煜,等. HIF-1α和HIF-2α在肝癌细胞中的时相差异表达〔J〕.中国癌症杂志,2006; 16(2): 124-6.
3 Boddy JL,Fox SB,Han C,et al.The androgen receptor is significantly associated with vascular endothelial growth factor and hypoxia sensing via hypoxia-inducible factors HIF-1α,HIF-2α and the prolyl hydroxylases in human prostate cancer〔J〕.Clin Cancer Res,2005; 11(21): 7658-63.
4 Tong E,Xu Y,Li G,et al.The effects of β-elemene on the expression of mTOR,HIF-1A,survivin in lung adenocarcinoma A549 cell〔J〕.Afr J Tradit Complement Altern Med,2013; 10(4): 18-23.
5 Koukourakis MI,Giatromanolaki A,Skarlatos J,et al.Hypoxia inducible factor(HIF-1α and HIF-2α)expression in early esophageal cancer and response to photodynamic therapy and radiotherapy〔J〕.Cancer Res,2001; 61(5): 1830-2.
6闫哲,白立立,赵伟静,等. HIF-1α E-cadherin在乳腺中的表达及意义〔J〕.河北医学,2015; 21(6): 914-6.
7 Wang YF,Ma SR,Wang WM,et al.Inhibition of survivin reduces HIF-1α,TGF-β1 and TFE3 in salivary adenoid cystic carcinoma〔J〕.PLoS One,2014; 9(12): e114051.
8 Tong WW,Tong GH,Chen XX,et al.HIF2α is associated with poor prognosis and affects the expression levels of survivin and cyclin D1 in gastric carcinoma〔J〕.Int J Oncol,2015; 46(1): 233-42.
9 Li DW,Zhou L,Jin B,et al.Expression and significance of hypoxia-inducible factor-1α and survivin in laryngeal carcinomatissue and cells〔J〕.Otolaryngol Head Neck Surg,2013; 148(1): 75-81.
10 Zhang B,Yin CP,Zhao Q,et al.Upregulation of HIF-1α by hypoxia protect neuroblastoma cells from apoptosis by promotingsurvivin expression 〔J〕.Asian Pac J Cancer Prev,2014; 15(19): 8251-7.
11 Zou K,Tong E,Xu Y,et al.Down regulation of mammalian target of rapamycin decreases HIF-1α and survivin expression in anoxic lung adenocarcinoma A549 cell to elemene and/or irradiation〔J〕.Tumour Biol,2014; 35(10): 9735-41.
12 Fan LF,Dong WG,Jiang CQ,et al.Role of Hypoxia-inducible factor-1 alpha and Survivin in colorectal carcinoma progression〔J〕.Int J Colorectal Dis,2008; 23(11): 1057-64.
13 Sun HC,Qiu ZJ,Liu J,et al.Expression of hypoxia-inducible factor-1 alpha and associated proteins in pancreatic ductal adenocarcinoma and their impact on prognosis〔J〕.Int J Oncol,2007; 30(6): 1359-67.
14刘扬,刘荔萍,刘爱东.老年眼睑基底细胞癌患者术后组织中Survivin、Ataxin-3和PTEN表达及意义〔J〕.中国老年学杂志,2014; 34(11): 2933-4.
15 Lu D,Qian J,Yin X,et al.Expression of PTEN and survivin in cervical cancer: promising biological markers for early diagnosis and prognostic evaluation〔J〕.Br J Biomed Sci,2012; 69(4): 143-6.
16 Chen J,Li T,Liu Q,et al.Clinical and prognostic significance of HIF-1α,PTEN,CD44v6,and survivin for gastric cancer: a meta-analysis〔J〕.PLoS One,2014; 9(3): e91842.
17 Bache M,Holzapfel D,Kappler M,et al.Survivin protein expression and hypoxia in advanced cervical carcinoma of patients treated by radiotherapy〔J〕.Gynecol Oncol,2007; 104(1): 139-44.
18 Alig SK,Stampnik Y,Pircher J,et al.The tyrosine phosphatase SHP-1 regulates hypoxia inducible factor-1α(HIF-1α)protein levels in endothelial cells under hypoxia〔J〕.PLoS One,2015; 10(3): e0121113.
19 Li J,Guo ZY,Gao XH,et al.Low molecular weight heparin(LMWH)improves peritoneal function and inhibits peritoneal fibrosis possibly through suppression of HIF-1α,VEGF and TGF-β1〔J〕.PLoS One,2015; 10(2): e0118481.
〔2014-07-19修回〕
(编辑苑云杰)
〔文章编号〕1005-9202(2015)20-5821-02;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 066
〔文献标识码〕A
〔中图分类号〕R737. 33
第一作者:艾小庆(1981-),女,主治医师,主要从事妇产科疾病研究。
