钙磷诱导大鼠血管平滑肌细胞钙化的机制研究*
2015-12-15邱翠婷吕安林李寰姜晓宇马晓磊李珊郭显
邱翠婷, 吕安林,李寰, 姜晓宇, 马晓磊, 李珊, 郭显
钙磷诱导大鼠血管平滑肌细胞钙化的机制研究*
邱翠婷, 吕安林,李寰, 姜晓宇, 马晓磊, 李珊, 郭显
目的: 探讨氧化应激损伤在钙磷诱导的血管平滑肌细胞(VSMCs)钙化过程中的作用机制。
方法: 采用氯化钙(CaCl2)联合β-甘油磷酸钠(β-GP)建立大鼠VSMCs钙化模型。实验分为4组,对照组、钙化组、钙化+过氧化氢(H2O2)组和钙化+过氧化氢酶组。8天后分别通过茜素红S染色法和邻甲酚肽络合酮比色法检测各组细胞钙结节形成及钙含量;活性氧检测试剂盒 (DCFH-DA探针)检测各组细胞活性氧阳性细胞数;蛋白免疫印迹法检测各组细胞中成骨转录因子Runx2的蛋白表达量。
结果: 钙化组活性氧的产生、钙结节、钙含量及Runx2蛋白表达量均显著高于对照组,钙化+过氧化氢组与钙化组相比,各项指标进一步升高,差异有统计学意义(P<0.05)。钙化+过氧化氢酶组活性氧产生量、钙结节、钙含量及Runx2蛋白表达量均低于钙化组和钙化+过氧化氢组,仍高于对照组,差异有统计学意义(P<0.05),但其中Runx2蛋白表达量与对照组相比则差异无统计学意义(P>0.05)。
结论: 氯化钙联合β-GP通过激活ROS-Runx2信号通路诱导大鼠VSMCs钙化形成。
血管平滑肌细胞钙化;氧化应激;活性氧;Runx2蛋白
Methods: The VSMC calcification was induced by incubating the cells with calcium chloride (CaCl2) and β-sodium glycerophosphate (β-GP) for 8 days, and the cells were divided into 4 groups:①Control group,②Calcification group,③Calcification + H2O2group,④Calcification + catalase group. The calcium nodule formation and calcium deposition in VSMC were detected by Alizarin red staining and o-cresolphthalein complexone method, the reactive oxygen species (ROS) was detected by DCFH-DA probe staining and the protein expression of Runx2 was examined by Western blot analysis.
Results: Compared with Control group, Calcification group showed the higher ROS production, more calcium nodule and calcium deposition, higher Runx2 protein expression; while compared with Calcification group, the above indexes were even higher in Calcification + H2O2group, P<0.05. The ROS production, calcium nodule, calcium deposition and Runx2 protein expression were lower in Calcification + catalase group than those in Calcification group and Calcification + H2O2group, but still higher than that in Control group. The protein expression of Runx2 was similar between Calcification + catalase group and Control group, P>0.05.
Conclusion: CaCl2and β-GP treatment may induce VSMC calcification via activating ROS-Runx2 signal pathway in experimental rats.
(Chinese Circulation Journal, 2015,30:64.)
糖尿病、慢性肾功能不全的患者随着病情的逐渐发展会出现不同程度的血管钙化现象。最新研究表明,血管钙化并非简单地由于磷酸钙晶体被动沉积于血管壁,其形成过程类似于骨发育,钙化的主要环节是血管平滑肌细胞(VSMCs)在病理因素影响下向具有合成和分泌功能的成骨样细胞分化,合成并分泌骨形成相关蛋白[1,2]。近来研究发现该过程与氧化应激损伤具有密切的关系,慢性肾功能不全的患者机体钙磷代谢紊乱,过量的钙(Ca2+)和磷(Pi)会引起细胞发生氧化应激损伤,细胞内活性氧(ROS)产生增加[3]。过氧化氢(H2O2)是一种能够自由通过细胞膜的ROS,参与细胞内多条信号通路的调控。成骨转录因子Runx2是调节成骨细胞和软骨细胞分化的关键转录因子,在动脉粥样硬化患者的血管壁中及小鼠钙化的主动脉管壁中均发现Runx2的高表达,而正常的血管壁中则未发现其表达。本研究拟通过氯化钙(CaCl2)联合β-甘油磷酸钠(β-GP)建立VSMCs钙化模型,明确ROS对VSMCs钙化的影响及ROS-Runx2通路在其中的作用。
1 材料与方法
材料与主要试剂:2013-11至2014-09选择雄性SD大鼠,4周龄,体重80~100g(购自第四军医大学实验动物中心)。CaCl2、β-GP及茜素红S(Sigma)。改良杜氏伊格尔培养基DMEM(Hyclone,中国北京)。胎牛血清(FBS,Hyclone,中国北京)。活性氧检测试剂盒(S0033,碧云天生物公司)。钙测定试剂盒(邻甲酚肽络合酮比色试剂盒,北京中生北控生物公司)。Runx2抗体( Cell Signaling Technology,美国)。
大鼠VSMCs的培养: 无菌条件下分离大鼠胸主动脉,完整剥去外膜,将血管剪成2 mm长的动脉环接种于细胞培养瓶中,用DMEM培养基培养(含45 g/L葡萄糖,100 U/L青霉素及链霉素,20%胎牛血清),置于37 ℃含5% CO2孵箱中培养,3~5 d后更换培养基。经形态学和免疫组织化学法鉴定为VSMCs。实验取用3~8代的VSMCs[4]。
细胞钙化模型的建立及实验分组: 将细胞以5×104/L接种于6孔细胞培养板中,待细胞贴壁后用含终浓度7.2 mM CaCl2和10 mM β-GP的高糖DMEM联合诱导8 d,每2 d更换一次培养基[3]。分别取6孔板中正常培养的VSMCs随机分4组:对照组;钙化组;钙化+过氧化氢组;钙化+过氧化氢酶组,其中过氧化氢和过氧化氢酶分别在钙化诱导第一天与钙化培养基同时干预细胞。各组设置平行实验进行重复检测并分别进行3次独立实验。
细胞内活性氧检测: 将细胞以5×104/L接种于6孔细胞培养板中,待细胞贴壁后施加干预,以上4组每组设6个复孔。48 h后,去除细胞培养液,加入适当体积稀释好的活性氧荧光DCFH-DA探针,无血清培养基1:1000稀释,37℃孵育20 min。无血清培养基洗涤3次,以充分去除未进入细胞的DCFH-DA探针。激光共聚焦显微镜下观察并拍照[5]。
细胞钙化鉴定及检测:①茜素红S染色:细胞干预8 d后,4 ℃磷酸缓冲液洗涤3次,多聚甲醛固定20 min,加入1% 茜素红S(1 g茜素红S,100 ml蒸馏水),室温下孵育20 min,磷酸缓冲液冲洗3次,普通光学显微镜下观察钙结节被染成红色[6]。②细胞钙沉积含量检测:以上4组每组设6个复孔,细胞干预8 d后,4 ℃磷酸缓冲液洗涤3次,0.6 M HCl 37 ℃孵育24 h脱钙,次日收集上清液用于钙含量检测。将6孔板中的细胞洗涤3次,加入1 M NaOH/0.1% SDS裂解细胞,提取上清液,BCA法检测细胞蛋白含量[7]。用每孔细胞的蛋白含量对钙含量进行标准化(钙含量/蛋白含量)[8]。
蛋白免疫印迹法(Western blot) 检测Runx2蛋白表达水平:取各组6 孔培养板中密度达1×107/L的VSMCs,预冷的磷酸盐缓冲液(PBS) 洗涤3次后,加入160~180微升裂解液,提取细胞总蛋白,BCA法测定蛋白浓度,计算各组上样量,8% 聚丙烯酰胺凝胶(SDS- PAGE)电泳、转膜3 h、5%牛奶封闭、加兔抗鼠Runx2蛋白I抗(1:1500稀释)、4 ℃孵育过夜、辣根过氧化物酶标记的山羊抗兔Ig G 孵育1 h。Bio-Rad蛋白成像仪显像。Image J软件分析蛋白条带积分吸光度值(IA),以目的蛋白IA 值/β-actin IA 值的比值反映目的蛋白相对水平。
统计学处理:计量资料数据用均数±标准差表示。采用SPSS 19.0软件进行单因素方差分析,P<0.05为差异有统计学意义。
2 结果
VSMCs中 ROS检测:对照组中ROS阳性细胞数为4±2.73,而钙化组中ROS阳性细胞数增多39±4.32,差异具有统计学意义(n=3,P=0.006)。
钙化+过氧化氢组中ROS阳性细胞数进一步增加74±8.74,与对照组比较差异有统计学意义(P=0.0091),而使用过氧化氢清除剂—钙化+过氧化氢酶组ROS阳性细胞数为10±3.29,较钙化组显著减少,差异具有统计学意义(P=0.0057),以上数值均检测三次,取其平均值。图1

图1 激光共聚焦显微镜观察各组血管平滑肌细胞中细胞内活性氧表达,细胞内活性氧阳性细胞呈绿色荧光(×200)
钙化形态学及钙含量检测:钙化组钙结节形成,钙含量为(71.70±7.81)μg/mg蛋白,比对照组(2.99±0.4)μg/mg蛋白显著升高,差异有统计学意义(P=0.0001),钙化+过氧化氢组钙结节形成[钙含量为(111.3±21.34)μg/mg蛋白]较钙化组增加差异有统计学意义(P=0.03),钙化+过氧化氢酶组钙结节形成较少,钙含量为(37.29±8.29)μg/mg蛋白,与钙化组和钙化+过氧化氢组相比均显著降低,与对照组相比仍升高,差异均有统计学意义(P=0.0064;P=0.0025)。图2
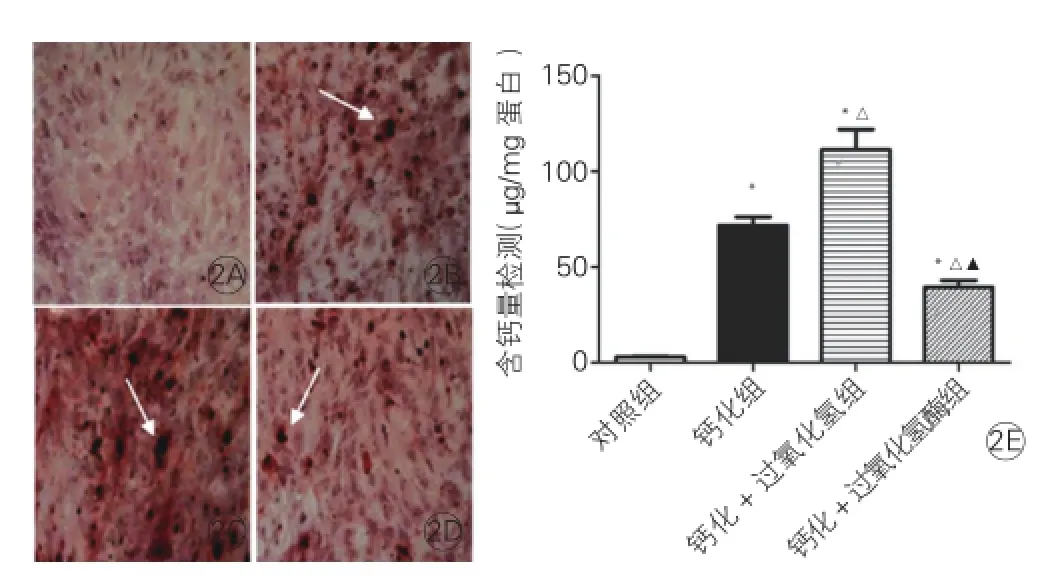
图2 茜素红S染色法检测各组血管平滑肌细胞钙结节形成
Runx2的蛋白表达定量分析:蛋白免疫印迹结果显示,在56 kDa(Runx2)处可见稳定的特异性条带。各组目的蛋白灰度值与β-actin(43 kDa)的灰度值比较计算相对灰度值。结果发现,钙化组Runx2蛋白表达(相对灰度值为0.58±0.029)较对照组(0.27±0.025)升高,差异有统计学意义(P=0.0005),钙化+过氧化氢组Runx2蛋白表达(0.79±0.036)较钙化组相比进一步升高,差异有统计学意义(P=0.003),而钙化+过氧化氢酶组Runx2蛋白表达(0.36±0.029)与钙化组及钙化+过氧化氢组相比均降低,差异均有统计学意义(P=0.0032,P=0.0001),与对照组相比则差异无统计学意义 (P=0.073) 。图3
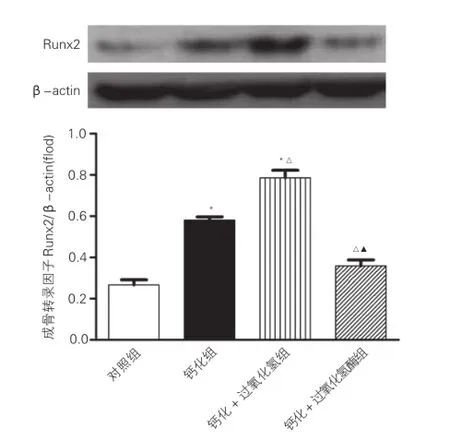
图3 蛋白免疫印迹法检测各组血管平滑肌细胞中Runx2蛋白表达(n=3)
3 讨论
高胆固醇血症、高血压、糖尿病和慢性肾功能不全的晚期患者发生心血管事件风险增加,血管钙化被认为是其心血管疾病发病率和死亡率的独立危险因素[9,10],血管钙化也是评价糖尿病及慢性肾功能不全患者的一项预后指标[11]。因此预防和治疗血管钙化对于原发病的发展和预后均具有重要的临床意义[12]。
当机体发生不同程度氧化应激损伤,大量ROS的产生在血管钙化的发生发展过程中发挥重要作用,也与 ROS影响细胞内成骨蛋白的表达有关[3,13]。Miller等[14]研究证实了ROS在不同种类瓣膜钙化发病过程中的起重要作用,如ROS能够促进主动脉瓣钙化,并导致主动脉瓣狭窄。慢性肾功能不全患者高血磷高血钙,糖尿病患者体内终末期糖基化产物堆积导致的血管钙化与氧化应激损伤有关
[1,5]。本研究采用CaCl2和β-GP联合诱导VSMCs,并成功建立VSMCs钙化模型,同时发现钙化组ROS升高。为了进一步证实ROS在钙化形成过程中的作用,本研究在Ca2+和Pi干预的基础上加入0.2 mM H2O2,发现细胞中ROS产生量增加,且钙化程度较单纯Ca2+和Pi联合诱导组的钙化程度加重。过氧化氢酶是细胞内过氧化氢的清除剂,催化过氧化氢分解成水和氧气,因此我们在Ca2+和Pi存在的基础上又加入过氧化氢酶,发现细胞中ROS显著减少,同时钙结节和钙含量与钙化组相比也显著减少。
H2O2是ROS中较常见的形式之一。大量研究证实H2O2作为第二信使参与氧化应激损伤的过程,而VSMCs钙化又与氧化应激损伤具有密切关系。Runx2是调节成骨细胞和软骨细胞分化的关键转录因子,由此推论H2O2作为第二信使上调成骨转录因子Runx2在VSMCs中的表达,从而促使VSMCs由收缩表型向成骨样细胞转化[15,16]。本研究发现Ca2+和Pi联合诱导VSMCs中成骨转录因子Runx2蛋白表达量升高,为了证实ROS在VSMCs钙化形成中的作用,我们分别通过促进或减少ROS的表达,即在Ca2+和Pi干预的基础上分别加入H2O2和过氧化氢酶,检测VSMCs中Runx2的蛋白表达量。结果发现加入H2O2后与Ca2+和Pi联合诱导的VSMCs相比Runx2蛋白表达量进一步升高,而使用过氧化氢酶的VSMCs中Runx2蛋白表达量降低,并与对照组相比差异无统计学意义。
本研究证实了VSMCs钙化形成与氧化应激损伤有关,ROS作为第二信使激活VSMCs中成骨转录因子Runx2的表达,由具有收缩表型的平滑肌细胞向成骨样细胞转变并促使钙化形成[17]。此外,我们在实验中还发现氧化应激损伤可造成细胞超微结构如线粒体、内质网肿胀和溶解,进而造成细胞发生程序性死亡—凋亡,且大量研究证实凋亡与VSMCs钙化形成密切相关[7,18,19],因此,氧化应激损伤是否通过多条途径促进VSMCs钙化形成还有待进一步深入研究,进而探明动脉钙化的重要发病机理,为动脉钙化提供新的治疗靶点。
[1] Liberman M, Pesaro AE, Carmo LS, et al.Vascular calcification: pathophysiology and clinical implications.Einstein (Sao Paulo), 2013, 11: 376-382.
[2] Burton DG, Matsubara H, Ikeda K.Pathophysiology of vascular calcification: Pivotal role of cellular senescence in vascular smooth muscle cells.Exp Gerontol, 2010, 45: 819-824.
[3] Roman-Garcia P, Barrio-Vazquez S, Fernandez-Martin JL, et al. Natural antioxidants and vascular calcification: a possible benefit.J Nephrol , 2011, 24: 669-672.
[4] Li H, Tao HR, Hu T, et al.Atorvastatin reduces calcification in rat arteries and vascular smooth muscle cells.Basic Clin Pharmacol Toxicol, 2010, 107: 798-802.
[5] Sage AP, Tintut Y, Demer LL.Regulatory mechanisms in vascular calcification.Nat Rev Cardiol, 2010, 7: 528-536.
[6] Schurgers LJ, Spronk HM, Skepper JN, et al.Post-translational modifications regulate matrix Gla protein function: importance for inhibition of vascular smooth muscle cell calcification.J Thromb Haemost, 2007, 5: 2503-2511.
[7] Zuo PY, Chen XL, Lei YH, et al.Growth arrest-specific gene 6 protein promotes the proliferation and migration of endothelial progenitor cells through the PI3K/AKT signaling pathway.International Journal of Molecular Medicine, 2014, 34: 299-306.
[8] Liao XB, Peng YQ, Zhou XM, et al.Taurine restores Axl/Gas6 expression in vascular smooth muscle cell calcification model.Amino Acids, 2010, 39: 375-383.
[9] Linefsky JP, O'Brien KD, Katz R, et al.Association of serum phosphate levels with aortic valve sclerosis and annular calcification: the cardiovascular health study.Journal Of The American College of Cardiology, 2011, 58: 291-297.
[10] Shanahan CM, Crouthamel MH, Kapustin A, et al.Arterial calcification in chronic kidney disease: key roles for calcium and phosphate. Circulation Research, 2011, 109: 697-711.
[11] Schurgers LJ.Vitamin K: key vitamin in controlling vascular calcification in chronic kidney disease.Kidney International, 2013, 83: 782-784.
[12] Chowdhury UK, Airan B, Mishra PK, et al.Histopathology and morphometry of radial artery conduits: basic study and clinical application.Annals of Thoracic Surgery, 2004, 78: 1614-1621.
[13] Maziere C, Salle V, Gomila C, et al.Oxidized low density lipoprotein increases RANKL level in human vascular cells.Involvement of oxidative stress.Biochem Biophys Res Commun, 2013, 440: 295-299.
[14] Miller JD, Chu Y, Brooks RM, et al.Dysregulation of antioxidant mechanisms contributes to increased oxidative stress in calcific aortic valvular stenosis in humans.Journal of The American College Of Cardiology, 2008, 52: 843-850.
[15] Liberman M, Bassi E, Martinatti MK, et al.Oxidant generation predominates around calcifying foci and enhances progression of aortic valve calcification.Arterioscler Thromb Vasc Biol, 2008, 28: 463-470.
[16] Byon CH, Javed A, Dai Q, et al.Oxidative stress induces vascular calcification through modulation of the osteogenic transcription factor Runx2 by AKT signaling.Journal of Biological Chemistry, 2008, 283: 15319-15327.
[17] 许连军, 高润霖, 吴超, 等.双环铂对人主动脉平滑肌细胞和内皮细胞增殖影响的初步体外实验研究.中国循环杂志, 2012, 27: 454-457.
[18] Kim H, Kim HJ, Lee K, et al.alpha-Lipoic acid attenuates vascular calcification via reversal of mitochondrial function and restoration of Gas6/Axl/Akt survival pathway.J Cell Mol Med, 2012, 16: 273-286.
[19] 王议, 吴新华, 杨瑛, 等.云南农村自然人群冠状动脉钙化与脉压差的关系.中国循环杂志, 2014, 29: 428-431.
Investigation for the Mechanism of Vascular Smooth Muscle Cell Calcification Induced by Calcium and Phosphorus in Experimental Rats
QⅠU Cui-ting, LV An-lin, LⅠ Huan, JⅠANG Xiao-yu, MA Xiao-lei, LⅠ Shan, GUO Xian.
Department of Cardiology, Xijing Hospital, Fourth Military Medical University, Xi’an (710032) Shaanxi, China
Co-corresponding Authors: LV An-lin, Email: lvanlin@fmmu.edu.cn and LⅠ Huan, Email: lihuan816@yahoo.com
Objective: To explore the effect of oxidative stress injury on the mechanism of vascular smooth muscle cell (VSMC) calcification induced by calcium and phosphorus in experimental rats.
Vascular smooth muscle cell calcification; Oxidative stress; Reactive oxygen species; Runx2 protein
2014-08-29)
(编辑:汪碧蓉)
国家自然科学基金(NO.81170256);陕西省科技计划项目(项目编号:2009K13-01)
710032 陕西省西安市,中国人民解放军第四军医大学第一附属医院 心内科
邱翠婷 硕士研究生 主要从事动脉钙化研究 Email:qiucuiting87410@163.com 通讯作者:吕安林 Email:lvanlin@fmmu.edu.cn 李寰Email:lihuan816@yahoo.com
R54
A
1000-3614( 2015 ) 01-0064-04
10.3969/ j. issn. 1000-3614. 2015.01.017
