PTD4-Apoptin融合蛋白可溶性表达及其对Hela细胞的抑制作用
2015-12-15荆鑫鑫刘鸿飞葛堂栋王明富王跃新佳木斯大学基础医学院黑龙江佳木斯154007
荆鑫鑫 刘鸿飞 张 涛 张 强 葛堂栋 王明富 王跃新(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
PTD4-Apoptin融合蛋白可溶性表达及其对Hela细胞的抑制作用
荆鑫鑫刘鸿飞张涛张强葛堂栋王明富王跃新(佳木斯大学基础医学院,黑龙江佳木斯154007)
〔摘要〕目的构建PTD4-Apoptin融合蛋白的原核表达载体并表达蛋白,检测其对Hela细胞的生长抑制作用。方法人工合成Apoptin序列和PTD4序列,构建pGEX-6p-1-PTD4-Apoptin原核表达载体,使其在E. coli BL21(DE3)中表达。使用GST亲和层析柱纯化融合蛋白,并使用超滤管浓缩纯化后的目的蛋白,得到高浓度的融合蛋白。向Hela细胞中加入融合蛋白,检测其对Hela细胞的生长抑制作用。结果PTD4-Apoptin融合蛋白在大肠杆菌中可溶性表达成功,对Hela细胞生长具有抑制作用,PTD4-Apoptin对Hela细胞抑制率达82. 34%。结论成功构建PTD4-Apoptin融合蛋白表达载体,并表达可溶性的融合蛋白,PTD4-Apoptin对Hela细胞具有明显的抑制作用。
〔关键词〕Apoptin; PTD4; Hela
凋亡素(Apoptin)是鸡贫血病毒(CAV)编码的对正常细胞无毒性作用的小分子蛋白质〔1,2〕,可选择性地诱导肿瘤细胞的凋亡,而不伤害正常细胞,因此Apoptin是一种潜在的抗肿瘤药物。天然Apoptin很难透过细胞膜进入细胞〔3〕,如果在Apoptin一级序列前连接上可介导生物大分子物质透过细胞膜进入细胞内的穿膜肽,即可穿过细胞膜进入细胞〔4〕。TAT穿膜肽与Apoptin连接表达的融合蛋白具有良好的抑瘤作用〔5〕,但人工合成的穿膜肽PTD4较TAT结构更稳定且穿膜效率更高〔6〕。目前有构建PTD4-Apoptin表达载体并表达,但得到的是PTD4-Apoptin融合蛋白的包涵体,还需要复性才具有活性〔7,8〕。本实验旨在构建PTD4-Apoptin融合蛋白的可溶性表达载体并表达,获得对肿瘤细胞具有高效穿膜作用的可溶性PTD4-Apoptin融合蛋白,研究其对Hela细胞的抑制作用。
1 材料和方法
1. 1载体和细胞质粒pGEX-6p-1购于深圳伟通生物科技有限公司,E. coli BL21(DE3)感受态菌购于天根生物科技有限公司,E. coli DH 5α、人宫颈癌Hela细胞由哈尔滨医科大学惠赠。
1. 2试剂质粒提取试剂盒、DNA marker购于天根生物科技有限公司,SDS-PAGE凝胶试剂盒、蛋白质marker、4×SDS上样缓冲液、离心超滤浓缩管、MTT试剂盒购于北京索莱宝生物科技有限公司,GST SefinoseTM Resin购于上海生工科技有限公司,限制性内切酶BamH I、EcoR I、Xho I、T4 DNA连接酶购于大连宝生物科技有限公司。
1. 3表达载体的构建
1. 3. 1 pGEX-6p-1-Apoptin载体构建优化Apoptin的编码序列,使其在大肠杆菌中能更好表达。优化后的Apoptin编码基因序列由上海生工生物工程有限公司合成,连接入质粒载体pGEX-6p-1的EcoR I和Xho I位点之间,得到重组载体pGEX-6p-1-Apoptin。
1. 3. 2 PTD4序列合成根据PTD4氨基酸序列YARAAARQARA,合成PTD4的DNA序列的2条互补的单核苷酸链,编码链5'端加上BamH I限制性酶切位点的黏性末端,反义链的5'端加上EcoR I限制性酶切位点的黏性末端,由上海生工生物工程有限公司合成。正向序列: 5'-GATCCTACGCCCGTGCCGCAGCCCGTCAGGCCCGTGCCG-3';反向序列: 5'-AATTCGGCACGGGCCTGACGGGCTGCGGCACGGGCGTAG-3';将2条单核苷酸链等摩尔混合,加热至95℃,降温至25℃,形成双链DNA分子。
1. 3. 3重组表达载体pGEX-6p-1-PTD4-Apoptin的构建限制性内切酶BamH I和EcoR I双酶切重组质粒载体pGEX-6p-1-Apoptin,使用T4 DNA连接酶将PTD4的双链DNA分子与重组质粒载体pGEX-6p-1-Apoptin酶切片段16℃连接过夜。连接产物转化至E. coli DH 5α感受态菌株中,使用质粒提取试剂盒提取质粒,酶切验证,将验证正确的质粒送往上海生工生物工程有限公司,进行基因测序。
1. 3. 4表达载体pGEX-6p-1-PTD4-GFP的构建构建成功的表达载体pGEX-6p-1-PTD4-Apoptin由武汉淼灵生物科技有限公司改造为pGEX-6p-1-PTD4-GFP表达载体。
1. 4融合蛋白的表达重组载体pGEX-6p-1-PTD4-GFP和pGEX-6p-1-PTD4-Apoptin转化至E. coli BL21(DE3)菌株。含目的质粒的菌株加入含氨苄青霉素的LB培养液中培养至OD600为0. 4~0. 6,加入IPTG至终浓度为0. 01 mmol/L,25℃诱导培养6 h,4℃存放过夜,同等条件下以pGEX-6p-1空载体为对照。离心收集菌体,冰预冷的PBS缓冲液重悬菌体,超声破碎,离心收集上清和沉淀,进行SDS-PAGE电泳检测。
1. 5融合蛋白的纯化10倍柱体积冰预冷的PBS平衡GST亲和层柱待用;收集破菌液上清,0. 22 μm滤膜过滤后上柱; 5倍柱体积的PBS洗柱4次;加入2 ml GST洗脱缓冲液洗脱目的蛋白,多次洗脱后,收集洗脱液,使用4 ml的超滤柱浓缩,并更换蛋白缓冲液。
1. 6 PTD4-Apoptin融合蛋白对Hela细胞的抑制作用收集Hela细胞,分于96孔板,3 000个/孔。置于细胞培养箱中培养24 h后,加入PTD4-GFP和PTD4-Apoptin融合蛋白,继续培养48 h后吸去上清,用PBS洗涤后,加入MTT工作液,继续培养4 h,然后吸去上清,加入Formanzan溶解液,置于摇床上振荡,待结晶紫充分溶解后,在490 nm波长下测量各孔的吸光值。以pGEX-6p-1空质粒载体的提取物作为对照。
1. 7统计学方法采用SAS9. 1. 3软件进行单因素方差分析及t检验。
2 结果
2. 1表达载体的鉴定表达载体pGEX-6p-1-PTD4-GFP使用EcoR I和Xho I酶切验证;表达载体pGEX-6p-1-PTD4-Apoptin,使用BamH I和Xho I酶切验证,以pGEX-6p-1-Apoptin和pGEX-6p-1空质粒载体作为对照。pGEX-6p-1-PTD4-GFP双酶切后在700 bp出现条带,与预期结果一致,见图1A。pGEX-6p-1-PTD4-Apoptin载体和pGEX-6p-1-Apoptin双酶切后,在400 bp左右出现条带,而且pGEX-6p-1-PTD4-Apoptin的酶切片段略大于pGEX-6p-1-Apoptin的酶切片段,与预期结果一致,见图1B。基因测序结果显示目的基因片段序列正确,见图2。

图2 PTD4-Apoptin测序图谱
2. 2融合蛋白的表达和纯化载体表达提取液进行SDSPAGE电泳,以空质粒载体作为对照。电泳结果显示,pGEX-6p-1-PTD4-GFP表达提取液上清和沉淀都在分子量43~70 kD之间有条带,与预期融合蛋白的分子量计算值54 kD基本相符,而且在上清中融合蛋白大量表达。pGEX-6p-1-PTD4-Apoptin表达提取液上清和沉淀都在分子量31~43 kD之间有条带,与预期融合蛋白的分子量计算值40 kD基本相符,而且融合蛋白在上清中的表达量明显高于沉淀,说明pGEX-6p-1-PTD4-Apoptin主要表达可溶性的PTD4-Apoptin融合蛋白,见图3~5。
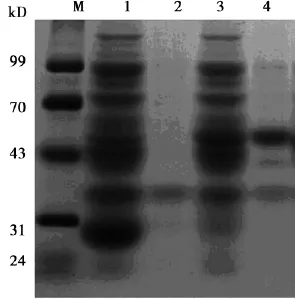
图3 PTD4-GFP融合蛋白表达
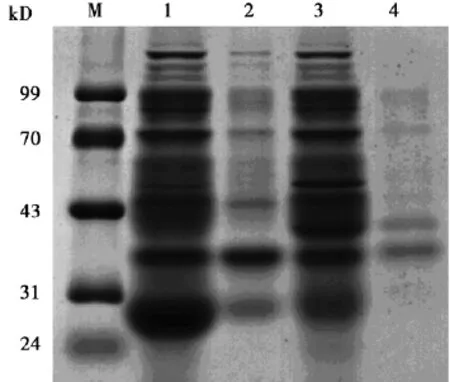
图4 PTD4-Apoptin融合蛋白表达
目的蛋白经纯化后SDS-PAGE电泳结果显示,pGEX-6p-1-PTD4-GFP载体在分子量43~70 kD之间出现单一条带,见图6,表明PTD4-GFP融合蛋白纯化成功。pGEX-6p-1-PTD4-Apoptin载体在分子量31~43 kD之间出现单一条带,见图7,表明PTD4-Apoptin融合蛋白纯化成功。

图5 PTD4-GFP融合蛋白纯化
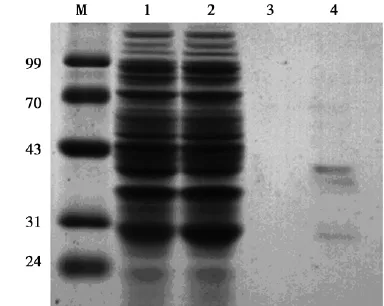
图6 鉴定PTD4-Apoptin融合蛋白
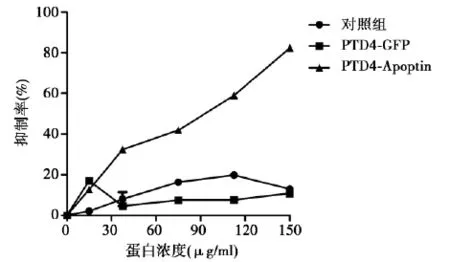
图7 PTD4-Apoptin融合蛋白对Hela细胞的抑制作用
2. 3 PTD4-Apoptin融合蛋白对宫颈癌细胞的抑制作用图7可见,MTT结果显示,PTD4-Apoptin融合蛋白与Hela细胞孵育后,对Hela细胞的抑制率达82. 34%,PTD4-Apoptin融合蛋白对Hela细胞具有明显的抑制作用(P<0. 001),并且随着PTD4-Apoptin融合蛋白浓度的升高,其对Hela细胞抑制作用也增强;而以PTD4-GFP和pGEX-6p-1提取物的对照组对Hela细胞并无明显抑制作用(P>0. 05)。
3 讨论
为了解决天然Apoptin难以透过细胞膜进入细胞的特性,本研究利用基因工程的方法构建PTD4-Apoptin融合蛋白,利用穿膜肽的蛋白转导活性使凋亡素进入细胞内。根据密码子偏好性原则优化了PTD4和Apoptin的编码序列,使其能在大肠杆菌中更容易表达,构建pGEX-6p-1-PTD4-Apoptin表达载体,可表达出结构更稳定的PTD4-Apoptin可溶性蛋白,且表达的PTD4-Apoptin融合蛋白具有显著抑制Hela细胞生长的作用; 因PTD4-GFP融合蛋白对Hela细胞并无抑制作用,故PTD4-Apoptin融合蛋白抑制Hela细胞生长的作用是Apoptin的功效。本研究构建的pGEX-6p-1-PTD4-Apoptin表达载体,成功避开了因表达包涵体需要复性的过程,可直接得到表达大量活性PTD4-Apoptin融合蛋白,简化了PTD4-Apoptin融合提取分离纯化步骤,为进一步研究Apoptin的抗肿瘤作用机制奠定了基础。由于pGEX-6p-1-PTD4-Apoptin表达的PTD4-Apoptin融合蛋白的前端含有谷胱甘肽S转移酶(GST)标签,该标签对蛋白活性是否产生一定的影响尚需进一步研究。
4参考文献
1 Zhou S,Zhang M,Zhang J,et al.Mechanisms of apoptin-induced cell death〔J〕.Med Oncol,2012; 29(4): 2985-91.
2武晓燕,候玲玲,晏琼,等.凋亡素诱导细胞凋亡的机制及其在肿瘤治疗中的应用〔J〕.生物学进展,2014; 45(1): 45-8.
3 Heilman DW,Teodoro JG,Green MR. Apoptin nucleocytoplasmic shuttling is required for cell type-specific localization,Apoptosis,and recruitment of the anaphase-promoting complex/cyclosome to PML bodies〔J〕.J Virol,2006; 80(15): 7535-45.
4刘德纯,袁鹏飞,陈彦彬,等. TAT-Apoptin融合蛋白用于抗肝癌实验研究〔J〕.中外医疗,2014; 15(1): 70-2.
5刘雪梅,崔剑,候剑伟,等. TAT-Apoptin融合蛋白分泌表达载体的构建及其活性检测〔J〕.中国医科大学学报,2013; 42(1): 45-8.
6李峰,陈岚,肖新莉,等.蛋白质-外源物质进入细胞的新工具〔J〕.生命的化学,2004; 24(3): 192-5.
7 Sun J,Yan Y,Wang XT,et al.PTD4-apoptin therapy inhibits tumor growth in vivo〔J〕.Int J Cancer,2009; 124: 2973-81.
8 Jin JL,Gong J,Yin TJ,et al.PTD4-Apoptin protein and dacarbazine show synergistic antitumor effect on B16-F1 melanoma in vitro and in vivo〔J〕.Eur J Pharmacol,2011; 654(1): 17-25.
〔2014-09-19修回〕
(编辑李相军)
通讯作者:张涛(1964-),女,教授,硕士生导师,主要从事抗肿瘤药物研究。
基金项目:黑龙江省自然基金项目(No. H201360);佳木斯大学研究生创新项目(No. LZR2014 _ 005);黑龙江省教育厅项目(No. 12531663);佳木斯大学重大项目(No. Szp2012-01)
〔文章编号〕1005-9202(2015)20-5737-03;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 024
〔文献标识码〕A
〔中图分类号〕R73
第一作者:荆鑫鑫(1988-),女,在读硕士,主要从事抗肿瘤药物研究。
