成纤维细胞/胶原凝胶复合支架促进中耳黏膜上皮细胞的增殖
2015-12-15于姝媛勇刘柏林李晓峰吉林大学第一医院耳鼻咽喉头颈外科吉林长春3002
于姝媛 王 苹 汤 勇刘柏林李晓峰(吉林大学第一医院耳鼻咽喉-头颈外科,吉林 长春 3002)
成纤维细胞/胶原凝胶复合支架促进中耳黏膜上皮细胞的增殖
于姝媛王苹汤勇1刘柏林1李晓峰1
(吉林大学第一医院耳鼻咽喉-头颈外科,吉林长春130021)
〔摘要〕目的探讨植入成纤维细胞的胶原凝胶复合支架对中耳黏膜上皮细胞生长和增殖的影响。方法制备大鼠I型胶原凝胶,以7∶1∶1混合胶原、10×DMEM和新生牛血清。以1/9体积比接种成纤维细胞,构建成纤维细胞的胶原凝胶复合支架,冰冻切片观察成纤维细胞在凝胶中的生长形态。复合支架接种中耳黏膜上皮细胞,共聚焦显微镜观察成纤维细胞与上皮细胞的生长状态,酶消化计数上皮细胞在接种的不同时间点,细胞数量的变化。结果接种后3 d成纤维细胞数量逐渐增加,细胞的突起在两极逐渐伸展延长。冰冻切片结果显示,成纤维细胞均匀地分布于凝胶中,细胞两极为两个较长的突起。接种于成纤维细胞/胶原凝胶复合支架上皮细胞增殖速度明显高于接种于单纯胶原凝胶组,比较上皮细胞在复合支架接种后3 d,6 h的细胞数量明显多于同时间点的胶原凝胶组(P<0. 05,P<0. 01)。共聚焦显微镜观察发现,上皮细胞在单纯胶原凝胶中,集聚生长形成岛型分布,在成纤维细胞/胶原复合支架上,与成纤维细胞交互分布,且细胞密度大于前者。结论植入成纤维细胞的胶原凝胶复合支架对上皮细胞增殖有明显的促进作用。
〔关键词〕胶原凝胶;成纤维细胞;上皮细胞;复合支架
1吉林省人民医院耳鼻咽喉-头颈外科
第一作者:于姝媛(1986-),女,技士,主要从事耳科学研究。
鼓膜穿孔是耳科常见的疾病之一,常由外伤和化脓性中耳炎迁延所致。鼓膜穿孔可引起听力下降、言语发育延迟和慢性耳瘘及胆脂瘤形成等〔1〕。目前常用的治疗方法是外科鼓膜修补,修补材料大多来自自体颞肌筋膜或颞骨骨膜,尽管近期的手术成功率比较高,但由于修补材料与鼓膜组织结构尚存在差异,其主要差异是修补材料缺少纤维层;此外,自体材料存在来源不足和机体的再损伤等原因,使鼓膜功能恢复和远期效果不理想〔2〕。目前组织工程皮肤的研究进展使应用此技术修复鼓膜缺损成为可能,本实验利用不断完善的组织工程学技术及支架材料的开发,探索构建组织工程化鼓膜的技术,研制组织工程化鼓膜移植物,以实现提高鼓膜穿孔治愈率、提高听力功能恢复和远期疗效以及减轻对患者自身机体损伤的目标。
1 材料和方法
1. 1动物和主要实验试剂Wistar大鼠(清洁级)由吉林大学动物部(动物饲养合格证号: 10-1026)提供。随机选取耳廓反射正常,实验前清洁外耳道,显微镜下检查均无中耳炎的动物,确保动物无噪声暴露及药物使用史。胎牛血清(FBS)、DMEM/F12培养基、胰蛋白酶、表皮生长因子(EGF)、Cell Tracker Dil等购于Invitrogen公司,CK19和Vimentin抗体购于北京博奥森生物公司。药房,2010; 21(15): 1439-40.
1. 2中耳黏膜上皮细胞和成纤维细胞的分离培养方法参照Formanek等〔3〕文献。采用10%水合氯醛按300 mg/kg剂量,腹腔注射进行大鼠麻醉。剪开颅骨,取出听泡,立即浸入含抗生素、预冷的D-Hank液中。无菌环境置听泡于解剖显微镜下打开,用分离针剥离中耳黏膜。将黏膜移入0. 075%蛋白酶ⅩⅣ消化液中,室温下消化1 h,移入离心管,1 000 r/min下离心10 min,弃去上清,留取细胞沉淀。用上皮细胞培养基悬浮细胞,活细胞染色并细胞计数,调整细胞含量为5×105/ml,接种于35 mm直径的培养皿内。培养1 h后,将未贴壁的细胞移入另一个培养皿中,加入2 ml上皮细胞培养液(含10%FBS和20 ng/ml EGF的DMEM/F12),剩余细胞加入成纤维细胞培养基(含10%FBS的DMEM/F12)。每日在倒置显微镜下观察细胞形态。上皮细胞和成纤维细胞鉴定采用免疫荧光染色技术,CK19抗体识别上皮细胞,Vimentin抗体识别成纤维细胞。
1. 3胶原凝胶制备采用大鼠鼠尾胶原浸出法,成年大鼠鼠尾,酒精消毒,去除尾上皮肤,分离肌腱与肌肉;将肌腱在70%乙醇中浸泡30 min,切碎,无菌水冲洗;转移至0. 1%乙酸溶液中,每根鼠尾用250ml乙酸溶液浸泡,置于4℃,48 h后取出,4 000 r/min离心30 min,取上清;加入0. 1 mol/L NaOH,按6∶1体积比混合,中和乙酸,然后1 500 r/min离心5 min,收获沉淀;等体积稀乙酸(0. 01 mol/L)溶解沉淀,4℃保存。
1. 4成纤维细胞胶原凝胶的制备取第3代成纤维细胞,在处于对数生长期90%细胞融合时用0. 25%的胰蛋白酶消化3 min,轻轻吹打,1 000 r/min离心,重悬于成纤维细胞培养液中,细胞计数,调整浓度至5×106/ml。用灭菌的0. 1 mol/L的醋酸溶液稀释提取的鼠尾胶原浓度至0. 6%,然后与10×DMEM细胞培养液、新生牛血清按7∶1∶1的比例混匀;加入1 mol/L NaOH以中和醋酸,快速混匀,立即加入1/9剂量的成纤维细胞悬液,快速混合。将此胶原/细胞混悬液吸入培养皿;在37℃培养箱中静置10 min,待凝胶形成后,补加成纤维细胞培养液,培养箱中培养。每3天换液1次。
1. 5冰冻切片成纤维细胞胶原凝胶进行冰冻切片,片厚10 μm左右。贴附于载玻片上,10%甲醛固定,磷酸盐缓冲液(PBS)洗涤,进行苏木素-伊红(HE)染色。
1. 6细胞增殖实验中耳黏膜上皮细胞采用Dil标记,以1× 105细胞/ml的浓度分别接种于胶原凝胶和成纤维细胞胶原凝胶复合支架上,持续培养,在培养后3、6 d时间点,消化细胞,荧光显微镜下计数红色荧光标记的细胞数量。
1. 7统计学方法应用SPSS17. 0软件进行单因素方差分析。
2 结果
2. 1中耳黏膜细胞一般形态和鉴定中耳黏膜上皮细胞,在接种后24 h,大部分细胞贴壁,5 d细胞增殖明显,相互融合成岛状(图1a)。培养到第8天时,呈现典型的铺路石状,与角朊细胞相似。细胞融合成片,铺满培养皿的底部(图1b)。激光扫描共聚焦显微镜下观察,培养6 d的中耳黏膜上皮细胞表达CK19标记蛋白,阳性表达定位于细胞质,见图1c。绿色荧光为阳性表达,蓝色荧光为核复染(Heochest33342)。
中耳黏膜成纤维细胞,1 h后既有贴壁细胞,细胞形态为长梭形,6 d细胞集落彼此融合接近长满单层(图1d)。10 d细胞交叉重叠生长,但长梭形的生长形态依然良好(图1e)。采用波形蛋白(Vimentin)免疫荧光染色鉴定成纤维细胞,Vimentin阳性表达呈现红色荧光,定位于细胞质。培养6 d的成纤维细胞均表达标志蛋白Vim。
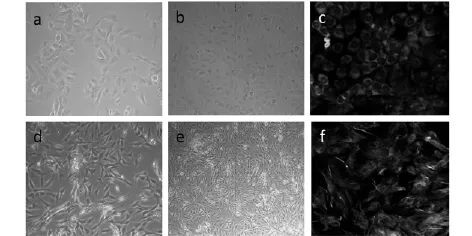
图1 形态学观察中耳黏膜上皮和成纤维细胞
a~c:中耳黏膜上皮细胞,d~f:中耳黏膜成纤维细胞
2. 2成纤维细胞/胶原凝胶复合支架一般形态观察胶原凝胶形成后呈半透明状,随时间延长,胶原凝胶发生收缩,培养基中放置12 d后,胶原凝胶收缩,且胶原弹性增加。成纤维细胞,接种后约3 h可见细胞与胶原纤维发生黏着。接种后3 d,成纤维细胞数量生长迅速,细胞呈长梭形,细胞的两极逐渐伸展延长。胶原凝胶中可以见成纤维细胞极性排列。接种后12 d凝胶块收缩至原来的3/5左右,此后收缩不明显。大约3 w后,成纤维细胞密度达到其极限,部分成纤维细胞从胶原凝胶中迁出。冰冻切片结果显示,HE染色可见胶原凝胶呈较均一的淡红色网状分布,而成纤维细胞均匀地分布于凝胶中,呈长梭形,胞核呈椭圆形,大多数细胞两极为两个较长的突起,极少数细胞有较多的突起。见图2。

图2 成纤维细胞/胶原凝胶复合支架的HE染色
2. 3中耳黏膜上皮细胞在成纤维细胞/胶原凝胶复合支架上增殖活性变化胶原凝胶接种成纤维细胞3 d后,在细胞/胶原凝胶复合支架上接种Dil染料标记的上皮细胞。分别在接种上皮细胞的3 d、6 d后,消化细胞,荧光显微镜下计数红色荧光细胞的细胞数。结果显示,接种于成纤维细胞/胶原凝胶复合支架上皮细胞增殖速度明显高于接种于单纯胶原凝胶组,比较上皮细胞在复合支架接种后3 d、6 h的细胞数量明显多于同时间点的胶原凝胶组(P<0. 05,P<0. 01)。共聚焦显微镜观察发现,上皮细胞在单纯胶原凝胶中,集聚生长形成岛型分布,在成纤维细胞/胶原复合支架上,与成纤维细胞交互分布,且细胞密度大于前者。见图3。蓝色荧光为Dapi标记的成纤维细胞,红色荧光为Dil标记的上皮细胞,Bar=50 μm

图3 成纤维细胞/胶原凝胶复合支架接种上皮细胞的激光共聚焦扫描结果(×200)
3 讨论
鼓膜位于中耳鼓室和外耳道交界,是一个由上皮层、黏膜层和中间纤维层组成的半透明薄膜,具有增加传入声波增益的特殊传音结构。鼓膜损伤导致穿孔常见的治疗方法是外科修补,选用自体颞骨骨膜、颞肌筋膜或耳屏软骨膜封闭穿孔,尽管手术修补的成功率较高,但由于修补材料与鼓膜组织结构存在差异(缺少纤维层),鼓膜功能恢复和远期疗效不理想。由于鼓膜组织形成的特殊放射状纤维支持鼓膜的强度及紧张度,而大部分的穿孔愈合是假膜愈合,即只有上皮层和黏膜层,缺少成纤维细胞形成的中间纤维层,假性鼓膜仍无法补偿声音传入时所产生的衰减。这个实验通过构建胶原/成纤维细胞符合支架,观察组织工程鼓膜纤维层结构对黏膜上皮细胞生长和增殖的影响,构建具有纤维层的完整生物工程鼓膜。
生物工程材料在外科组织修复术中有广泛的应用。如何根据损伤组织局部的组织学特征需用合适的工程材料是组织修复成功的关键。适合于鼓膜修复的工程材料首选考虑中间纤维层的形成,以保证修复成功后的鼓膜强度和适宜的紧张度。顾其胜〔4〕报道,胶原蛋白具有成纤维性能。本实验证实凝胶中的成纤维细胞与胶原之间存在相互作用,有利于成纤维细胞的有序生长、增殖。成纤维细胞沿胶原纤维纵向排列,这种结构使得纤维细胞凝胶复合支架具有一定的伸展性和弹性。
Tremblay等〔5〕研究发现,利用含成纤维细胞和不含成纤维细胞的胶原、弹性蛋白生物工程复合物进行皮肤损伤修复,发现移植后含成纤维细胞的复合物降解速度要比不含成纤维细胞的慢2~4 w,证实植入的成纤维细胞可稳定真皮纤维层。成纤维细胞可分泌EGF等上皮生长因子,促进上皮细胞生长,而且胶原中成纤维细胞具有促真皮与表皮重组的作用。
文献报道在体外培养时上皮细胞与成纤维细胞的相互作用是通过它们分泌在培养基中的可溶性酸性生长因子来实现的。成纤维细胞既能够分泌胰岛素样生长因子(IGF-1),也能合成Ⅰ、Ⅲ型胶原和纤维黏连蛋白(FN),FN成分具有促进细胞向伤口处移动〔6〕,成纤维细胞在组织上与过程中的作用不可缺少。
在体外培养过程中,成纤维细胞沿胶原纤维重新排列,接种成纤维细胞12 d后凝胶块收缩至原来的3/5左右。可能源于胶原凝胶中的成纤维细胞分泌Ⅰ和Ⅲ型胶原等细胞外基质,这些新分泌的基质成分使重组胶原凝胶发生纤维重构。此外,细胞外基质的增多可以改善胶原凝胶的生物相容性,重构的胶原凝胶改变了胶原凝胶的韧性,使复合支架更适合上皮细胞生长。Goulet等〔7〕通过成纤维细胞和上皮细胞间接共同培养的系统观察成纤维细胞对上皮细胞生长的影响。结果发现,间接共培养系统明显刺激上皮细胞的生长和增殖,上皮细胞克隆形成率增加,认为这个间接培养基中存在着由成纤维细胞所分泌的生长因子促进上皮细胞的增殖。Yoshikawa等〔8〕研究认为成纤维细胞可能还分泌一些其他类型与上皮细胞分化增殖信号传导途径的细胞基质成分,这在鼓膜修复过程中的作用尚待进一步证实。
综上所述,在胶原凝胶中成纤维细胞具有活跃的生物学特性,使之形成有抗拉伸能力的组织工程类似鼓膜纤维层,在其表面成功接种的中耳黏膜上皮细胞具有促黏附和增殖作用,有望成为鼓膜修复的生物工程替代品。
4参考文献
1 Hardman J,Muzaffar J,Nankivell P,et al.Tympanoplasty for chronic tympanic membrane perforation in children: systematic review and meta-analysis〔J〕.Otol Neurotol,2015; 36(5): 796-804.
2 Carr SD,Strachan DR,Raine CH. Factors affecting myringoplasty success 〔J〕.J Laryngol Otol,2015; 129(1): 23-6.
3 Formanek M,Millesi W,Willheim M,et al.Opitimized growth medium for primary culture of human oral keratinocytes〔J〕.Int J Oral Maxilofac,1995,35(5): 157-60.
4顾其胜.胶原蛋白的临床应用〔J〕.中国修复重建外科杂志,2006; 20(10): 1052-8
5 Tremblay P,Cloutier R,Lamontagne J,et al.Potential of skinfi broblastsfor application to anterior cruciate ligament tissue engineering〔J〕.Cell Transplant,2011; 20(4): 535-42.
6 Froget S,Barthelemy E,Guillot F,et al.Wound healing mediator production by human dermal fibroblasts grown within a collagen-GAG matrix for skin repair in humans〔J〕.Eur Cytokine Netw,2003; 14(1): 60-4.
7 Goulet F,Poitras A,Rouabhia M,et al.Stimulation of human keratinocyte proliferation through growth factor exchanges with dermal fibroblasts in vitro〔J〕.Burns,1996; 22(2): 107-12.
8 Yoshikawa M,Kojima H,Yaguchi Y,et al.Cholesteatoma fibroblasts promote epithelial cell proliferation through overexpression of epiregulin〔J〕.PLoS One,2013; 8(6): e66725.
〔2014-11-23修回〕
(编辑袁左鸣/滕欣航)
通讯作者:汤勇(1973-),男,主任医师,主要从事耳科学研究。
基金项目:吉林省自然科学基金项目(No.201015223);吉林省卫生计生委资助课题(No.2012z094)
〔文章编号〕1005-9202(2015)20-5703-03;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 021
〔文献标识码〕A
〔中图分类号〕R764
