慢性低氧及野百合碱对SD大鼠右心室功能及规范性瞬时感受器电位亚家族表达的影响
2015-12-15陈慧勤泉州医学高等专科学校福建泉州362000
陈慧勤 (泉州医学高等专科学校,福建 泉州 362000)
慢性低氧及野百合碱对SD大鼠右心室功能及规范性瞬时感受器电位亚家族表达的影响
陈慧勤(泉州医学高等专科学校,福建泉州362000)
〔摘要〕目的探讨慢性低氧(CH)及野百合碱(MCT)对SD大鼠右心室功能及右心室心肌细胞上规范性瞬时感受器电位(TRPC)亚家族表达的变化。方法将72只SD雄性大鼠随机平均分为对照组(CON组)、CH组和MCT诱导右心室肥大模型组(MCT组),每组24只。CH组将大鼠置于CH(10%O2)环境饲养3 w以诱导大鼠发生右心室肥厚,MCT组则是对SD大鼠进行腹腔注射诱导液,其剂量规定是2%MCT 60 mg/kg,设计MCT诱导大鼠出现右心室肥厚模型。之后对上述三组SD大鼠的右心室进行全面检查,研究其血流动力学指标和右心肥大指数(RVMI)、右心室心肌病理切片,实时定量PCR法和免疫印迹法检测TRPC亚家族mRNA和相关蛋白的表达水平。结果与CON组比较,CH组及MCT组: SD大鼠的右心室功能相关指标收缩压(RVSP)、右心室内压力最大上升速率(+dp/dtmax)、RVMI均显著增加(P<0. 01),且MCT组的血流动力学改变及RVMI均显著高于CH组;心肌纤维组织呈病态状,纤维层变厚,胞核颜色加重、外形不规则,同时经检测发现,MCT组的病理改变较CH组更为显著; CH组右心室心肌组织TRPC1 mRNA表达升高; MCT组右心室心肌组织TRPC6 mRNA表达升高; CH组大鼠右心室TRPC1蛋白指数异常,其表达率增加,MCT组大鼠右心室TRPC6蛋白指数异常,其表达率增加(P<0. 05)。结论在CH环境中生长3 w能够顺利诱导大鼠出现右心室肥厚,同时也会提高其心肌细胞中的TRPC1 mRNA与蛋白的表达,MCT预处理3 w可成功诱导SD大鼠产生右心室心肌肥厚,且MCT预处理的诱导的右心室肥厚现象比较明显,同时也提高其心肌细胞中的TRPC6 mRNA与蛋白的表达,这两个亚型或许是诱导右心室肥厚出现的重要因素。
〔关键词〕慢性低氧;野百合碱;规范性瞬时感受器电位;心肌肥厚; Ca2+
心肌肥厚是老年人死亡率增高的独立危险因素〔1〕。规范性瞬间感受器电位(TRPC)亚家族一员TRPC1~7和钙离子内流密切相关,它们可以改变细胞内外的钙离子浓度,同时也会造成细胞的增殖与凋亡等〔2〕。本研究分别选用慢性低氧(CH)及野百合碱(MCT)诱导的大鼠右心室肥大模型,模拟肺心病的急性发作,对比在CH环境下、MCT诱导大鼠右心室肥厚模型的心肌细胞上,发生的钙离子内流且心肌肥厚是哪一个TRPC亚型影响的。
1 资料与方法
1. 1药品和仪器试剂有: ROX(Roche,澳大利亚)、Trizol(Invitrogen,英国)、逆转录试剂仪(Takara,德国)、引物(江苏生物工程有限公司)、PMSF(碧云天,贵州)、RIPA(碧云天,贵州)、化学发光试剂Novex ECL(BioSpherix,日本)、兔抗大鼠TRPC6抗体(Heraeus,美国)、兔抗大鼠TRPC1抗体(Abcam,德国)、小鼠抗大鼠β-actin抗体(Abcam,俄罗斯)、MCT(Sigma,瑞士),其他分析纯是国产订购。仪器:氧气浓度探测头(E702型,德国Invitrogen企业)、氧气浓度分析器(ProOX-110型,德国Invitrogen企业)、压力转换仪(YPJ01型,南京医疗器械公司)、生物信号采集运作系统(RM6240型,南京医疗器械公司)、冷冻高速离心器(日本Abcam企业)、StepOne实时PCR器(ABI企业,德国)、Mini-Protean Tetra电泳槽(Bio-Rad企业,日本)、BIO-RAD Mini Trans-Blot Cell小型转印槽(Bio-Rad企业,日本)。
1. 2组建慢性低氧诱导的大鼠模型随机选出72只健康雄性SD大鼠,重量范围控制在180~220 g之间(由南京斯莱克实验动物饲养单位提供),自动分为三个实验组,其分别是参照组(CON组)、CH组和MCT组,每组24只。CON组:大鼠在正常环境下不间断喂养3 w; CH组:大鼠在常压低氧的盒子里不间断喂养3 w,低氧盒中的空气成分添加了N2,确保O2浓度控制在9. 8%~10. 2%范围内; MCT组:给SD大鼠一次性腹腔注射2%MCT 60 mg/kg,设计MCT诱导大鼠出现右心室肥厚模型。CH及MCT给药3 w对大鼠右心室血流动力学、肥厚参数、病理组织形态的影响。
1. 3血流动力学参数的测算各组SD大鼠均通过腹腔注射肝素(Heparin,50 IU/100 g),5 min之后经腹腔注射麻药氨基甲酸乙酯(1 g/kg)。然后将静脉管由右颈插入右心室(RV)内,详细观察SD大鼠RV收缩压(RVSP)、心率(HR)和右心室内压力最大/最小上升速率(RV±dp/dtmax),后经左颈总动脉插管记录平均体循环动脉压(mSAP)。
1. 4 RVMI的测算将静脉管插入RV之后,立即打开大鼠胸腔,对心脏进行解剖,顺着心房交叉端切掉两心房与大动脉,然后将左右心室与室间隔(LV+S)逐一分离出来,并吸干表层水分,测净重,可通过公式RVMI=RV/(LV+S)计算得出。
1. 5心室肌组织形态学测算将麻醉后的SD大鼠解剖,拿出心脏,将周边的血管、脂肪层、心包膜等组织剪去,并吸干表层水分,将RV心肌接近心尖的一端切割出来,放在4%甲醛溶液内浸泡,然后选用普通石蜡进行埋藏,通过HE染色心肌组织,进行切片处理,之后用光镜来观察心室肌病理组织的变化。
1. 6 R-T PCR分析TRPC1/3/4/5/6/7 mRNA的表达取出净重是0. 1 g的左/右心室组织置于液氮内磨成粉末状,然后取出TRIzol试剂来筛选出总RNA量,用紫外分光光度法测算,得出RNA的浓度和纯度。根据Takara逆转录试剂盒的说明步骤来做RT-PCR。其内参考标准选定β-actin,并对PCR进行实时定量,设计10 μl PCR反应系统: PCR正义链引物、ROX、PCR反义链引物、cDNA和H2O的体积各是0. 3 μl、5 μl、0. 3 μl、0. 25 μl和4. 15 μl,从而实现PCR的扩增,此反应包括两个步骤:①预变性:放置在95℃环境下约为10 min(1个循环);②变性、降火、延展放置在95℃环境下约为30 s,放置在60℃环境下约为1 min(40个循环)。引物序列见表1。
1. 7 Western印迹分析TRPC1、TRPC6蛋白的表达将右心室心肌组织置于液氮内磨成粉末状,用RIPA溶液进行细胞裂解,从而筛选出总蛋白,通过BCA方法计算其浓度,然后选用40 μg总蛋白做Western印迹。设定电泳液是12. 5%,之后进行转膜印迹,实现和膜抗原融合,其抗体共有3个,即兔抗大鼠TRPC1抗体、小鼠抗大鼠β-actin抗体与兔抗大鼠TRPC6抗体,再将辣根过氧化物酶(HRP)耦联的二抗与此抗体进行结合发生联合反应,然后经化学发光试剂Novex EC来测算,再将压片曝光,然后实现显影与定影。最后绘制Phoretix ID图来研究相关蛋白的表达水平。
1. 8统计学方法采用Origin 6. 1软件进行单因素方差分析。

表1 β-actin和TRPC亚家族的mRNA引物
2 结果
2. 1 RV血流动力学与心室肥厚的情况与CON组比较: CH组、MCT组RVSP、RV+dp/dtmax、RVMI显著升高,RV-dp/dtmax显著下降(P<0. 01),且MCT组较CON组升高程度更为显著,3组间mSAP差异无统计学意义(P>0. 05),见表2。与CON组RVMI(28. 20±4. 39)比较,CH组和MCT组RVMI均明显增高〔(37. 59±4. 80)、(51. 06±9. 62),P<0. 01〕,说明在CH环境下生存3 w能够让SD大鼠出现右心室肥厚,且明显提高RVSP;由此可以看出CH组和MCT组都能够让大鼠出现右心室肥厚,同时提高RVSP。

表2 右心室血流动力学参数比较(x ±s,n=24)
2. 2病理组织形态变化对比图1可见,经过HE染色之后,通过光镜观察CON组大鼠心肌细胞排列规则,胞核界限分明。CH组和MCT组大鼠心肌细胞纤维层变厚,肌原纤维量提升,心肌纤维排序杂乱,胞核颜色加重、外形不规则,且MCT组心肌纤维、细胞核的排列更为紊乱,心肌细胞增生更明显。
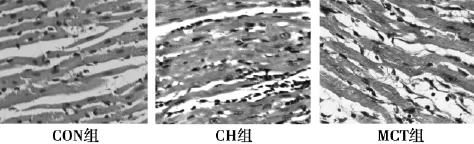
图1 各组大鼠右心室心肌组织病理切片(HE,×400)
2. 3 CH及MCT诱导3 w对右心室心肌组织TRPC亚家族mRNA表达的影响CH组右心室心肌细胞上TRPC1 mRNA相对表达显著升高(P<0. 05,n = 6); MCT组右心室心肌细胞上TRPC6 mRNA相对表达显著升高(P<0. 05),见表3。
2. 4在CH环境下及MCT诱导生存3 w对右心室心肌组织TRPC1蛋白表达的影响CH组大鼠右心室TRPC1蛋白表达明显增强,其变化幅度是由(1. 00±0. 62)增加到(2. 02±0. 47)(P<0. 05,n = 4);见图2,而TRPC6蛋白表达的变化幅度由(1. 00±0. 46)至(2. 90±0. 32)(P<0. 05,n=4),见图3。
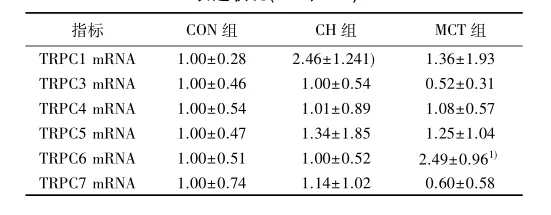
表3 各组大鼠右心室TRPC亚家族mRNA相对表达状况(x±s,n=6)
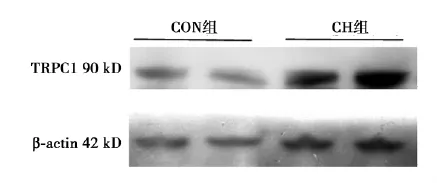
图2 Western印迹法检测TRPC1蛋白在各组大鼠右心室心肌组织的表达

图3 Western印迹法检测TRPC6蛋白在各组大鼠右心室心肌组织的表达
3 讨论
CH及MCT诱导右心室心肌肥厚的机制为:基于应激原因的考虑,在CH环境下能够对身体的各项组织及器官的发育带来影响,尤其是会直接影响到心血管系统的代谢及发育。血管内皮细胞损伤是CH引起的首要副作用,除此以外,多种缩血管的物质释放会引起血管阻力增加,并且,氧浓度弱的情况下还会提高内皮素(ET)-1,5-HT等收缩血管因子的活性,致使肺动脉出现痉挛和肌细胞增生,致使肺动脉狭窄〔3〕。肺循环阻力增加时,右心发挥其代偿功能从而发生右心室肥大。而MCT诱导3 w的方法其实是参考了Tofovic等〔4〕的实验原理,通过此分析可以看出MCT给药后大鼠的心肌肥厚模型可以模拟人类肺心病的发病过程。MCT属双稠吡咯啶生物碱,该物质可在肝脏内代谢转化为有活性的野百合碱吡咯,特异性地使得肺动脉内皮细胞损伤,增加收缩血管因子有: ET、血小板源性生长因子(PDGF)、碱性成纤维细胞生长因子(bFGF)等含量的增加,以此造成肺动脉血管收缩变细,导致凋零的内皮细胞瞬间激活内外源性凝血路径,以此出现脑血栓,从而导致病情更为复杂〔5〕。本实验选择的两组造模方式最为合理,其重复性控制得当。
研究发现在TRPC亚家族成员可以在大鼠心肌细胞里实现显著表达,TRPC亚家族与心肌肥厚的发生具有相关性,尤其是TRPC1、TRPC3和TRPC6通道在心肌肥厚中扮演了重要的角色〔6〕。在大鼠心肌细胞上TRPC3基因的表达量最多,TRPC1 与TRPC6紧随其后〔7〕。Seth等〔8〕发现TRPC1基因敲除、Onohara等〔9〕发现TRPC3基因沉默或TRPC6基因沉默都可阻碍心肌肥厚的出现,Vindis等〔10〕研究得出由5-HT给药的大鼠心肌肥厚的心肌细胞里的TRPC1表达有了明显地提升,不过通过siRNA能明显减弱TRPC1蛋白的表达,同时也可以避免活化T细胞核因子(NFAT)的再生,以此可以有效地控制经5-HT给药出现的心肌肥厚。Kinoshita等〔11〕通过实验得出GC-A基因断裂以后,实验小鼠体内没有了GC-A对TRPC6的阻碍,那么会导致心肌细胞中CaN/NFAT信号路径被打开,以此造成心肌肥厚的出现。本实验模型与之完全不同,它研究的是在CH环境下及经MCT给药大鼠心肌肥厚模型,从而明确了TPRC1与TPRC6蛋白基因表达的提升或许和心肌肥厚有密切的联系。
4参考文献
1张昌琳,乔树宾. Apelin-APJ系统在心肌肥厚发生发展过程中作用的研究进展〔J〕.中国循环杂志,2015; 30(3): 398-400.
2 Ohba T,Watanabe H,Murakami M,et al.Upregulation of TRPC1 in the development of cardiac hypertrophy〔J〕.Mol Cell Cardiol,2007; 42(4): 498-507.
3 Vieillard BA,Frisdal E,Eddahibi S,et al.Inhibition of matrix metalloprot einases by lung TIMP-1 gene transfer or doxycycline aggravates pulmonary hypertension in rats〔J〕.Circ Res,2000; 87(5): 418-25.
4 Tofovic SP,Zhang X,Zhu H,et al.2-Ethoxyestradiol is antimitogenic and attenuates monocrotaline-induced pulmonary hypertension and vascular remodeling〔J〕.Vasc Pharmacol,2008; 48(4-6): 174-83.
5 Oh JK,Appleton CP,Hatle LK,et al.The noninvasive assessment of left ventricular diastolic function with two-dimensional and Doppler echocardiography〔J〕.Am Soc Echocardiogr,1997; 10(3): 246-70.
6 Nakayama H,Wilkin BJ,Bodi I,et al.Calcineurin-dependent cardiomyopathy is activated by TRPC in the adult mouse heart〔J〕.FASEB J,2006; 20(10): 1660-70.
7 Hiroyuki W,Kenji I.Possible involvement of TRPChannels in cardiac hypertrophy and arrythmia〔J〕.Curr Top Med Chem,2013; 13(3): 283-94.
8 Seth M,Zhang ZS,Mao L,et al.TRPC1 channels are critical for hypertrophic signaling in the heart〔J〕.Circ Res,2009; 105(10): 1023-30.
9 Onohara N,Nishida M,Inoue R,et al.TRPC3 and TRPC6 are essential for angiotensinⅡ-induced cardiac hypertrophy〔J〕.EMBO J,2006; 25(22): 5305-16.
10 Vindis C,DAngelo R,Mucher E,et al.Essential role of TRPC1 channels in cardiomyopathy hypertrophy mediated by 5-HT2A serotonin receptors 〔J〕.Biochem Biophys Res Commun,2010; 391(1): 979-83.
11 Kinoshita H,Kuwahara K.Inhibition of TRPC6 channel activity contributes to the antihypertrophic effects of natriuretic peptides-guanylyl Cyclase-A signaling in the heart〔J〕.Circ Res,2010; 106(12): 1849-60.
〔2014-09-18修回〕
(编辑赵慧玲/曹梦园)
基金项目:福建省教育厅课题(JA15717);泉州市科技计划项目(2015Z98)
〔文章编号〕1005-9202(2015)20-5725-03;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 019
〔文献标识码〕A
〔中图分类号〕R363
第一作者:陈慧勤(1982-),女,讲师,硕士,主要从事心血管病研究。
