生物蛋白胶-牙髓干细胞构建三维支架的生物相容性
2015-12-15胡红梅曾常爱陈彩芬井冈山大学医学院组胚教研室江西吉安343000
胡红梅 曾常爱 陈彩芬 李 伟(井冈山大学医学院组胚教研室,江西 吉安 343000)
生物蛋白胶-牙髓干细胞构建三维支架的生物相容性
胡红梅曾常爱陈彩芬李伟1(井冈山大学医学院组胚教研室,江西吉安343000)
〔摘要〕目的构建牙髓干细胞-生物蛋白胶支架的三维培养体系,研究牙髓干细胞在生物蛋白胶中的生物相容性。方法体外复苏牙髓干细胞并复合进入生物蛋白胶中培养,通过CCK-8检测提取液对细胞增长情况的影响,并通过细胞的矿化情况进一步分析生物蛋白胶的生物特性。结果冻存的牙髓干细胞经免疫荧光染色具备干细胞的特性,细胞包埋于生物蛋白胶内可见三维培养下细胞状态更加伸展,更加模拟自然生长,细胞形态典型,2 w后生物蛋白胶可完全降解,牙髓干细胞矿化诱导结果较典型。结论生物蛋白胶是一种适宜的组织工程牙髓种子细胞载体。
〔关键词〕生物蛋白胶;牙髓干细胞;生物相容性
1井冈山大学临床医学院口腔系
第一作者:胡红梅(1976-),女,硕士,副教授,主要从事干细胞的分化与增殖研究。
牙髓干细胞(DPSC)是具有克隆形成能力、高增殖率的重要成体干细胞,与支架材料构建培养可以形成牙髓牙本质复合体样结构组织〔1〕。目前的牙髓干细胞支架材料存在细胞界面关系容易丧失、载体材料细胞丢失严重以及载体材料不易分解的缺点〔2〕。生物蛋白胶具有良好的生物相容性,且具有形态可控性和可注射性,作为骨髓间充质干细胞的载体,在体内已成功构建组织工程软骨,但是将其用于牙髓组织工程研究甚少。本课题分析种子细胞DPSC与生物蛋白胶支架构建后的生物学特征,以确定适宜的组织工程牙髓种子细胞载体。
1 材料和方法
1. 1主要试剂与仪器DMEM高糖型培养基(GIBCO/HYCLONE,USA),胎牛血清(GIBCO,USA),胰蛋白酶、地塞米松(sigma,USA),DMSO、L-抗坏血酸(Amesco,USA),免疫组织化学试剂盒(DAKO,USA),SABC试剂盒、兔抗人STRO-1单克隆抗体、抗CD34、抗CD45和抗CD146多克隆抗体(博士德试剂公司,武汉),0. 22 μm、0. 45 μm混合纤维素滤膜(BM,德国),生物蛋白胶(普济医药技术开发有限公司,杭州),生物安全柜(上海博讯实业有限公司),荧光倒置显微镜倒置相差显微镜及照相系统(Olympus,Japan),千分之一电子天平(GB303 Mettler-Toledo Instr. Ltd),细胞培养箱(Shellab,美国),微型高速冷冻离心机(Eppendorf,德国),高速台式离心机(Beckman,美国),ND-1000微量核酸定量仪(Thermo,美国),分选型流式细胞仪(Beckman,美国)、激光共聚焦扫描显微镜(zeiss,德国)。
1. 2细胞复苏前期的实验已经培养成功并保存的牙髓干细胞复苏后接种到细胞培养瓶中,37℃、饱和湿度、5%CO2培养箱,24 h后更换一次培养液,待培养液变成黄色后再更换培养液,继续培养。
1. 3 DPSC免疫荧光细胞化学染色鉴定取第四代的牙髓干细胞以2×104个细胞/cm2的密度种于细胞爬片上,然后在DMEM高糖型细胞培养液中37℃恒温培养箱培养12 h,移除培养液,PBS缓冲液清洗两次共10 min,吸干标本周围液体,4%多聚甲醛固定15 min。按照SABC试剂盒的说明免疫组织化学染色STRO-1、CD146、CD34、CD45。在加入Ⅰ抗4℃孵育过夜后加入FITC荧光二抗(1∶40),避光条件下孵育1 h,然后利用DAPI荧光染料对细胞核进行染色,荧光显微镜拍照。
1. 4 DPSC-生物蛋白胶支架的构建待取细胞培养瓶中已经长满90%后,用0. 25%胰蛋白酶进行消化传代,收集细胞并进行细胞计数板计数,大约5×106个第3代DPSC添加到500 μl生物蛋白胶A液(纤维蛋白原浓缩液及其溶解液)中,然后在6孔培养板中将混合有A液的细胞混悬液与生物蛋白胶B液(凝血酶及钙离子溶液)充分混合,5%CO2培养箱培养,并在倒置显微镜下观察生物蛋白胶中DPSC的生长情况及支架降解情况,待培养液变成黄色后再更换培养液,继续培养。
1. 5 DPSC在生物蛋白胶支架中的矿化诱导将混合有生物蛋白胶的细胞培养瓶中浓度2×103/ml的DPSC接种于96孔板内,对照组仅含有普通培养基,两组同时培养1 w后,分别进行传代培养。以2×103/ml细胞/孔接种于24孔板,待细胞汇合至90%以上时每孔分别加入矿化诱导液(10%FBS,50 ng/ml维生素C,10 mmol/ml β-甘油磷酸钠和2 ng/ml地塞米松),每3 d换液,孵育4 w,4%多聚甲醛固定30 min后,茜素红染色法鉴定矿化结节,PBS洗去多余茜素红,再给孔内加入PBS液,镜下观察矿化结节的染色形成情况。
1. 6统计学分析计量资料组间比较行t检验。
2 结果
2. 1 DPSC免疫荧光细胞化学染色鉴定由于本次所用的细胞是前期实验冻存在冰箱的DPSC,因此本次实验仅作免疫荧光细胞化学染色鉴定。鉴定结果显示DPSC抗STRO-1阳性,细胞质呈绿色的荧光染色,利用紫外光波长的光线激发DAPI染色细胞核为蓝色(图1);抗CD146染色显示细胞质为红色,DAPI染色细胞核为蓝色,表达为阳性;通过荧光共聚焦图片merge三维显示,上述标志物在DPSC细胞内表达,他们在细胞内定位在细胞质,与细胞核没有重合,表达的改变是同步的;抗CD34染色显示细胞质无荧光染色,DAPI染色细胞核为蓝色; 抗CD45染色显示细胞质无荧光染色,DAPI染色细胞核为蓝色,通过荧光共聚焦图片merge三维显示,上述标记物在DPSC细胞内表达阴性,仅细胞核染色(图2)。

图1 CD146和STRO-1免疫荧光共聚焦图片显示阳性(×400)

图2 CD34和CD45免疫荧光共聚焦图片显示阴性(×400)
2. 2 DPSC在生物蛋白胶支架中生长的生物相容性检测DPSC复合生物蛋白胶后在倒置相差显微镜下显示,凝胶呈半透明状,可见三维培养下细胞状态更加伸展,更加模拟自然生长(图3),细胞状态良好,细胞培养液消耗比对照组的培养液加快,培养液的更换频率较对照组提前2~3 d。体外培养的成人牙髓干细胞在生物蛋白胶提取液条件下培养5 d,表明普通组与生物蛋白胶组无差别(P<0. 05),见图4。
2. 3 DPSC在生物蛋白胶支架中生长的矿化能力鉴定DPSC在生物蛋白胶支架中生长2 w后,加入牙本质分化诱导液培养后,细胞的形态逐渐由长梭形变成立方状,部分细胞形成交叠折叠呈网状和细胞团块状,在连续培养2 w后,出现类似白色的小结节,行茜素红染色,结节呈现红色染色(图5),细胞结节中央颜色呈红色,周围较变浅。
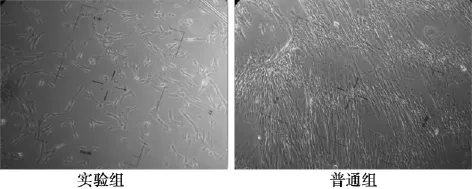
图3 牙髓干细胞光镜下形态(×100)
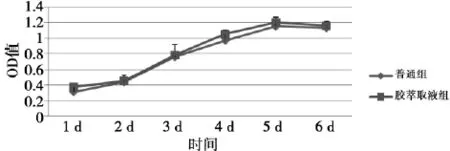
图4 生物蛋白胶生物相容性检测

图5 牙髓干细胞矿化诱导(×400)
3 讨论
近年来将转染的DPSC作为种子细胞体外加载到生物材料支架载体上在或体外培养,并种植到缺损区域以修复缺损的牙髓组织已成为了牙髓组织工程研究热点之一〔3〕。目前的DPSC支架包括聚羟基乙酸(PGA)、左旋聚乳酸(PLLA)和羟基磷灰石/磷酸三钙(HA/TCP),在进行牙髓组织工程研究中,都存在与生物支架材料的不适应,细胞界面关系丧失导致载体材料细胞丢失严重,且耗时较长,形成的牙髓牙本质样结构少且不典型结构多,载体材料不易分解的缺点〔4,5〕。生物蛋白胶含有纤维蛋白原浓缩液、凝血酶及钙离子溶液,具有良好的生物相容性,稳定性,可降解性,并能促进细胞分化,国内外学者成功地将生物蛋白胶作为骨髓间充质干细胞的载体,在体内成功构建组织工程软骨,为临床提供了一种良好的组织工程支架材料。本课题组研究发现DPSC-生物蛋白胶支架中DPSC的生长相比单纯培养液组更加典型,并且体外培养的成人牙髓干细胞在生物蛋白胶提取液条件下发现生物蛋白胶有很好的生物相容性,究其原因可能是由于生物蛋白胶是多空隙三维结构,能保证营养物质和代谢产物进出支架内外,通过倒置相差显微镜、激光共聚焦荧光显微镜等观察,证实DPSC在生物蛋白胶中能够很好地吸取营养并生长,细胞的数量更多及形态更典型,因此,我们认为生物蛋白胶是一种适宜的组织工程牙髓种子细胞载体。由于细胞与生物蛋白胶是在液态的情况下混合,并且聚合后细胞可被均匀包埋在固态的纤维蛋白网内,减少了种子细胞的丢失,而且三维网状结构提供了较大的接触面积和细胞生理活性面积,因此DPSC可以很好地分化〔6,7〕。
4参考文献
1 Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo〔J〕.Proc Natl Acad Sci USA,2000; 97(25): 13625-30.
2 Chung H,Yamaza T,Zhao H,et al.Stem Cell property of postmigratory cranial neural crest cells and their utility in alveolar bone regeneration and tooth development〔J〕.Stem Cells,2009; 27(4): 866-77.
3 Karaöz E,Demircan PC,Saˇglam O,et al.Human dental pulp stem cells demonstrate better neural and epithelial stem cell properties than bone marrow-derived mesenchymal stem cells〔J〕.Histochem Cell Biol J,2011; 136(4): 455-73.
4王亦菁,张晓东,李里,等.三维培养的牙髓干细胞参与牙髓损伤修复能力的实验研究〔J〕.临床口腔医学杂志,2011; 27(10): 582-4.
5李艳萍,梁鹏,董海波,等.人牙髓干细胞在聚乳酸-聚乙醇酸共聚物支架上粘附与增殖的研究〔J〕.口腔医学研究,2011; 27(12): 1083-6.
6张巍巍,李艳萍,潘爽,等.模拟微重力对人牙髓干细胞-PLGA复合物矿化的影响〔J〕.口腔医学研究,2013; 29(2): 135-7.
7张萍,朱聪惠,张纲,等.人牙髓干细胞向成牙本质细胞定向分化过程中miRNAs表达谱筛选及鉴定〔J〕.实用口腔医学杂志,2011; 27(2): 212-6.
〔2014-12-03修回〕
(编辑李相军)
The study of biocompatibility on build three-dimensional scaffold of dental pulp stem cells with biological fibrin glue in vitro
HU Hong-Mei,ZENG Chang-Ai,CHEN Cai-Fen,et al.
Histology and Embryology Department of Medical College,Jinggangshan University,Ji'an 343000,Jiangxi,China
【Abstract】Objective To build the three-dimensional cultivation system of dental pulp stem cells with biological fibrin glue bracket,study the compatibility of dental pulp stem cells in biological fibrin glue,explore the feasibility of the biological fibrin glue in the dental pulp tissue engineering scaffold.Methods The dental pulp stem cells were recovered in vitro and identificated by immunofluorescence staining,and cultivated in biological fibrin glue,the effect of cell growth was detected by CCK 8,the characteristics of the biological fibrin glue was analyzed through mineralization changes of the cells.Results Dental pulp stem cells in frozen storage had the characteristics of stem cells by immunofluorescence staining,cell state was more stretch,more simulated natural growth and more the typical forms in embedding in biological fibrin glue,the biological fibrin glue had completely degradations after 2 weeks,induced mineralization results of dental pulp stem cells.Conclusions Biological fibrin glue is a suitable carrier of dental pulp tissue engineering seed cells.
【Key words】Biological fibrin glue; Dental pulp stem cells; Compatibility
通讯作者:李伟(1972-),男,硕士,副教授,主要从事牙体牙髓疾病的病因及治疗研究。
基金项目:国家自然科学基金资助项目(81341109)
〔文章编号〕1005-9202(2015)20-5712-03;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 013
〔文献标识码〕A
〔中图分类号〕R781
