JAK2-STAT3信号通路在大鼠脑出血模型中的作用
2015-12-15王绪常张振兴宋晓峰李树玲周青青辽宁医学院辽宁锦州200
王绪常 张振兴宋晓峰 李树玲 周青青 (辽宁医学院,辽宁 锦州 200)
JAK2-STAT3信号通路在大鼠脑出血模型中的作用
王绪常张振兴1宋晓峰李树玲周青青(辽宁医学院,辽宁锦州121001)
〔摘要〕目的探讨大鼠脑出血后JAK2-STAT3信号通路的作用机制及与脑水肿的关系。方法健康雄性SD大鼠108只,经尾动脉取血缓慢注射到尾状核区制作大鼠脑出血模型。根据出血时间不同,采用随机数字表法将其分为3 h、9 h、1 d、3 d、5 d和7 d 6组,每个组又分为3个亚组:模型组、假手术组和AG490组。采用免疫组织化学和Western印迹检测JAK2、p-JAK2、STAT3和p-STAT3的表达,并测定脑组织含水量。结果与假手术组和AG490组相比,模型组中p-JAK2和p-STAT3大量表达,并于24 h时达到高峰;与模型组相比,AG490组大鼠脑组织含水量在各时间点均较低。结论脑出血后能够激活JAK2-STAT3信号通路,并导致脑组织水肿。
〔关键词〕JAK2; STAT3;脑出血
1辽宁医学院附属第一医院
第一作者:王绪常(1988-),男,在读硕士,主要从事脑血管疾病的基础和临床研究。
JAK2-STAT3信号通路是近年新发现的一条细胞内信号转导途径,与抑制炎性反应、肿瘤、神经病理性疼痛、神经退行性变及脑缺血等中枢神经系统疾病的病理生理过程密切相关〔1~5〕。但该系统在脑出血中表达变化尚未明确。本实验通过制作脑出血模型初步了解JAK2/STAT3信号通路的动态变化,探讨其作用机制。
1 材料与方法
1. 1材料JAK2抗体,p-JAK2抗体,STAT3抗体,p-STAT3抗体,二抗(Santa Cruz公司); DW-2000立体定向仪(成都泰盟科技有限公司);微量进样器(上海高鸽工贸有限公司);钻孔机(郑州市一美牙科工业有限公司);电子天平(Denver Instrument Company A-200型,DS美国);切片机;电泳系统(北京六一公司);手术器械包;消毒液?等。
1. 2方法
1. 2. 1实验动物与分组健康雄性SD大鼠108只,体质量250~300 g,许可证号: SCXK(辽)2010-0001,由辽宁长生生物技术有限公司提供。室温25℃左右,正常饲料喂养,自由摄水和食物,每日更换垫料。根据出血时间的不同,按照随机数字表法分为6组(n=18): 3、9 h、1、3、5、7 d组。每组中又按照随机数字表法随机分为3个亚组:①模型组(M组);②假手术组(S 组);③AG490组(AG组),每组6只。每组中3只用来做免疫组化检测,3只用来做蛋白印迹检测。M组:刺破尾动脉取得动脉血,缓慢注射到尾状核区制作出脑出血模型。S组:除了脑内不注入动脉血液外,其他操作与模型组相同。AG组:造模前10 min静脉注射JAK2特异性抑制剂AG490(3 mg/kg)。处死大鼠后取得脑组织标本,测量其含水量;应用免疫组织化学和Western印迹方法检测JAK2、p-JAK2、STAT3和p-STAT3蛋白表达。
1. 2. 2大鼠脑出血模型的制作10%水合氯醛300 mg/kg腹腔麻醉,俯卧位固定在成都泰盟DW-2000立体定向仪上,使门齿钩平面比耳间线平面低2. 4 mm〔6〕。剪去头部背侧鼠毛,皮肤消毒,正中切开皮肤,长约15 mm,3%双氧水腐蚀骨膜(用刀片刮去骨膜),暴露前后囟门及冠状缝,于冠状缝前0. 2 mm,中线右侧旁开3 mm处钻一直径约1 mm的小孔,不伤及硬脑膜〔7〕。将大鼠腹部翻转,于鼠尾根部腹侧正中消毒后做一2~3 mm切口,使用玻璃分针扩大至1 cm切口,分离暴露尾动脉并剪断,待血液流出后,弃去第一滴血液,用微量进样器吸取60 μl血液,将其固定于立体定向仪上,调整滑杆,沿钻孔方向垂直进针,深度6 mm为注射点(尾状核)。先缓慢注射10 μl,停针约2 min(此期间可加压包扎好尾动脉),然后缓慢匀速(10~17 μl/min,针芯旋转推注)注射剩余血液,注射时间约3~5 min,注射后留针20 min,骨蜡封住颅孔,缝合皮肤切口并消毒,预防局部感染。
1. 2. 3大鼠神经学评分〔8〕神经症状观察参照Longa 5级评分法,在大鼠处死前进行神经功能缺损评分。
1. 2. 4标本的采集各组大鼠在3、9 h、1、3、5、7 d相应时间点处死。处死前经腹注射10%水合氯醛。待麻醉后,将大鼠固定在实验架上,迅速开胸,充分暴露出心脏,经左心室插入吊针针头至升主动脉;右心耳处剪一缺口,将250 ml生理盐水进行全速灌注,再用4%多聚甲醛250 ml进行灌注,待肝脾发硬,立即断头取脑。取得标本处理后继续于4%多聚甲醛中固定24 h,脱水、包埋,连续冠状位切片,恒温切片机连续切片,片厚5 μm,行免疫组化检测; JAK2、p-JAK2、STAT3和p-STAT3染色结果的判定使用二级计分法计数阳性细胞,在装有目镜网格测微尺的光学显微镜200倍视野下随机选取5个视野,计数500个细胞,根据阳性细胞比例及阳性着色强度,按Shimizu等〔9〕采用的评分标准进行:以阳性细胞数<5%、5%~24%、25%~50%、51%~74%及≥75%,分别判定为0、1、2、3、4分;每张切片阳性细胞的着色强度按无着色、淡黄色、棕黄色和棕褐色分别判定为0、1、2、3分;根据两项积分之和判定结果,0分为阴性(-),1分~2分为弱阳性(+),3分~5分为中等阳性(),6分~7分为强阳性()。3只用来做Western印迹检测,大鼠直接处死,迅速断头取脑,留取右侧损伤脑组织,放入-80℃冰箱中冻存。
1. 2. 5脑组织含水量的测定取右侧大脑进针处前、后0. 6 cm的脑组织,使用滤纸吸尽其表面水分,置于锡箔纸上,放在电子天平上秤出湿重,置入110℃恒温烘箱内烤48 h后秤其干重,计算脑组织的含水量:大鼠脑组织含水量=(大鼠脑组织湿重-大鼠脑组织干重)/大鼠脑组织湿重×100%。
1. 2. 6 Western印迹检测组织块破碎后(冰上操作),加入RIPA裂解液匀浆处理,煮沸变性留取上清液待用。配制8%分离胶和4%浓缩胶,取样品上样,进行SDS-PAGE电泳。恒流0. 11~0. 2A,转移2~4 h,电转完成后,将PVDF膜上含有蛋白Marker的条带切下,于丽春红S染液中进行反应,10~20 min,5%脱脂牛奶室温封闭1 h。抗体4℃过夜。弃掉第一抗体溶液,TBST漂洗转印膜,15 min×4次,加入二抗,作用1 h。免疫反应条带用化学发光系统进行检测,测定磷酸化JAK2、STAT3和总JAK2、STAT3蛋白的表达水平,X线进行照相记录,β-actin作为内参照。用Quantity One软件测蛋白条带积分灰度值,以各组蛋白表达量与β-actin内参照的比值进行半定量分析。
1. 3统计学方法采用SPSS16. 0软件进行方差分析、单因素方差分析。
2 结果
2. 1大鼠脑组织含水量S组中大鼠右侧脑组织标本含水量为(71. 15±0. 02)%;与S组相比,M组中大鼠右侧脑组织标本含水量明显增高(P<0. 05),3 d时达到高峰,直到7 d含水量仍然较高(P>0. 05);与M组相比,AG组中大鼠右侧脑组织标本中含水量明显减少(P<0. 05)(表1)。

表1 各组大鼠中脑组织标本含水量测定结果(%,x±s,n=6)
2. 2免疫组织化学检测各组中JAK2、STAT3蛋白均为阳性表达,表达于细胞质和细胞核中(图1、图2),阳性细胞计数的差别无统计学意义(P>0. 05); S组和AG组中p-JAK2、p-STAT3蛋白表达为阴性或弱阳性; M组中p-JAK2、p-STAT3蛋白为阳性表达,p-JAK2主要表达于细胞质,p-STAT3主要表达于细胞核,胞质少量表达(图3),且p-JAK2和p-STAT3蛋白在24 h呈强阳性表达,阳性细胞计数最多(图4)。

图1 大鼠JAK2免疫组化结果
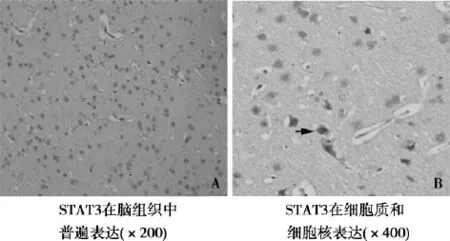
图2 大鼠STAT3免疫组化结果
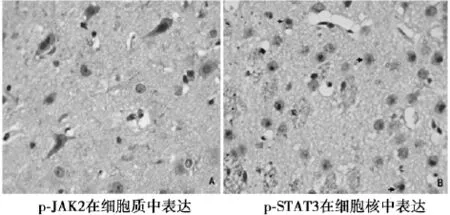
图3 大鼠p-JAK2和p-STAT3免疫组化结果(×400)

图4 24 h p-JAK2和p-STAT3免疫组化结果(×200)
2. 3 Western印迹检测S组、AG组和M组JAK2蛋白水平相当(图5);并且随着时间的推移,其表达量也较恒定。S组、AG组和M组STAT3蛋白水平相当(图6),且表达量随时间推移变化不显著。
S组和AG组中大鼠脑组织p-JAK2和p-STAT3均表达为阴性,M组p-JAK2蛋白呈阳性表达,于1 d后蛋白表达量最大,与p-STAT3蛋白表达量存在一致性(图7,表2)。

表2 M组大鼠脑组织p-JAK2、p-STAT3表达水平比较(x±s)
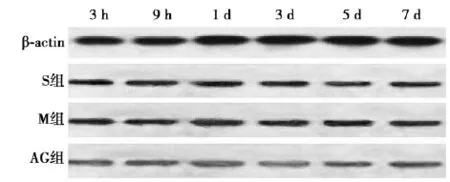
图5 各组AG组中大鼠脑组织JAK2蛋白表达情况
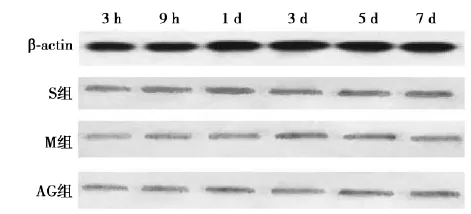
图6 各组大鼠脑组织STAT3蛋白表达情况
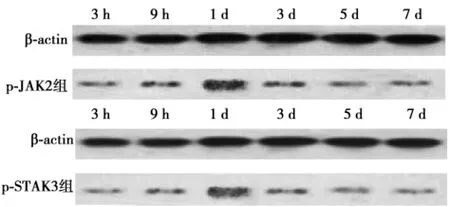
图7 M组大鼠脑组织p-JAK2、p-STAT3蛋白表达
3 讨论
JAKs/STATs是近年来发现的由细胞外到细胞内起作用的信号转导通路,该通路包括JAK蛋白家族和STAT蛋白家族。JAK蛋白家族包括JAK1、JAK2、JAK3和Tyk2 4个成员,STAT蛋白家族成员在哺乳动物中已被克隆出的有以下7种: STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b和STAT6,并且JAK是STAT上游的共有激酶〔10〕。目前研究认为该信号通路的作用途径大致为:胞外可溶性信号分子(炎性因子、细胞因子、生长因子)能够识别膜上的特异性受体,并与之结合,随之信号分子与特异性受体结合发生二聚化,并能相互磷酸化,在细胞质内形成对JAKs蛋白具有高亲和性的结合位点; JAKs蛋白与结合位点融合一起后,诱使酪氨酸磷酸化而活化,活化后的JAKs蛋白在细胞质内募集信号分子并识别STATs家族蛋白中的SH2功能结构域,诱使STAT蛋白磷酸化而活化;活化后的STATs家族蛋白之间可彼此形成同源或异源性二聚体并定向移动到细胞核内,与靶基因上游的启动子相结合,进而直接激活靶基因,使其得以活化而表达,完成特异性信号分子受体介导的信号传导过程,表达相应的生物学效应。目前已知有多种细胞因子(如IFN、IL-4、IL-6)和生长因子(如ECF、CSF、EPO)能够通过活化JAK-STAT信号转导途径来进行转导,不同的受体亚家族可分别通过特定的JAK和STAT蛋白分子进行信号转导,该途径已成为信号分子完成信息转导的一条重要通道〔11〕。已有研究表明氧化应激反应也能激活JAK-STAT信号通路〔12〕。
近年来的研究发现JAK-STAT信号转导通路不仅广泛参与细胞应激反应、增殖分化、生长及凋亡,而且可能与炎症、缺血等中枢神经疾病紧密相关,更重要的是可参与介导多种病理过程中炎症反应和免疫反应的发生〔13〕。因此国内外的研究学者对以此信号转导通路作为靶途径研究进而研发出新型的靶向治疗方法产生了极其浓厚的兴趣〔14,15〕。研究还发现,JAK2-STAT3通路是一条细胞因子对机体免疫反应、神经系统和胚胎组织发育的调节以及细胞分裂、分化和凋亡等具有多重效应的信号转导通路。那么JAK2/STAT3通路作为重要的细胞外到细胞内信号分子起作用的传导通路,广泛参与了细胞应激、分裂、生长、分化和调亡等多种生物学效应,并可被细胞外多种因子(炎性因子、生长因子等)和环境应激等激活,进而介导细胞分裂、分化以及增殖、凋亡等信号的转导。然而它是否参与调控脑出血后周围组织损伤过程,而阻断此信号通路又有何影响,如何发生变化,对这些问题国内、外尚未见研究报道。
给予AG490干预后,大鼠脑组织含水量减少,提示脑水肿较轻,且p-JAK2和p-STAT3的表达也被抑制,对脑组织应有一定保护作用。可能是由于AG490抑制剂阻断了JAK2-STAT3这一信号通路后所起的作用,据此可以推测JAK2-STAT3信号转导通路参与了脑出血后周围组织的损伤过程,并导致脑组织水肿。AG490作为一种JAK2特异性抑制剂,在很多研究实验中都被应用。已有研究表明,在应用AG490这种JAK2抑制剂后,能明显抑制脑组织损伤后p-JAK2、p-STAT3蛋白的表达,减轻大脑神经细胞损伤,改善神经组织功能缺损〔16〕,并与邓必高等〔17〕研究结果相一致。p-JAK2和p-STAT3表达水平的降低,能减轻脑水肿,在一定程度上发挥脑保护作用。
本实验结果显示大鼠脑出血后周围损伤脑组织中p-JAK2、p-STAT3表达含量随时间推移逐渐增多,提示可能是由于应激或内环境的变化导致了JAK2-STAT3信号通路的激活,进而参与脑出血后周围组织损伤的病理生理变化。由于应用JAK2蛋白抑制剂后,脑组织水肿有所减轻,并且p-JAK2和p-STAT3蛋白含量减少,提示可能是由于JAK2和STAT3的磷酸化引发脑组织水肿,但具体作用机制尚不清楚,有待于进一步研究。
4参考文献
1 Saravavanan S,HairulⅣ,Prakash BN,et al.Swertiamarin attenuates inflammation mediators via modulating NF-κB/ⅠκB and JAK2/STAT3 transcription factors in adjuvant induced arthritis〔J〕.Eur J Pharm Sci,2014; 56: 70-86.
2 Stechishin OD,Luchman HA,Ruan YB,et al.On-target JAK2/STAT3 inhibition slows disease progression in orthotopic xenografts of human glioblastoma brain tumor stem cells〔J〕.Neuro Oncol,2013; 15(2): 198-207.
3 Wang ZF,Li Q,Liu SB,et al.Aspirin-triggered Lipoxin A4 attenuates mechanical allodynia in association with inhibiting spinal JAK2/STAT3 signaling in neuropathic pain in rats〔J〕.Neuroscience,2014; 273: 65-78.
4 Slattery ML,Lundgreen A,Kadlubar SA,et al.JAK/STAT/SOCS-signaling pathway and colon and rectal cancer〔J〕.Mol Carcinog,2013; 52(2): 155-66.
5 Liu XX,Zhang XJ,Zhang J,et al.Diosmin protects against cerebral ischemia/reperfusion injury through activating JAK2/STAT3 signal pathway in mice〔J〕.Neuroscience,2014; 268: 318-27.
6 Paxinos G,Watson CR. The rat brain in stereotaxic coordinates〔M〕.5th ed. New York: Academic Press,2005: 42.
7 Hua Y,Schallert T,Keep RF,et al.Behavioral tests after intracerebral hemorrhage in the rat〔J〕.Stroke,2002; 33(10): 2478-84.
8 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989; 20(1): 84-91.
9 Shimizu M,Saitoh Y,Itoh H. Immunohistochemical staining of Ha-ras oncogene product in normal,benign,and malignant human pancreatic tissues〔J〕.Hum Pathol,1990; 21(6): 607-12.
10薛广才,梁德刚,魏民新,等. miRNA-21与JAK2-STAT3通路在心肌缺血后处理保护心肌中的相互影响〔J〕.天津医药,2013; 41(5): 451-4.
11 Campbell IL. Cytokine-mediated inflammation,tumorigenesis,and disease-associated JAK/STAT/SOCS signaling circuits in the CNS〔J〕.Brain Res Brain Res Rev,2005; 48(2): 166-77.
12 Kuo DY,Chen PN,Hsieh YS. Targeting oxidative stress in the hypothalamus: the effect of transcription factor STAT3 knockdown on endogenous antioxidants-mediated appetite control〔J〕.Arch Toxicol,2015; 89(1): 87-100.
13 Park DW,Lyu JH,Kim JS,et al.Role of JAK2-STAT3 in TLR2-mediated tissue factor expression〔J〕.J Cell Biochem,2013; 114(6): 1315-21.
14 Vijayakrishnan L,Venkataramanan R,Gulati P. Treating inflammation with the janus kinase inhibitor CP-690,550〔J〕.Trends Pharmacol Sci,2011; 32(1): 25-34.
15 Quintas-Cardama A,Kantarjian H,Cortes J,et al.Janus kinase inhibitors for the treatment of myeloproliferative neoplasias and beyond〔J〕.Nat Rev Drug Discov,2011; 10(2): 127-40.
16 Morga E,Mouad-Amazzal L,Felten P,et al.Jagged1 regulates the activation of astrocytes via modulation of NFκB and JAK/STAT/SOCS pathways〔J〕.Glia,2009; 57(16): 1741-53.
17邓必高,但伶,黄燕.异丙酚对大鼠内毒素脑损伤磷酸化JAK2、STAT3表达的影响〔J〕.中国医院药学杂志,2011; 31(22): 1867-70.
〔2015-07-27修回〕
(编辑曲莉)
The mechanisms of JAK2-STAT3 signaling pathway in intracerebral hemorrhage models of rats
WANG Xu-Chang,ZHANG Zhen-Xing,SONG Xiao-Feng,et al.
Liaoning Medical University,Jinzhou 121001,Liaoning,China
【Abstract】Objective To investigate the role and mechanisms of JAK2-STAT3 signaling pathway preliminarily in intracerebral hemorrhage rat model and the relationship between brain edema.Methods 108 healthy male SD rats were used to induce intracerebral hemorrhage models.According to the difference of bleeding time,all rats were randomly divided into six groups.Every group was further divided into three subgroups: model(M),sham(S)and AG490(AG)groups.Both immunohistochemistry and Western blot analysis were used to detect the expressions of JAK2,p-JAK2,STAT3 and p-STAT3.Results Compared with those of sham and AG groups,the protein levels of p-JAK2 and p-STAT3 were significantly increased in M group and peaked at 24 h.Compared with that of model group,the water content of rat brain tissues in AG group were lower than that in M group at every time point.Conclusions The JAK2-STAT3 signaling pathway could be activated in intracerebral hemorrhage rat model and contributes to brain edema.
【Key words】JAK2; STAT3; Intracerebral hemorrhage
通讯作者:张振兴(1974-),男,博士,副主任医师,硕士生导师,主要从事脑血管疾病的基础和临床研究。
基金项目:辽宁省高等学校杰出青年学者成长计划(No.LJQ2013088)
〔文章编号〕1005-9202(2015)20-5708-04;
doi:10. 3969/j. issn. 1005-9202. 2015. 20. 012
〔文献标识码〕A
〔中图分类号〕R743. 34
