基于纳米金表面等离子体的高灵敏过氧化氢光学检测方法
2015-12-14李娜娜黄嘉荣詹求强
李娜娜,黄嘉荣,詹求强
(华南师范大学华南先进光电子研究院,广州510006)
纳米金表面等离子体因其独特的光学、化学性质和良好的生物相容性,近年来被广泛用于光学探针、电化学传感和生物传感等领域[1-2]. 纳米金具有明显的表面等离子体共振吸收峰,其波长与纳米金的粒径、周围的介质、粒子的间距等密切相关,导致纳米金溶胶颜色差异较大[3]. 纳米金比色法则通过纳米金溶液颜色的变化检测微量样品. 在纳米金比色法中,微量的待测样品可改变纳米金颗粒的聚集情况,从而导致溶液产生颜色变化,用肉眼即可分辨.
结合抗体或其他靶向试剂(如蛋白质、多肽和核酸),纳米金比色法被广泛用于金属离子[4-5]、DNA[6-7]、生物酶[8-9]等目标分子的微量检测和分析. 与传统荧光分子相比,纳米金具有很高的消光系数,其检测灵敏度可达到荧光分子的103~104倍[10-11]. 纳米金比色法以其简单快速、灵敏度高、肉眼可分辨且不需要借助复杂仪器等卓越优势,在生化检测、环境检测等领域具有广阔的应用前景[12-13].
过氧化氢(H2O2)在生化领域应用广泛,尤其常用于传统的酶联免疫吸附检测技术中. 利用纳米金比色法设计检测微量H2O2的方法,可得到较高的检测灵敏度[14]. 结合酶联免疫吸附技术,该方法可直观快速、灵敏地检测多种微量目标物质. 将传统酶联免疫吸附技术和纳米金测定H2O2的方法相结合,已经成为一种新型的检测艾滋病病毒技术[15],检测灵敏度可达到10-18g/mL,比目前检测技术高10 倍以上.该技术用过氧化氢酶标记HIV-1 衣壳抗原p24,浓度极低的p24 即可引起H2O2浓度的减小和纳米金颗粒的不规则聚集,进而使溶液颜色呈现蓝色;阴性结果则是纳米金粒子仍保持为单分散形态,溶液颜色显示为红色,用肉眼就可以分辨出以上的颜色变化. 运用这个技术,在釆用常规核酸检测方法都无法检出的情况下,研究人员可以在HIV 患者血液中检测出超低浓度的p24. 但该技术具有一定的局限性:(1)反应体系稳定性较差,其结果随反应时间的变化较快,为检验带来不便;(2)只能定性分析所测样品浓度在检测极限范围内外,却无法精确定量. 本文在此基础上,应用纳米金表面等离子体建立微量H2O2的检测体系,提高反应体系的稳定性并探索精确定量方法,并降低检测的分辨极限,为微量样品检测提供更好的平台.
1 实验部分
1.1 仪器与试剂
紫外-可见-近红外分光光度计(PerkinElmer,Lambda 950);酶标仪(Bio-Rad,iMark);电子透射显微镜;磁力搅拌器;pH 计;2-吗啉乙磺酸(西格玛奥德里奇上海贸易有限公司);氢氧化钠(国药试剂,分析纯);过氧化氢(阿拉丁试剂有限公司,分析纯);氯金酸(阿拉丁试剂有限公司,Au≥48%).
1.2 实验方法
取1.95 g 2-吗啉乙磺酸粉末溶于80 mL 去离子水中,在磁力搅拌下用1 mol/L 过氧化氢溶液调节pH 6.5,转移至100 mL 容量瓶定容,为100 mmol/L 2-吗啉乙磺酸储备液,室温储存备用. 另外,将1 g氯金酸粉末溶于25.4 mL 去离子水中,为100 mmol/L 氯金酸储备液,避光存于4 ℃中,保存时间勿超过15 d. 称取0.012 3 g 还原型半胱甘肽粉末溶于100 mL 去离子水中,配制成400 μmol/L 半胱甘肽溶液,4 ℃保存.
使用1 mmol/L 的2-吗啉乙磺酸溶液配置浓度为20 ~200 μmol/L 的H2O2溶液以及0.2 mmol/L 氯金酸溶液,现配现用.于96 孔板中,每孔各加100 μL氯金酸溶液和100 μL H2O2溶液,静置反应10 min.向各反应孔加入10 μL 半胱甘肽溶液,并于紫外-可见-近红外分光光度计或者酶标仪下读取吸光度.反应系统稳定情况检测部分未加半胱甘肽溶液.
2 结果与讨论
2.1 裸眼检测体系的辨色极限及金颗粒电镜图
2-吗啉乙磺酸可作为一种弱还原剂,与氯金酸溶液反应将生成团聚态的纳米金颗粒,反应溶液呈现裸眼可辨的蓝色. 此时,如果加入过量的H2O2作为辅助还原剂,将促进反应生成分散态的纳米金颗粒,使反应溶液呈现红色. 因此,纳米金表面等离子体可作为检测微量H2O2的灵敏探针.
实验分别检测0、20、40、60、80、100、120、140、160、180 及200 μmol/L 的H2O2溶液,反应10 min后辨色(图1). 当H2O2的浓度c <100 μmol/L 时,反应溶液肉眼观察显示蓝色;当c >120 μmol/L 时,反应溶液呈现红色. 该检测体系裸眼检测H2O2极限可分辨浓度差为20 μmol/L.
其中,取加入了60 μmol/L 和160 μmol/L H2O2的反应孔产物分别作为蓝色和红色反应孔的代表,制备铜网样品,用电子透射电镜观察结果(图2).蓝色反应孔的反应产物为团聚态的的纳米金颗粒,红色反应孔的反应产物为分散态的纳米金颗粒,与实验原理相符.

图1 不同H2O2 浓度反应孔的辨色图Figure 1 Photograph of nanoparticle solutions for different H2O2 concentrations

图2 不同颜色反应孔产物电镜图Figure 2 TEM images of nanoparticles in solutions of different colors
2.2 反应体系稳定性分析及其终止
2.2.1 反应体系的稳定性分析 实验发现,反应体系在3 h 内稳定性差,且在反应进行45 min 内颜色变化较快,对下一步检测和定量分析带来困难. 随着反应时间增加,c >120 μmol/L 的反应孔所生成的分散态纳米金颗粒将逐渐增加,红色逐渐加深;c<100 μmol/L 的反应孔也将生成分散态的纳米金颗粒,逐渐呈现红色,具体辨色结果见图3A. 反应进行15 min 后,c 为100 μmol/L 和80 μmol/L 的反应孔开始略微变红;反应进行20 min 后,此2 孔与更低过氧化氢浓度的反应孔颜色有明显区别,呈现红色,并逐渐加深(图3A). 此外,c <60 μmol/L 的反应孔所呈现的蓝颜色也随着反应时间不断加深.其中,c=60 μmol/L 的反应孔在反应进行45 min 后也已变为红色.
由于纳米金溶液在波长为570 nm 处有特征吸收,实验也通过检测溶液在570 nm 处的吸光度(OD570)来监测纳米金生成的稳定情况. 图3B 为不同反应时间各反应孔的吸光度OD570变化曲线. c>180 μmol/L 的反应孔在反应10 min 后OD570保持不变,反应稳定;而c <160 μmol/L 时,反应孔的OD570则在反应45 min 内变化较快,之后达到稳定.此外,随着反应孔中所加入H2O2浓度的降低,反应体系的OD570需要的稳定时间明显增加,与辨色结果中较低H2O2浓度反应孔逐渐变红的现象相吻合.
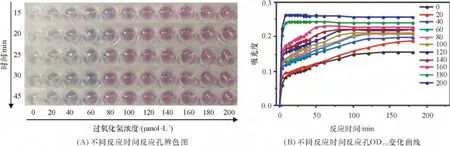
图3 不同反应时间下不同浓度H2O2 的稳定情况Figure 3 Detection stability of different reaction time for different hydrogen peroxide concentrations
2.2.2 半胱甘肽对反应体系的终止效果 为了方便下一步的检测和量化分析,实验使用还原型半胱甘肽作为反应体系的终止剂,以提高反应体系的稳定性. 由于还原型半胱甘肽对纳米金颗粒表面具有较好的亲和性,反应体系中的半胱甘肽将附着于纳米金表面,从而阻止了金颗粒的进一步团聚,终止反应. 反应进行10 min 后,向各反应孔中加入10 μL的半胱甘肽溶液,所得不同反应时间各反应孔情况见图4A. 加入半胱甘肽后,各反应孔的辨色结果不再随时间改变,c <100 μmol/L 的反应孔保持蓝色,c >120 μmol/L 的反应孔保持红色. 不同反应时间各反应孔的吸光度OD570变化曲线见图4B. 加入半胱甘肽后,各反应孔在反应15 min 后的OD570基本不变,反应稳定,与辨色结果中各反应孔颜色稳定的现象相吻合. 实验表明,还原型半胱甘肽溶液可有效终止各孔的反应,使纳米金颗粒的状态稳定.
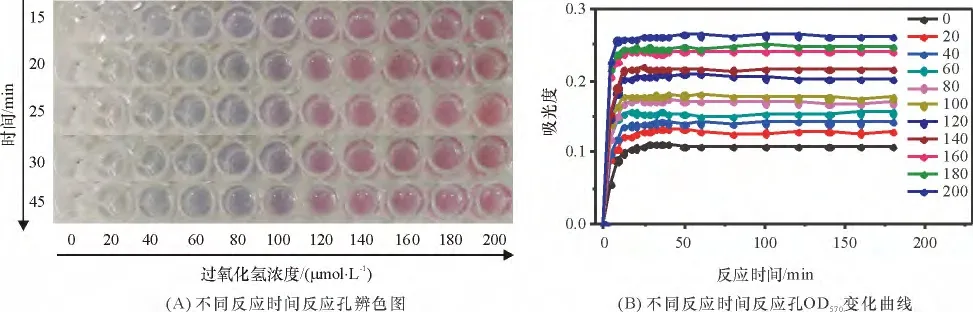
图4 加入半胱甘肽后不同反应时间下H2O2 的稳定情况Figure 4 Detection stability of different reaction time with L-glutathione for different hydrogen peroxide concentrations
2.3 检测结果吸收光谱及定量分析
为了精确定量H2O2浓度,实验使用紫外-可见-近红外分光光度计测定不同H2O2浓度反应孔生成物的吸收光谱(图5A). c <100 μmol/L 的反应孔产物在波长约550 nm 处有吸收峰,且吸收强度与c 成正相关. 而c >120 μmol/L 的反应孔产物吸收峰逐渐往短波长方向偏移,最终峰值约为540 nm.实验对各反应孔产物在630 nm 和545 nm 处吸光度的比值(OD630/545)进行分析,得到不同浓度H2O2的定量分析曲线(图5B). 各反应孔产物的OD630/545与c(μmol/L)呈良好的线性关系,其回归方程为OD630/545=-0.003 02c+1.011 77.
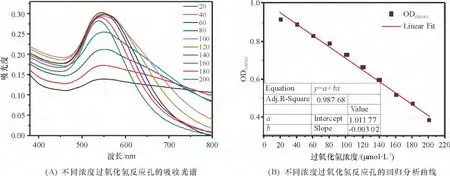
图5 不同浓度过氧化氢反应孔的吸收光谱及定量分析Figure 5 Ultraviolet-visible spectra and linear relativity of regressive curves of OD630/545 for different H2O2 concentrations
2.4 裸眼分辨极限下的检测分析
根据定量分析曲线,可有效地对裸眼分辨极限下的检测样品进行定量分析. 实验设计了加入100、102、104、106、108、110、112、114、116、118 和120 μmol/L 过氧化氢的反应孔,辨色结果见图6. c =100 μmol/L 的反应孔呈现蓝色,c =120 μmol/L 的反应孔呈现红色,而中间浓度的反应孔呈现从蓝色过渡到红色的辨色结果,裸眼难以区分. 实验中各反应孔的吸光度OD630/545如图7 所示,OD630/545与过氧化氢浓度c(μmol/L)呈良好的线性关系. 应用OD630/545可精确定量H2O2浓度,降低裸眼检测途径下该方法的分辨极限.

图6 不同浓度过氧化氢反应孔的辨色图(100 ~120 μmol/L)Figure 6 Photograph of nanoparticle solutions for different H2O2 concentrations (100 ~120 μmol/L)
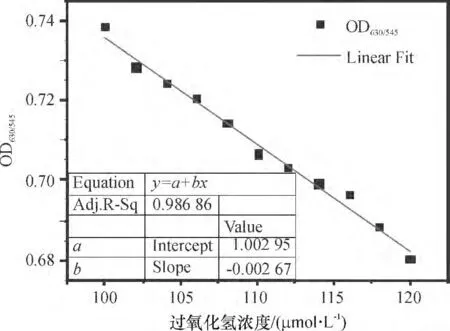
图7 裸眼分辨极限下不同浓度过氧化氢反应孔吸光度OD630/545(100 ~120 μmol/L)Figure 7 OD630/545 for different H2O2 concentrations (100 ~120 μmol/L)beyond the limit of detecting resolution with naked eyes
3 结论
本实验在酸性2-吗啉乙磺酸介质中,建立基于纳米金表面等离子体的微量过氧化氢的检测体系,其裸眼检测H2O2极限可分辨浓度差为20 μmol/L.实验使用半胱甘肽有效终止反应,提高了体系的稳定性,并利用光谱分析精确定量H2O2浓度,降低裸眼检测途径下该方法的分辨极限. 该检测方法操作简单、灵敏度高,便于结合传统酶联免疫吸附技术,在微量生物分子检测领域有广阔应用前景.
[1]Saha K,Agasti S S,Kim C,et al. Gold nanoparticles in chemical and biological sensing[J]. Chemical Reviews,2012,112(5):2739-2779.
[2]孙双姣,蒋治良. 金纳米微粒的制备和表征及其在生化分析中的应用[J]. 贵金属,2005,26(3):55-65.Sun S J,Jiang Z L. Preparation and characterization of gold nanoparticles and their application in biochemical analysis[J]. Precious Metals,2005,26(3):55-65.
[3]刘刚,潘敦,刘丽,等. 纳米金与生物分子的相互作用及生物传感检测[J]. 纳米科技,2009,6(3):6-9.Liu G,Pan D,Liu L,et al. Interaction of gold nano particles and biomolecules and their application in biosensor[J]. Nanomaterial & Application,2009,6(3):6-9.
[4]Wang L,Liu X,Hu X,et al. Unmodified gold nanoparticles as a colorimetric probe for potassium DNA aptamers[J]. Chemical Communications,2006,28(36):3780-3782.
[5]Wang H,Wang Y,Jin J,et al. Gold nanoparticle-based colorimetric and“Turn-On”fluorescent probe for mercury(II)ions in aqueous solution[J]. Analytical Chemistry,2008,80(23):9021-9028.
[6]Cordray M S,Amdahl M,Richards-Kortum R R. Gold nanoparticle aggregation for quantification of oligonucleotides:Optimization and increased dynamic range[J]. Analytical Biochemistry,2012,431(2):99-105.
[7]Xu W,Xue X,Li T,et al. Ultrasensitive and selective colorimetric DNA detection by nicking endonuclease assisted nanoparticle amplification[J]. Angewandte Chemie International Edition,2009,48(37):6849-6852.
[8]Jv Y,Li B,Cao R. Positively-charged gold nanoparticles as peroxidiase mimic and their application in hydrogen peroxide and glucose detection[J]. Chemical Communications,2010,46(42):8017-8019.
[9]Kim J W,Kim J H,Chung S J,et al. An operationally simple colorimetric assay of hyaluronidase activity using cationic gold nanoparticles[J]. Analyst,2009,134(7):1291-1293.
[10]Gribnau T C J,Leuvering J H W,van Hell H. Particlelabelled immunoassays:A review[J]. Journal of Chromatography B: Biomedical Sciences and Applications,1986,376:175-189.
[11]Storhoff J J,Lucas A D,Garimella V,et al. Homogeneous detection of unamplified genomic DNA sequences based on colorimetric scatter of gold nanoparticle probes[J]. Nature Biotechnology,2004,22(7):883-887.
[12]Xia F,Zuo X,Yang R,et al. Colorimetric detection of DNA,small molecules,proteins,and ions using unmodified gold nanoparticles and conjugated polyelectrolytes[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(24):10837-10841.
[13]马立娜,刘殿骏,王振新. 金纳米粒子探针的合成及应用[J]. 分析化学,2010,38(1):1-7.Ma L,Liu D,Wang Z. Synthesis and applications of gold nanoparticle probes[J]. Chinese Journal of Analytical Chemistry,2010,38(1):1-7.
[14]Sang Y,Zhang L,Li Y F,et al. A visual detection of hydrogen peroxide on the basis of Fenton reaction with gold nanoparticles[J]. Analytica Chimica Acta,2010,659(1/2):224-228.
[15]de la Rica R,Stevens M M. Plasmonic ELISA for the ultrasensitive detection of disease biomarkers with the naked eye[J]. Nature Nanotechnology,2012,7(12):821-824.
