动态增强MRI在孤立性肺结节鉴别诊断中的应用
2015-12-14马晓玲周舒畅夏黎明
马晓玲,周舒畅,夏黎明
华中科技大学同济医学院附属同济医院放射科,武汉 430030
孤立性肺结节(solitary pulmonary nodules,SPNs)性质的鉴别诊断一直是影像学的重要命题。近年有学者利用CT和MRI动态增强技术从评价肺部结节的的血供和代谢方面鉴别良恶性取得了进展和突破,另有学者利用PET或PET/CT通过结节对18F-FDG的代谢情况判断结节的性质,但因炎性结节和恶性结节在血流动力学和强化趋势上存在交叉重叠[1-7],上述检查方法均具有较高的假阳性。笔者对肺部SPNs的患者行MRI动态增强扫描(DCE-MRI),探讨利用DCE-MRI的血流动力学参数定量化鉴别恶性结节和良性结节、炎性结节的可行性。
1 材料和方法
1.1 研究对象
收集2013年8月至2014年10月在武汉同济医院经CT检查为肺部SPNs[不含钙化斑块和脂肪成分的实性结节,直径范围为7~36 mm,平均直径为(24.51±5.32)mm],符合本研究纳入标准的62例SPNs患者(男42例,女20例,年龄27~76岁,平均年龄54.5岁)。本组中,恶性病灶42例,良性病灶13例,炎性病灶7例,病理43例经手术证实,16例经纤支镜或经皮穿刺活检证实,3例经治疗后随访复查证实。
1.2 检查设备
使用GE 超导型磁共振扫描仪(GE Healthcare,MR HD×1.5 T,Milwaukee,WI,USA),采用8通道的心脏线圈,使用呼吸门控和外周心电门控。
1.3 检查技术及成像参数
所有患者均行常规MRI和DCE-MRI。常规MRI:①轴位心电门控SE/T1WI:TR800 ms,TE8 ms,层厚5 mm,层间隔1 mm,FOV41 cm,矩阵320×160,扫描时间6 min。②FSE/T2WI:TR7000 ms,TE 102 ms,层厚5 mm,层间隔1 mm,FOV41cm,矩阵320×224,扫描时间3.6 min。DCE-MRI:采用肝脏快速容积采集(LAVA):TR 4.2 ms,TE2.0 ms,翻转角15°,层厚5 mm,矩阵256×160,FOV35cm,带宽62.50。扫描原则:在尽可能包住病灶和纵隔的前提下减少扫描时间,单次扫描时间12 s~15 s,要求患者呼气后屏气。首先进行蒙片扫描,再在打药后15 s后开始扫描,每期时间保持在30 s左右,持续扫描15期。
病人肘前静脉置入18G留置针;对比剂采用钆喷替酸葡甲胺(Gd-DTPA,莫迪司),剂量为0.1 mmol/kg,流速2.5 ml/s,同时以相同流速注入0.9%生理盐水10 ml。
1.4 图像处理与分析
(1)将数据传至GE工作站(GE ADW 4.4),为减少呼吸和心脏搏动造成的运动伪影,所有数据均由两名工作年限超过3年的医生手动测量病灶16个期相中每个期相信号值。尽量避开病灶坏死、囊变、血管区域,尽可能选择病灶最大的实性层面,在每一期对应相同层面用工具沿病灶边缘勾勒形成ROI,为减少病灶血流动力学的不均质性,ROI尽可能包住病灶。图像先后重复测量3次,再求平均值作为最终信号值。利用软件SPSS Statistics 20.0处理数据:将数据录入,绘制时间-信号曲线(time-signal intensity curves,T-SI曲线)。
(2)分析DCE-MRI参数如下:①未注药和强化高峰的信号强度,分别是SI0和SImax;②强化第1 min、2 min、4 min的强化增强比(SI1%、SI2%、SI4%);SIn%=(SIn-SI0)/SI0,n=1,2,4 min;③最大的强化增强比(MER),MER =(SImax-SI0)/SI0;④达峰时间Tmax,即达到峰值信号的时间;⑤廓清率washout,washout=SImax-SImax+3/SImax,SImax+3是Tmax+3的SI值;⑥最大上升斜率(steepest slope,SS)=[(SIend-SIprior)/SI0]×100%/(Tend-Tprior);⑦平均强化值(mean enhancement value,ME),15期信号的平均增加值。
1.5 统计学分析
利用软件SPSS Statistics 20.0,使用Kolmogorov-Smirov法分别检验各组数据的各参数是否符合正态分布,若符合正态分布,3组各参数两两进行独立样本T检验,若不符合正态分布,3组数据的各强化参数两两进行Kruskal-Wallis检验(P<0.05为具有统计学差异)。使用Medcalc软件进行ROC分析。
2 结果
将本研究的病例分为恶性组、炎性组和良性组;恶性组42例,病理类型包括:18例腺癌,11例鳞癌,6例小细胞肺癌,3例肺肉瘤样癌,2例类癌,2例分别为肺淋巴瘤和肺转移性肾癌。活动性炎性组7例包括:活动性结核4例,机化性肺炎1例,真菌感染1例,脓肿1例。良性组13例包括:结核瘤8例,错构瘤2例,慢性肉芽肿2例,硬化性血管瘤1例。
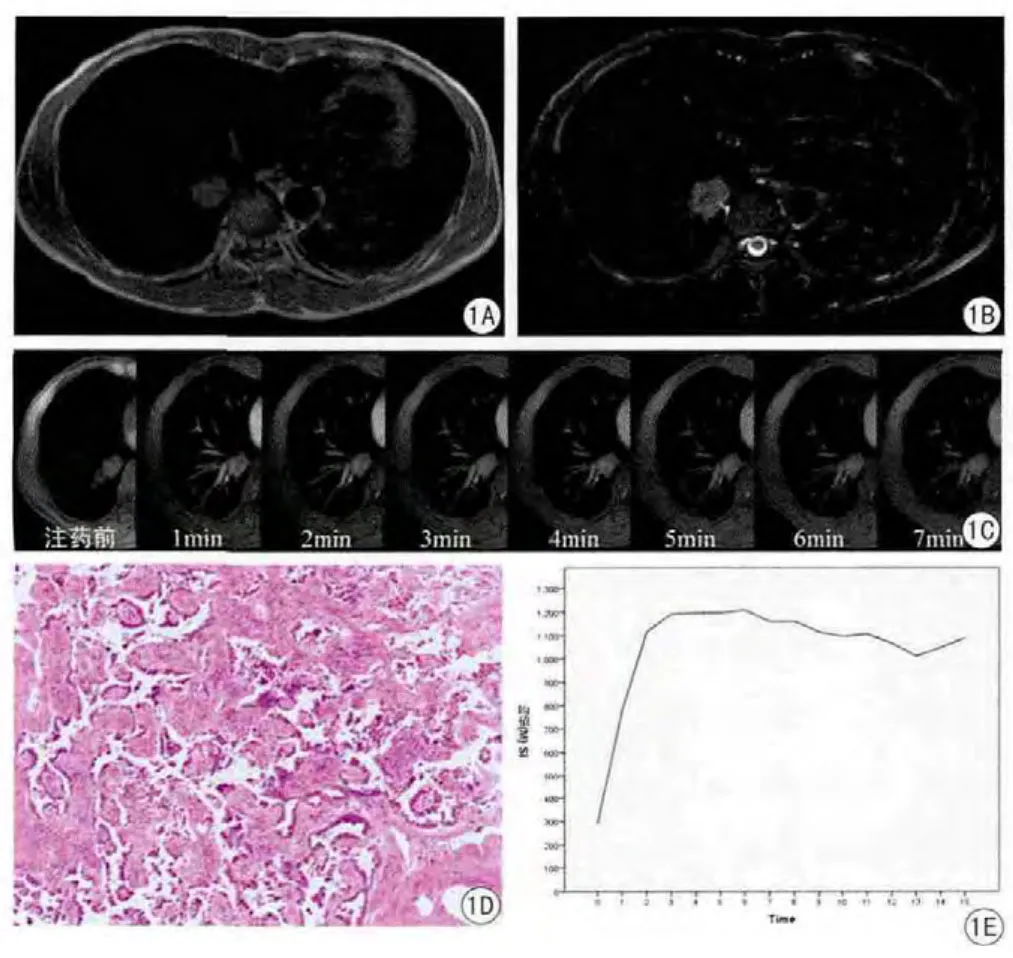
图1 右下肺中-低分化腺癌。病灶呈类圆形,信号欠均匀,边缘可见数个短毛刺。A:SE/T1WI示病灶呈等信号;B:FSE/T2WI示病灶呈高信号;C:动态增强序列,从左至右依次为注射对比剂之前、注射后1min~7min的图像,右肺下叶病灶迅速强化后逐渐廓清;D:病理示镜下可见大量结构不一、异型性明显的瘤细胞呈腺样排列;E:时间-信号曲线,曲线呈早期明显上升,而后逐渐下降Fig.1 Adenocarcinoma in right lower lobe.Lesion is round-like,heterogeneous,spiculated.A:SE/T1WI MR reveals moderate intensity in leision.B:FSE/T2WI MR reveals hyperintensity in leision.C:Dynamic contrast enhanced-MR images show enhancement before bolus injection and after 1-7 min since bolus injection of Gd-BOPTA.The leision in right lower lobe strengthens rapidly then clears gradually.D:Photomicrograph shows lots of neoplastic cells with different structure are arranged in adenoid.E:The temporal-signal curves shows a rapid increase and a gradual decrease in signal intensity.
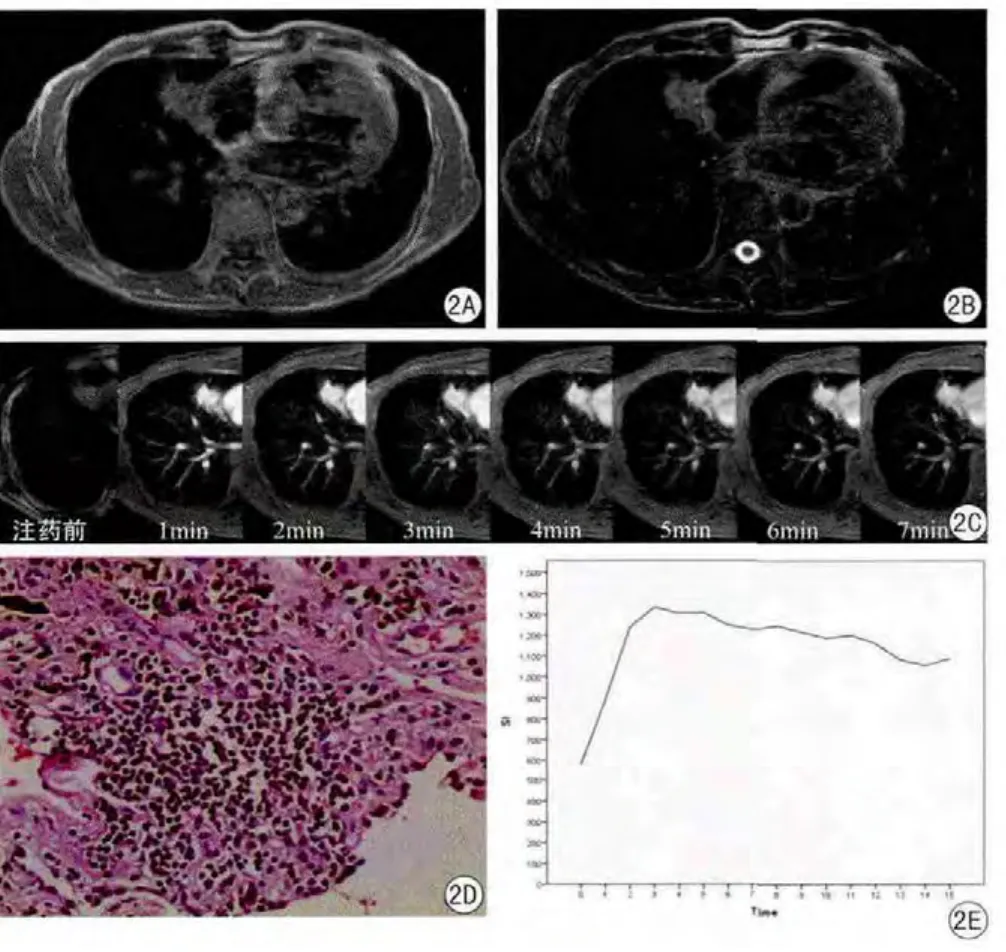
图2 右肺中叶机化性肺炎。病灶形态不规则,边缘欠光整,信号不均。A:SE/T1WI示病灶呈等信号;B:FSE/T2WI示病灶稍高信号;C:动态增强序列,从左至右依次为注射对比剂之前、注射后1min~7min的图像,右肺中叶病灶迅速强化后又逐渐廓清;D:病理示镜下可见纤维组织增生,并可见大量的炎性细胞浸润;E:时间-信号曲线,曲线呈早期明显上升,而后逐渐下降Fig.2 Focal organized pneumonia in right middle lobe reveals an irregular shape and heterogeneous nodule with unsmoothed margin.A:SE/T1WI MR reveals moderate intensity in leision; B:FSE/T2WI MR reveals slightly hyperintensity in leision; C:Dynamic contrast enhanced-MR images show enhancement before bolus injection and after 1-7min since bolus injection of Gd-BOPTA.The leision in right middle lobe strengthens rapidly then clears gradually; D:Photomicrograph shows lots of hyperplastic fibrous tissue and infl ammatory cells; E:The temporal-signal curves shows a rapid increase and a gradual decrease in signal intensity.
2.1 正态性检验结果
恶性组(图1)、炎性组(图2)、良性组(图3)的SI 1%、SI 2%、SI 4%、MER、Tmax、washout均不符合正态分布(以中位数和四分位差形式描述),使用多样本的Kruskal-Wallis法成对检验,而SS、ME符合正态分布(以平均数±标准差形式描述),使用独立样本T检验两两进行对比检验。
2.2 各组统计学比较
恶性组的SI 1%、SI 2%、SI 4%、MER、SS均明显低于炎性组(P<0.05)且均明显高于良性组(P<0.01),具有显著性统计学差异(图4)。恶性组和炎性组Tmax、ME、washout均未具有显著性差异,但恶性组和良性组的Tmax、ME及炎性组和良性组的ME具有显著性统计学差异(P<0.05)(表1)。
2.3 对参数SI 2%、SI 4%、MER、SS进行检验效能分析(表2)
以SI2%为1.95、0.6分别作为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>1.95为炎性病变,≤0.6为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是95%(40/42)、75%(15/20)、89%(40/45)、88%(15/17)、89%(55/62);以SI4%为1.93、0.61分别作为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>1.93为炎性病变,≤0.61为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是93%(39/42)、75%(15/20)、89%(39/44)、83%(15/18)、87%(54/62),以MER为2.23、0.63分别作为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>2.23为炎性病变,≤0.63为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是100%(42/42)、75%(15/20)、89%(42/47)、100%(15/15)、92%(57/62);以SS为2.76、0.88分别作为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>2.76为炎性病变,≤0.88为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是86%(36/42)、75%(15/20)、88%(36/41)、71%(15/21)、82%(51/62)。

图3 左上肺硬化性血管瘤。病灶呈类圆形,边缘清晰光整,信号较均匀。A:SE/T 1WI示病灶呈稍高信号;B:FSE/T2WI示病灶呈较高信号;C:动态增强序列,从左至右依次为注射对比剂之前、注射后1min~7min的图像,左肺上叶病灶早期呈边缘强化后逐渐向内填充,增强后期病灶呈明显、均匀强化,还可见“血管贴边征”;D:病理示镜下可见血管瘤样和乳头样成分;E:时间-信号曲线,曲线呈早期明显上升,而后保持水平Fig.3 Sclerosing hemangioma in left upper lobe reveals a round-like and homogenous nodule with clear and smooth border.A:SE/T1WI MR reveals slightly hyperintensity in leision; B:FSE/T2WI MR reveals hyperintensity in leision; C:Dynamic contrast enhanced-MR images before bolus injection and after 1-7min since bolus injection of Gd-BOPTA show edge enhancement then inward fi lling,and obvious homogeneous enhancement at last with vascular welt syndrome; D:Photomicrograph shows angiomatous and nipple-like component; E:The temporal-signal curves shows a early peak then keep steady
3 讨论
近年有较多国内外学者利用动态增强CT和MRI、PET/CT等多种影像方法对肺孤立性结节进行良恶性的鉴别研究[1,4,8-12],旨在早期发现恶性病变后行手术切除,对良性病变避免有创性活检或手术。临床对恶性、炎性、良性病变的干预治疗措施截然不同,本文通过比较三者动态增强参数的差异探究其血液动力学方面的特征,以期为无创性的鉴别诊断。
肺部病灶的强化程度和强化方式由病灶的血流灌注、血流量、毛细血管表面积、血管的渗透性、血管外间隙等决定[2,5]。恶性病灶主要由支气管动脉供血,其内含有大量的新生血管,血供丰富,血流量、血管渗透性、血管外间隙均增高,增强时的强化幅度和强化速度高于乏血供的良性病变,但血流量和血管渗透性的增加不仅发生在恶性病变中,也同样发生在活动性炎症中,多个研究报道证实良恶性病变的血流动力学参数具有统计学差异,但恶性病变的强化参数和活动性炎症存在交叉现象[1,8-12],其中Fujimoto[1]取最大强化率为1.1作为临界值鉴别良恶性结节,敏感度、特异度、阳性预测值分别为63%、74%、92%,Schaefer,et al[11]研究中最大强化率和斜率分别取0.85和1.5为临界值时,特异度分别为88%和75%。Zou Y,et al[13]的病理学资料证实恶性肿瘤内含有大量的、血管壁欠完整的不成熟血管,活动性炎症内毛细血管和微血管丰富且明显迂曲、扩张但血管壁均完整,故恶性病变和活动性炎症的血流灌注、血流量、毛细血管的渗透性均会不同程度的增加。笔者的研究将活动性炎症单独作为一组与恶性组比较发现炎性组、恶性组、良性组的SI 1%、SI 2%、SI 4%、MER、SS值呈依次递减的趋势,炎性组和恶性组、恶性组和良性组及炎性组和良性组的上述参数均具有统计学的差异(P<0.05)。炎性组的平均强化量ME、廓清率washout虽高于恶性组但无统计学差异,两者的Tmax无统计学差异。较之恶性结节和良性结节,炎性结节在对比剂首过时强化速率、强化幅度最大,具有更高的强化峰值,同时具有更大的廓清速率。恶性组次之,良性组因缺乏血供或无血供,强化速率和幅度、峰值、廓清率均为最低。与笔者的研究结果相符,Ohno Y,et al[14]对58例孤立性肺结节的研究发现恶性结节的最大强化速率和平均上升斜率明显大于良性结节并明显小于炎性结节,均具有显著统计学差异。Zou Y,et al[13]的研究结果也发现恶性组的SI 4%与炎性组相比具有统计学差异,与笔者研究不同的是,SI 1%、SI 2%、SS及强化峰值均无明显差异。据ROC分析MER以2.23、0.63分别为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>2.23为炎性病变,≤0.63为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是100%(42/42)、75%(15/20)、89%(42/47)、100%(15/15)、92%(57/62),以SI2%为1.95、0.6分别作为鉴别炎性病变和恶性病变、恶性病变和良性病变的临界值(>1.95为炎性病变,≤0.6为良性病变),恶性病变与另外两组得以鉴别的敏感度、特异度、阳性预测值、阴性预测值、准确度分别是95%(40/42)、75%(15/20)、89%(40/45)、88%(15/17)、89%(55/62),具有良好的鉴别效能。
本研究良性组中出现5例假阳性病例,与恶性组的参数发生交叉,分别为3例结核瘤,1例错构瘤,1例硬化性血管瘤,表现为较明显、迅速强化。本文将结核瘤与活动性结核的区分依照以下标准:(1)近6月的影像资料表明,病灶体积无明显变化;(2)微生物检查(包括痰涂片、痰培养)中未检出结核分支杆菌[13-14]。结核随病程的迁延病理特征呈多样化,分析这3例病灶内含有部分炎性成分,故强化程度较高,结核瘤是由纤维组织和结核性肉芽组织包裹干酪样坏死物形成,增强时表现为边缘薄壁环形强化、病灶内欠强化的特征,再者其内含有较多粘液蛋白,在T1加权成像时多表现为稍高信号,1例错构瘤表现为边缘光滑,病灶强化明显,内可见分隔样的不强化区,不强化区系由无血供的软骨核构成[15]。另其中1例硬化性血管瘤血供丰富,增强早期时病灶呈周边强化后对比剂向内填充,增强后期病灶呈均匀、明显强化的特点。因此,结合动态增强时病灶形态学特点,能进一步提高鉴别诊断的准确度。
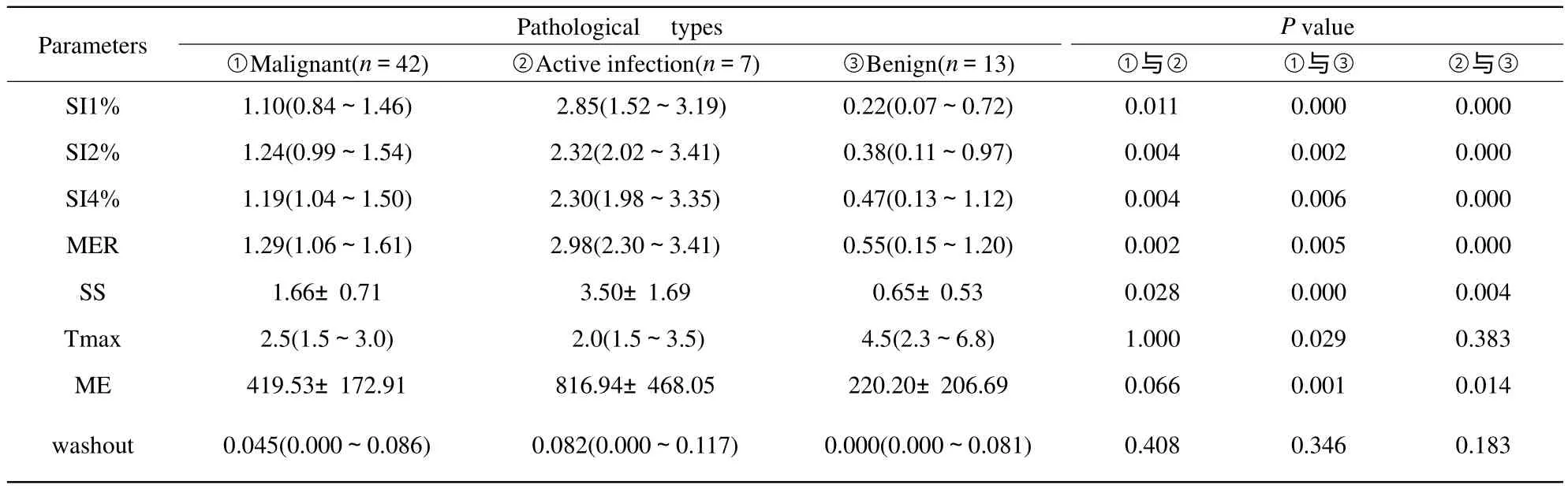
表1 不同类型的SPNs的DCE-MR强化参数比较Tab.1 Parameters of DCE-MR of the three SPNs groups
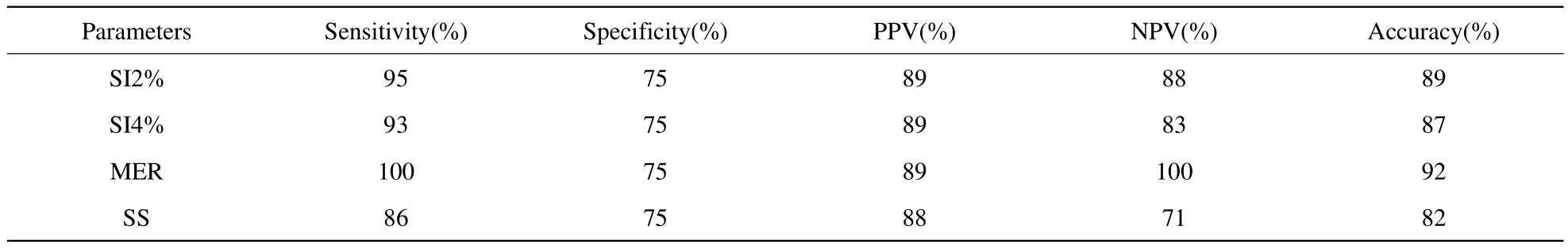
表2 恶性结节与其他两组结节鉴别的诊断效能Tab.2 Diagnostic Capability of malignant SPNs group from other SPNs groups

图4 3组SPNs的MER散点图(使用平均值和标准差):良性组SPNs的MER显著性低于恶性组SPNs(P<0.05);炎性组SPNs的MER显著性高于恶性组SPNs(P<0.05)。Fig.4 Scattergram for the three SPNs groups indicates maximum relative enhancement ratios with means and standard deviation:MER for the benign group was significantly lower than that for the malignant group(P<0.05); the active infection group was significantly higher than that for the malignant group(P<0.05).
本研究存在的局限性:(1)炎性组和良性组的病例数尚显欠缺,这将在后续工作中进一步补充完成;(2)磁共振的肺部成像有其固有的局限性,空间分辨率较低,磁敏感伪影及呼吸和运动导致的运动伪影均不能完全避免,图像测量会产生一定误差。
[References]
[1]Fujimoto K.Usefulness of contrast-enhanced magnetic resonance imaging for evaluating solitary pulmonary nodules.Cancer imaging,2008,8(1):36-44.
[2]Fujimoto K,Abe T,Muller NL,et al.Small peripheral pulmonary carcinomas evaluated with dynamic MR imaging:correlation with tumor vascularity and prognosis.Radiology,2003,227(3):786-793.
[3]Bai RJ,Cheng XG,Qu H,et al.Solitary pulmonary nodules:comparison of multi-slice computed tomography perfusion study with vascular endothelial growth factor and microvessel density.Chin Med J,2009,122(5):541-547.
[4]Li ZW,Zhang TT,Li MY,et al.Clinical study of dynamic contrastenhanced MR imaging in differential diagnosis of solitary pulmonary nodules with abundant blood supply.CT Theory and Applications,2012,21(3):563-570.李智勇,张婷婷,李梦颖,等.动态增强磁共振成像在孤立性富血供肺结节良恶性鉴别诊断中的临床研究.CT理论与应用研究,2012,21(3):563-570.
[5]Schaefer JF,Schneider V,Vollmar J,et al.Solitary pulmonary nodules:association between signal characteristics in dynamic contrast enhanced MRI and tumor angiogenesis.Lung Cancer,2006,53(1):39-49.
[6]Ma XL,Zhou SC,Ai T,et al.The quantitative study of dynamic contrat enhanced MRI in solitary pulmonary nodules.Radiol Prac,2014,29(10):1158-1162.马晓玲,周舒畅,艾涛,等.动态增强磁共振在肺孤立性结节灶中的定量化研究.放射学实践,2014,29(10):1158-1162.
[7]Zheng L,Li HL,Zhang JM,et al.Diagnostic Value of Dynamic Enhanced CT in Solitary Pulmonary Nodules.Radiol Prac,2008,23(7):772-774.郑琳,黎海亮,张建伟,等.动态增强CT扫描对孤立性肺结节的诊断价值.放射学实践,2008,23(7):772-774.
[8]Kim JH,Kim HJ,Lee KH,et al.Solitary pulmonary nodules:a comparative study evaluated with contrast-enhanced dynamic MR imaging and CT.J Comput Assisted Tomogr,2004,28(6):766-775.
[9]Kono R,Fujimoto K,Terasaki H,et al.Dynamic MRI of solitary pulmonary nodules:comparison of enhancement patterns of malignant and benign small peripheral lung lesions.AJR Am J Roentgenol,2007,188(1):26-36.
[10]Mamata H,Tokuda J,Gill RR,et al.Clinical application of pharmacokinetic analysis as a biomarker of solitary pulmonary nodules:dynamic contrast-enhanced MR imaging.Magn Reson Med,2012,68(5):1614-1622.
[11]Schaefer JF,Vollmar J,Schick F,et al.Solitary pulmonary nodules:dynamic contrast-enhanced MR imaging--perfusion differences in malignant and benign lesions.Radiology,2004,232(2):544-553.
[12]Tozaki M,Ichiba N,Fukuda K.Dynamic magnetic resonance imaging of solitary pulmonary nodules:utility of kinetic patterns in differential diagnosis.J Comput Assisted Tomogr,2005,29(1):13-19.
[13]Zou Y,Zhang M,Wang Q,et al.Quantitative investigation of solitary pulmonary nodules:dynamic contrast-enhanced MRI and histopathologic analysis.AJR Am J Roentgenol,2008,191(1):252-259.
[14]Ohno Y,Hatabu H,Takenaka D,et al.Solitary pulmonary nodules:potential role of dynamic MR imaging in management initial experience.Radiology,2002,224(2):503-511.
[15]Potente G,Macori F,Caimi M,et al.Noncalcified pulmonary hamartomas:computed tomography enhancement patterns with histologic correlation.J Thorac Imaging,1999,14(2):101-104.
