热带大型水库蓝藻群落季节动态特征——以大沙河和高州水库为例
2015-12-13袁一文肖利娟韩博平
袁一文,肖利娟,,韩博平,
1. 暨南大学生态学系,广东 广州 510632;2. 广东省蓝藻水华防治中心,广东 广州 510632
热带大型水库蓝藻群落季节动态特征——以大沙河和高州水库为例
袁一文1,肖利娟1,2*,韩博平1,2
1. 暨南大学生态学系,广东 广州 510632;2. 广东省蓝藻水华防治中心,广东 广州 510632
为了解热带大型水库蓝藻群落结构的组成和季节动态,于2011年和2010年分别对两座热带大型水库进行逐月采样,研究其蓝藻群落结构的组成和季节动态特征,并探讨关键的环境因子。两座水库共检测到蓝藻14属,在蓝藻种类组成上两座水库没有明显差异,但蓝藻群落结构和季节动态差异明显。生态幅较宽的种类,如鱼腥藻 Anabaena、蓝纤维藻Dactylococcopsis、微囊藻Microcystis分布较广且多为优势种。高州水库为中营养水体,蓝藻生物量在0.039 mg·L-1以下,丰水期蓝藻生物量较高,以丝状蓝藻(泽丝藻Limnothrix)、假鱼腥藻Pseudanabaena和蓝纤维藻)为优势种。大沙河水库为富营养水体,全年蓝藻生物量在0.23 mg·L-1以上,枯水期蓝藻生物量较高,在3~12 mg·L-1之间,以具伪空泡结构的蓝藻(微囊藻和鱼腥藻)为优势种。冗余分析结果表明,总磷、总氮、温度、硝氮、正磷酸盐、真光层深度以及真光层与混合层深度之比等7个环境变量对蓝藻群落有显著作用(P<0.05),其中总磷浓度与群落的相关性最高,其次为总氮和温度。相对于中营养水体,富营养水体的光可获得性更低,同时营养盐的限制作用较弱,具有伪空泡结构的蓝藻多为优势种。在富营养的大沙河水库,微囊藻和鱼腥藻全年维持一定的生物量,不存在温带水体的“越冬”现象,且其生物量在冬季更高。热带水体蓝藻群落的演替机制与温带、亚热带地区有较大的区别,温度对蓝藻群落的作用以间接作用为主。
热带;大型水库;蓝藻;季节动态
YUAN Yiwen, XIAO Lijuan, HAN Boping. Seasonal Dynamics of Cyanobacteria Assemblage in Tropical Large Reservoirs, South China——Using Dashahe and Gaozhou Reservoirs as Examples [J]. Ecology and Environmental Sciences, 2015, 24(12): 2027-2034.
蓝藻是浮游植物群落中常见的门类之一,其细胞没有色素体,色素均匀分布在细胞内,除叶绿素之外,还含藻胆蛋白,对光的吸收和利用能力较强,是其在光限制水体中具有较大竞争优势的生理特征之一(Adams et al.,1999;Oliver et al.,2002)。有些蓝藻种类具有伪空泡,通过调节伪空泡的数量和伪空泡内的气压,可以控制细胞的浮力大小,进而调节细胞在水体中的位置,获得最佳的营养盐和光照条件(Walsby,1994;Visser et al.,1996)。部分丝状蓝藻具有异形胞,能够固氮,在氮限制水体中能吸收和利用空气中的N2(Brett et al.,1997;Kilham et al.,1997;Whitton,2012)。水体中的蓝藻多以群体或丝状形态存在,以群体存在的蓝藻能够有效抵御浮游动物的牧食,减少牧食的损失(Kromkamp et al.,1998;Nalewajko et al.,2001; Ghadouani et al.,2003)。此外,有些蓝藻还具有储磷机制和碳浓缩机制等特性(Visser et al.,1996;Kromkamp et al.,1998;Nalewajko et al.,2001)。这些生理特征都有利于蓝藻对营养盐和光的竞争,是蓝藻在富营养水体中成为优势类群的重要原因。
在温带和亚热带地区,冬季温度很低,水体中浮游植物的生长受到温度的限制,生物量的峰值一般出现在温度较高的季节。例如从温带地区水体浮游生物生态类群模型(PEG模型)表明温带水体浮游植物的峰值一般出现在春季和夏季(De Senerpont Domis et al.,2013);大量研究也表明温带地区的蓝藻水华主要出现在春季和夏季(Reynolds et al.,1998);太湖是我国第三大湖,长期的研究表明,春季是太湖蓝藻的生长季节,夏季蓝藻生物最高(Deng et al.,2014)。温度是温带和亚热带地区浮游植物以及蓝藻季节动态的决定性因素,低于15 ℃的水体不利于蓝藻的生长(Robart et al.,1987)。
广东省地处亚热带北缘,大部分地区在北回归线以南,属于热带海洋性气候,气温全年较高。该地区天然湖泊较少,水库是主要蓄水水体。广东省有35座大型水库,承担着多项供水任务,对地区经济发展有重要作用。近年来随着珠三角经济的发展,大型水库水体富营养化趋势明显加剧,蓝藻水华事件的发生也呈现逐年上升的趋势。因此对广东省水库蓝藻群落结构和季节动态的研究对水质管理有重要的意义。目前对蓝藻及蓝藻水华发生的机制研究结果多来自于温带和亚热带地区,对于热带地区的蓝藻研究相对较薄弱,热带地区蓝藻及蓝藻水华的发生发展机制与温带和亚热带地区的是否一致,并不完全清楚。本研究以广东省两座经常发生蓝藻水华的大型供水水库:高州水库和大沙河水库为例,通过调查蓝藻种类组成和季节动态,分析影响蓝藻群落和季节动态的环境因子,以了解热带水库蓝藻的季节动态和影响蓝藻群落动态的关键环境因子。
1 材料与方法
1.1水库概况
高州水库(22°2′N,111°1′E)位于广东省茂名市西北部,属于峡谷型大型深水水库,处于粤西地区的鉴江流域,主要负担供水、发电、防洪等功能,是粤西重要的供水水源地。高州水库库容1.15×109m3,集水面积1.02×103km2,水面面积43.8 km2,湖泊区平均水深25.8 m,主要来水河流为曹江与大井河。大沙河水库(22°32′N,112°30′E)位于广东省江门市西北部,属于大型浅水水库,岸线系数较大,是开平市重要的水源地。该水库库容2.58×108m3,集水面积2.17×102km2,水面面积16.3 km2,湖泊区平均水深10.8 m,入库河流为径流量较小的溪流。两水库相距约150 km,都属于亚热带海洋性季风气候,夏季高温多雨,冬季暖和少雨,均为广东省重要的大型供水水库(图1)。
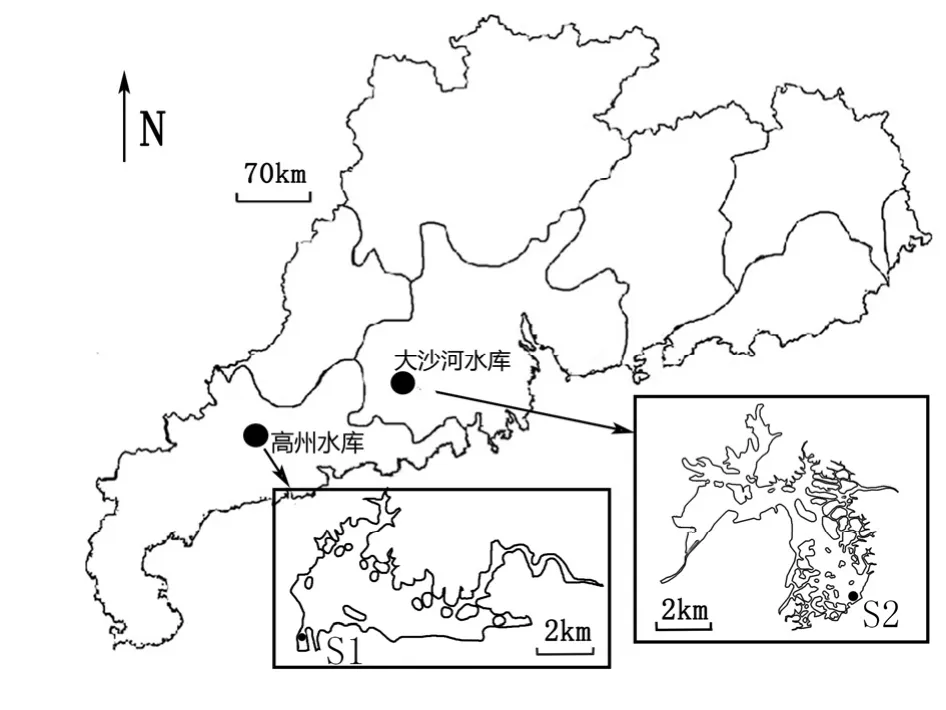
图1 水库位置和采样点示意图Fig. 1 Location of reservoirs and sampling sites
1.2采样点设置及采样时间
在水库坝前的湖泊区中心位置设置采样点,两水库各设置1个采样点,高州水库采样时间为2011年1─12月,每月采样1次;大沙河水库采样时间从2010年1─12月,每周采样1次。
1.3样品采集与数据处理
现场用便携式多参数水质监测仪(YSI 185)测定水温(t),用塞氏盘测定透明度(SD)。用采水器于0.5 m深处取5 L水样,取其中1 L存于棕色玻璃瓶,当天带回实验室测定营养盐浓度:总氮(TN)、氨氮(NH4+-N)、硝态氮(NO3--N)、总磷(TP)和正磷酸盐(PO43--P)。在数据分析中,溶解态氮为氨氮和硝氮之和,正磷酸盐为溶解态磷。水文数据由分别由两水库管理局提供。
浮游植物定性样品用孔径为38 μm的浮游生物网于水平和垂直方向拖取,存于100 mL的聚乙烯瓶内现场用甲醛溶液固定,在光学显微镜(OLYMPUS-BX51)下进行种类鉴定。于0.5 m水深处用采水器取水5 L,取其中1 L存于1000 mL聚乙烯瓶内,作为浮游植物定量样品,现场用鲁哥试剂固定,带回实验室沉淀、浓缩后在光学显微镜下对浮游植物进行计数,藻类丰度和生物量计算方法参考《淡水浮游生物研究方法》。
浮游植物Levins生态位宽幅计算公式:

式中Pij=,Bi是指种i的生态位宽度,Pij是种i对第j个资源的利用占它对全部资源利用的频度;nij是指种i在资源j上的优势度,此处为物种综合优势度(SDR);r为资源等级数。
综合优势度(SDR)计算公式:

其中RDi=×100%;RPi=×100%;式中Di指物种i的密度,指样本中所有物种的总密度,Vi指物种i的体积,指样本中所有物种的总体积。
相关性分析、环境因子和蓝藻群落关系的RDA(Redundancy Analysis)分析及作图均在R platform version 3.1.1(Borcard et al.,2011)中完成。
2 结果与分析
2.1水文水动力和物理特征
调查期间,高州水库平均水温 25.0 ℃,变化范围为 18.0~31.9 ℃;大沙河水库平均水温24.0 ℃,变化范围为16.6~31.2 ℃,大沙河温度波动范围大于高州水库。但两座水库表层水温没有明显差别(P>0.05),基本在20 ℃以上。高州水库库区的总降雨量为1014 mm,丰水期4─9月份,月平均降雨量为205 mm,枯水期1─3月和10─12月的月平均降雨量只有26 mm;大沙河水库库区降雨量高达2239 mm,丰水期4─9月份,月平均降雨量为312 mm,枯水期1─3月和10─12月的月平均降雨量为57 mm。高州水库水力滞留时间均值504 d,最高时在7月为1106 d,最低时在4月为114 d,全年水力滞留时间无明显变化规律;大沙河水库水力滞留时间最高值和最低值分别为 2月的962 d和10月的81 d,有明显的季节性,在丰水期相对较低,平均113 d,枯水期平均为886 d。高州水库水体透明度在0.85~3.12 m之间,平均值为2.11 m,丰水期低于枯水期;大沙河水库透明度总体比高州水库低,平均为1.72 m,在0.82~2.31 m之间;与高州水库相反,大沙河水库丰水期的透明度比枯水期的高一些。两座水库水体混合深度均为枯水期高于丰水期,丰水期混合深度均值都在5 m左右,而枯水期高州水库混合深度明显高于大沙河。因此真光层与混合层深度之比(Zeu/Zmix),大沙河显著(P<0.05)低于高州水库(图 2)。因此两座水库的水文水动力和物理特征的差别主要体现在水力滞留时间、透明度和Zeu/Zmix3个方面。
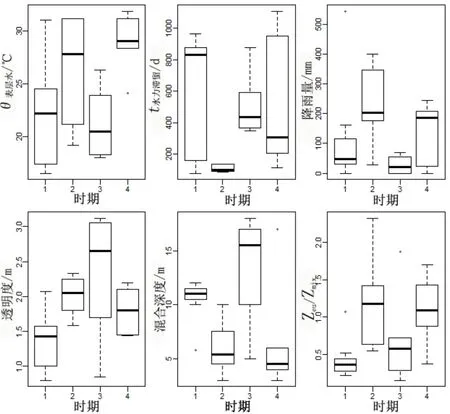
图2 高州水库和大沙河水库的水动力和物理特征比较Fig. 2 The compare of hydrodynamic and physical traits in Gaozhou and Dashahe reservoirs
2.2营养状态
高州水库的总氮浓度在0.59~1.28 mg·L-1之间,平均值为 0.79 mg·L-1;大沙河水库总氮浓度在0.59~1.79 mg·L-1之间,平均值为0.98 mg·L-1,两座水库均表现为总氮浓度在丰水期相对低。高州水库总磷浓度在0.005~0.026 mg·L-1之间,全年总磷平均浓度为 0.017 mg·L-1;大沙河水库总磷浓度在0.016~0.068 mg·L-1之间,其丰水期和枯水期差异极显著(P<0.01),丰水期4─9月总磷浓度较低,在0.023 mg·L-1以下,枯水期1─3月和10─12月较高在0.044 mg·L-1以上。两座水库的叶绿素a浓度有显著的差异(P<0.05),大沙河水库叶绿素a浓度明显高于高州水库,且在季节变化上,大沙河枯水期叶绿素a浓度明显高于丰水期,高州的季节差异不明显(图3)。

图3 高州水库和大沙河水库的营养盐浓度比较Fig. 3 The compare of nutrients concentration in Gaozhou and Dashahe reservoirs
高州水库可溶性氮浓度在0.44~0.73 mg·L-1之间,平均值为0.59 mg·L-1,枯水期浓度较低;大沙河水库可溶性氮浓度比高州水库的低,其浓度在0.083~0.57 mg·L-1之间,平均值为0.331 mg·L-1。两水库可溶性氮浓度存在极显著差异(P<0.01)。高州水库可溶性磷酸盐浓度除 4月份高于 0.005 mg·L-1以外,其他月份均低于0.005 mg·L-1,丰水期和枯水期无明显差异。大沙河水库可溶性磷总体比高州水库高,但也在0.01 mg·L-1以下,平均浓度为 0.006 mg·L-1,只有个别月份低于 0.005 mg·L-1。两水库可溶性磷浓度存在极显著差异(P<0.01)(图3)。
2.3蓝藻组成与季节变化
2.3.1蓝藻组成和生态宽幅
调查期间,两座水库共鉴定出蓝藻 14属,其中,高州水库12属,大沙河13属,两座水库蓝藻的种类组成较为相似,均以丝状体和团体状蓝藻为主,共有的蓝藻属有:色球藻 Chroococcus、鱼腥藻 Anabaena、微囊藻 Microcystis、蓝纤维藻Dactylococcopsis、假鱼腥藻 Pseudanabaena、隐球藻Aphanocapsa、拟柱孢藻Cylindrospermopsis、平裂藻 Merismopedia、颤藻 Oscillatoria、隐杆藻Aphanothece、粘球藻Gloeocapsa,其中色球藻、鱼腥藻、微囊藻、蓝纤维藻、假鱼腥藻、平裂藻和拟柱孢藻在两座水库中出现频率较高。浮丝藻Planktothrix和泽丝藻 Limnothrix只在高州水库检到,但浮丝藻不常见,泽丝藻常见;只在大沙河水库检出螺旋藻Spirulina,但不常见。其中以微囊藻和鱼腥藻的生态宽幅最大,其次为蓝纤维藻、粘球藻和色球藻(表1)。
2.3.2蓝藻生物量的季节动态
调查期间,高州水库蓝藻生物量整体较低,低于0.039 mg·L-1。8─10月相对较高,在0.025 mg·L-1以上,其余月份均不足0.01 mg·L-1。蓝藻优势种类为:蓝纤维藻、假鱼腥藻、泽丝藻和微囊藻(图4)。
蓝纤维藻是最重要的蓝藻种类,12次采样中,除1月份外,在所有样品中均有检出,其平均生物量为0.0032 mg·L-1,在2月份和4─7月份生物量较高,其生物量占蓝藻总生物量的80%以上;假鱼腥藻在8月份生物量较高,为0.025 mg·L-1,占当月蓝藻总生物量约80%;泽丝藻在9月份的优势相当明显,生物量为 0.035 mg·L-1,占当月蓝藻总生物量的91%;微囊藻生物量在3月和10月较高,分别为0.005和0.016 mg·L-1,占到蓝藻总生物量的59%以上(图4)。
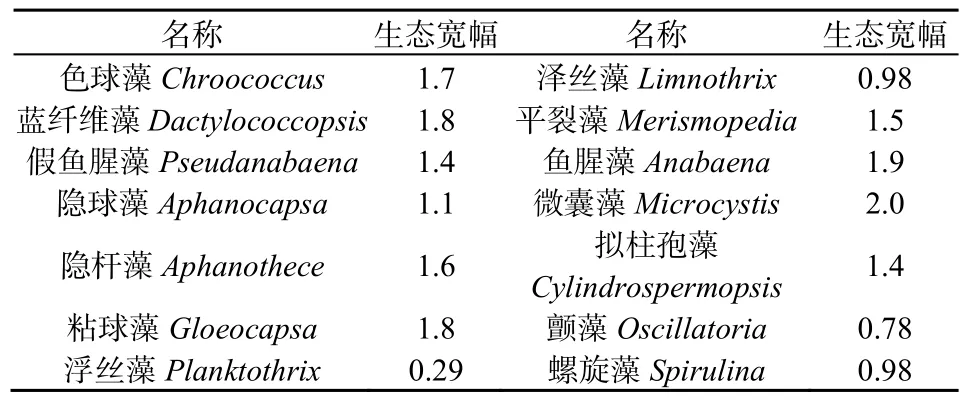
表1 蓝藻的组成及其生态宽幅Table 1 The component of cyanobacteria and their ecological breadth
大沙河水库蓝藻总生物量季节变化规律与高州水库的恰好相反,3─10月相对较少,最低生物量在6月份,为0.23 mg·L-1。1─2月和11─12月,大沙河水库蓝藻生物量均高于3 mg·L-1,其中12月份为12.36 mg·L-1为最高值。大沙河水库优势蓝藻为鱼腥藻和微囊藻。鱼腥藻和微囊藻在全年的样品中均有被检测到。鱼腥藻生物量占蓝藻总生物量的45.6%~99.6%,是大沙河水库全年绝对的优势蓝藻种类,生物量最高值为7.38 mg·L-1,出现在12月份,最低值为0.06 mg·L-1出现在8月份,枯水期平均生物量明显比丰水期高;微囊藻在1─10月份平均生物量只有0.04 mg·L-1,占蓝藻总生物量均不足10%,但是在11、12月份却大量繁殖,生物量分别增至1.35和4.44 mg·L-1;虽然蓝纤维藻在大沙河水库也为常见种,但从未占优势,相对生物量平均不足2%,最高相对生物量也只有8%;假鱼腥藻偶有检出,相对生物量最高只有0.01%(图4)。
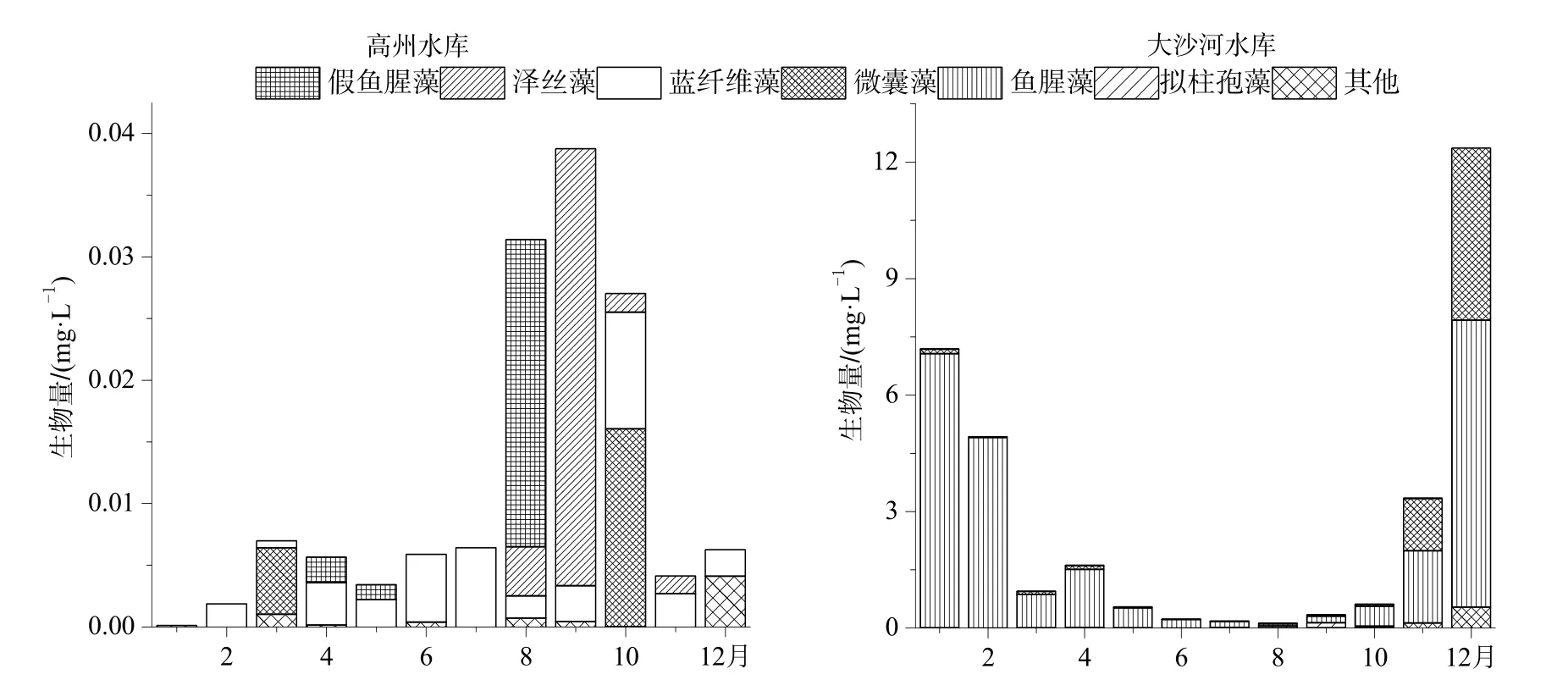
图4 高州水库和大沙河水库蓝藻生物量变化Fig. 4 The biomass variation of cyanobacteria species in Gaozhou and Dashahe reservoirs
2.4蓝藻群落与环境因子之间的关系
对两座水库的蓝藻总生物量和优势蓝藻与环境因子之间的相关性进行分析,结果表明,蓝藻与总磷、总氮浓度的相关性最高,相关系数在0.8以上,且极显著相关。其次与硝氮浓度和真光层深度呈极显著负相关,相关系数在0.55左右。正磷酸盐浓度、温度、水力滞留时间以及真光层与混合层之比也与蓝藻生物量有显著相关性,相关系数在0.4~0.5之间(表2)。
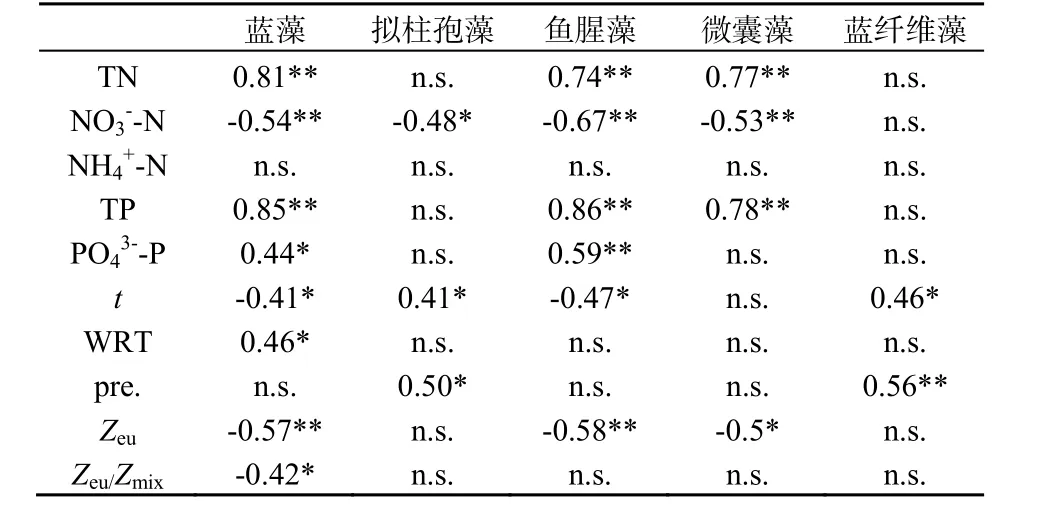
表2 环境因子与蓝藻生物量之间的相关性Table 2 Correlation analysis between biomass of cyanobacteria and environmental factors
拟柱孢藻的生物量在两座水库中均不高,只在个别时期较多,其生物量与硝氮浓度、温度和降雨有显著相关性。鱼腥藻生物量与总氮浓度、总磷浓度、硝氮浓度、正磷酸盐浓度和真光层深度呈极显著相关性,与温度呈显著相关。微囊藻生物量与总氮浓度、硝氮浓度和总磷浓度呈极显著相关性,与真光层深度呈显著相关。蓝纤维藻与温度和降雨有显著相关性。泽丝藻和假鱼腥藻的生物量较低,且只在个别月份出现较多,在分析中与 10个环境变量都没有显示显著相关性。
进一步对拟柱孢藻、鱼腥藻、微囊藻、蓝纤维藻、假鱼腥藻和泽丝藻与环境变量进行冗余分析(RDA),结果表明,7个环境变量对蓝藻的群落有显著(P<0.05,ANOVA)的作用,即TN、NO3--N、TP、PO43--P、t、Zeu和Zeu/Zmix。7个变量对蓝藻群落变化的解释量为88%。对变量与群落的相关性进行分析,7个变量中总磷浓度与群落相关性最高(R2=0.72,P=0.001,ANOVA),其次为温度(R2=0.06,P=0.009,ANOVA)和硝氮浓度(R2=0.038,P=0.025,ANOVA)。微囊藻和鱼腥藻在大沙河水库为优势种,生物量相对于其他种类要高得多,因此在RDA分图中其他种类的轴很短,集中在中心点附近(图5)。

图5 环境因子与蓝藻群落的RDA分析Fig. 5 The ordination diagram of Redundancy Analysis with environmental factors and cyanobacteria assemblage
3 讨论
蓝藻分布极广,从低纬度的赤道热带地区到高纬度的极地寒带地区都有分布。寒带地区夏半年极昼冬半年极夜,终年严寒,蓝藻很少以团状或丝状的大群体形式存在于淡水水体中,更常见的是单细胞粒径为 pico级的球型或丝状种类(Vincent,2002)。常见蓝藻为耐低温的聚球藻(Synechococcus)、颤藻(Oscillatoria)和席藻(Phormidium)(Hawes,1990;Vincent,2002;Spaulding et al.,1994;McKnight et al.,2000),其中席藻在冬季极夜时可以通过自身的调节悬浮在翌年夏季真光层的最大深度位置,以确保在夏季能够复苏(McKnight et al.,2000)。在温带和亚热带地区,温度和光照季节性变化明显,是引起蓝藻季节性变化的主要非生物因子(Reynolds,1984;Richardson et al.,2000)。蓝藻群落的生长通常在夏季达到峰值,且其优势随着秋冬季水温逐渐下降而减弱(Carr et al.,1982)。高州水库与大沙河水库均位于热带季风气候区,水温常年较高(>15 ℃),微囊藻和鱼腥藻是大沙河水库的主要蓝藻,其丰度在冬季最高;蓝纤维藻是高州水库最主要的蓝藻,其最大丰度出现在夏季,可见热带地区蓝藻的季节动态与其他气候带的蓝藻群落动态有明显的差异,其群落演替的机制与其他地区不同。
温度对藻类的生长有重要作用。在自然水体中,温度对蓝藻生长的作用包括直接作用和间接作用。直接作用即温度对细胞新陈代谢速率的影响,实验室培养的研究结果表明在15~30 ℃范围内,蓝藻的生长与温度呈正相关关系;间接作用主要体现在太阳辐射导致的水体温度升高、水体分层以及水体稳定性升高,阻止水层之间营养盐的循环,降低营养盐的可获得性,从而限制蓝藻的生长,在数据分析上表现为温度与蓝藻的负相关关系。本研究中,温度与蓝藻生物量呈现极显著的负相关关系,因此判断,在热带大型水库中温度对蓝藻生长的作用主要以间接作用为主。结果表明两座水库均有明显的分层,4─9月份为分层期;在温度较低的冬季水体混合增强,甚至完全混合。营养盐的数据结果也表明,两座水库枯水期营养盐高于丰水期,尤其是在水体较浅且呈富营养化的大沙河水库,水体混合较强的枯水期营养盐浓度显著高于丰水期,高浓度营养盐和适宜的温度导致浮游植物,主要是蓝藻生物量的增加。
对比两座水库营养盐的浓度和溶解态氮的组成发现,两座水库溶解态氮浓度均较高,高州水库以硝氮为主,大沙河水库尤其是枯水期以氨氮为主;两座水库溶解态磷浓度均较低,磷限制水体藻类生长,高州水库溶解态磷的可获得性低于大沙河水库。溶解态氮和磷的差异可能是导致两座水库蓝藻群落结构差异的主要原因,统计结果也表明硝氮和磷酸盐浓度的变化对蓝藻群落的变化有重要的作用。
多数蓝藻具有适应低光的能力,因此光可获得性可能对蓝藻的群落结构有重要的作用。两座水库光可获得性的季节规律一致,即丰水期高而枯水期低。然而,大沙河水库的光可获得性明显低于高州水库。同时光可获得性的季节特征与水体分层一致,丰水期水体分层,枯水期水体混合。综合以上分析,两座水库在水体理化环境上均有明显的季节性:枯水期水体混合增强,光可获得性降低,水层之间营养盐循环增强,内源性营养盐的可获得性增加;丰水期水体分层,光可获得性较高,内源性营养盐可获得性降低。
对比两座水库的蓝藻生物量,高州水库蓝藻的生物量远低于大沙河水库,这与两座水库营养水平有关。高州水库为中营养水体,蓝藻的生物量较低;大沙河水库为富营养水体,蓝藻生物量较高。其他研究结果也表明,在贫、中营养水体中,蓝藻往往不是浮游植物的优势类群,水体主要以绿藻或硅藻为主,而在富营养水体中,蓝藻多成为浮游植物的优势类群(Kalff,2002;Reynolds,2006)。多元统计的结果表明,营养盐尤其是总磷是解释两座水库蓝藻群落动态最重要的因子。
在种类组成上,大沙河水库以微囊藻和鱼腥藻等具有伪空泡的种类为主,这类蓝藻可通过伪空泡的浮力调节机制竞争光源,这与大沙河光可获得性较差相符合。而高州水库以蓝纤维藻、假鱼腥藻和泽丝藻等不具备或很少具有伪空泡的丝状种类为优势类群,这类丝状藻具有较大的比表面积,对低营养盐浓度的环境有较好的适应能力,与高州水库极低的溶解态磷相符。虽然微囊藻、鱼腥藻、蓝纤维藻和色球藻等种类的生态幅都较宽,但是其优势度受其生理特征和环境条件共同影响,在两座水库有明显的分布差异。蓝纤维藻细胞呈纤细的纺锤型,它的比表面积较大,对低营养盐环境有较好的适应能力,同时对高温环境耐受能力也较为突出(Walsby et al.,1983;Reynolds,1984)。在高州水库温度较高的丰水期,蓝藻是优势种。此外蓝纤维藻具有较高的上浮速度,能调整类胡萝卜素的合成,在低光环境中呈蓝绿色,在高光环境中呈深橙色,因此,光不易限制其生长(Walsby et al.,1983)。统计结果也表明温度和降雨与蓝纤维藻的种群动态关系最显著。鱼腥藻和微囊藻均能够耐受低磷环境(Walsby et al.,1983),因此在两座水库中均有分布。此外微囊藻和鱼腥藻具有浮力调节机制,使其在光限制水体能够获得充足的光照(Reynolds et al.,1987;Wallace et al.,2000;Jungo et al.,2001),因此在富营养的大沙河水库中,这两种藻类有更高的优势。
在季节动态上,两座水库蓝藻生物量差异较大,高州水库为丰水期更高,而大沙河水库为枯水期更高。高州水库营养盐较低,尤其是溶解态磷常低于 0.005 mg·L-1,浮游植物受到营养盐的限制;此外由于水体深度大(湖泊区水深在25 m以上),底部营养盐向上层水体输送的内源循环也相对较弱,因此外源营养的补充对浮游植物的生长很重要。丰水期大量的降雨,导致入库径流增加,外源营养的补充增加,有利于藻类生长。本研究表明丰水期高州水库的蓝藻生物量明显高于枯水期。大沙河水库为富营养水体,底部营养盐浓度很高,虽然丰水期外源营养的补充高于枯水期,但是由于水体分层,高营养的下层水受到隔离,内源循环受到抑制;而在枯水期,虽然外源径流较小,但水体混合导致高营养的底部水层不断与上层水交流,内源循环强烈,整个水体的营养盐浓度都较高,导致藻类快速增殖,此时光成为主要的限制因子,故对光具有较高竞争能力的蓝藻逐渐成为优势类群。本研究表明大沙河水库蓝藻生物量高峰期主要出现在枯水期。
4 结论
(1)热带大型水库蓝藻群落演替机制与温带、亚热带地区的有明显的差异,水华蓝藻的峰值出现在冬季。
(2)热带大型水库中温度对蓝藻的作用主要为间接作用,温度通过改变水体理化性质影响蓝藻的生长。
(3)温度、营养盐和光是影响热带地区蓝藻群落组成和季节动态的关键因素,水华蓝藻(微囊藻和鱼腥藻)在营养盐较高、光可获得性较低的枯水期有较高的生物量。
ADAMS D G, DUGGAN P S. 1999. Tansley Review No.107 Heterocyst and akinete differentiation in cyanobacteria [J]. New Phytologist, 144(1): 3-33.
BORCARD D, GILLET F, LEGENDRE P. 2011. Numerical ecology with R [M]. US: Springer.
BRETT M T, MÜLLER-NAVARRA D C.1997. The role of highly unsaturated fatty acids in aquatic food web processes [J]. Freshwater Biology, 38(3): 483-499.
CARR N G, WHITTON B A. 1982. The biology of cyanobacteria[M]. University of California Press: 467-471.
DE SENERPONT DOMIS L N, ELSER J J, GSELL A S, et al. 2013. Plankton dynamics under different climatic conditions in space and time [J]. Freshwater Biology, 58(3): 463-482.
DENG J, QIN B, PAERL H W, et al. 2014. Earlier and warmer springs increase cyanobacterial (Microcystis spp.) blooms in subtropical Lake Taihu, China [J]. Freshwater biology, 59(5): 1076-1085.
GHADOUANI A, PINEL-ALLOUL B, PREPAS E E. 2003. Effects of experimentally induced cyanobacterial blooms on crustacean zooplankton communities [J]. Freshwater Biology, 48(2): 363-381.
HAWES I. 1990. Eutrophication and vegetation development in maritime antarctic lakes [M]//Antarctic Ecosystems. US: Springer, 83-90.
JUNGO E, VISSER P M, STROOM J, et al. 2001. Artificial mixing to reduce growth of the blue-green alga Microcystis in Lake Nieuwe Meer, Amsterdam: an evaluation of 7 years of experience [J]. Water Science & Technology: Water Supply, 1(1): 17-23.
KALFF J. 2002. Limnology: inland water ecosystems[M]. New Jersey: Prentice Hall.
KILHAM S S, KREEGER D A, GOULDEN C E, et al. 1997. Effects of algal food quality on fecundity and population growth rates of Daphnia [J]. Freshwater Biology, 38(3):639-647.
KONOPKA A, BROCK T D. 1978. Effect of temperature on blue-green algae (cyanobacteria) in Lake Mendota [J]. Applied and Environmental Microbiology, 36(4): 572-576.
KROMKAMP J, VAN DEN HEUVEL A, MUR L R. 1989. Phosphorus uptake and photosynthesis by phosphate-limited cultures of the cyanobacterium Microcystis aeruginosa [J]. British Phycological Journal, 24(4): 347-355.
MCKNIGHT D M, HOWES B L, TAYLOR C D, et al. 2000. Phytoplankton dynamics in a stably stratified Antarctic lake during winter darkness [J]. Journal of Phycology, 36(5): 852-861.
NALEWAJKO C, MURPHY T P. 2001. Effects of temperature and availability of nitrogen and phosphorus on the abundance of Anabaena and Microcystis in Lake Biwa Japan: an experimental approach [J]. Limnology, 2(1): 45-48.
OLIVER R L, GANF G G. 2002. Freshwater Blooms: The Ecology of Cyanobacteria[M]. US: Springer, 149-194.
REYNOLDS C S, OLIVER R L, WALSBY A E. 1987. Cyanobacterial dominance: the role of buoyancy regulation in dynamic lake environments [J]. New Zealand Journal of Marine and Freshwater Research, 21(3): 379-390.
REYNOLDS C S. 1984. The ecology of freshwater phytoplankton [M]. Cambridge University Press.
REYNOLDS C S. 1998. What factors influence the species composition of phytoplankton in lakes of different trophic status? [J]. Hydrobiologia, 369: 11-26.
REYNOLDS C S. 2006. The ecology of phytoplankton [M]. Cambridge: Cambridge University Press.
RICHARDSON T L, GIBSON C E, HEANEY S I. 2000. Temperature, growth and seasonal succession of phytoplankton in Lake Baikal, Siberia [J]. Freshwater Biology, 44(3): 431-440.
ROBARTS R D, ZOHARY T. 1987. Temperature effects on photosynthetic capacity, respiration, and growth rates of bloom-forming cyanobacteria [J]. New Zealand Journal of Marine and Freshwater Research, 21(3): 391-399.
SPAULDING S A, MCKNIGHT D M, SMITH R L, et al. 1994. Phytoplankton population dynamics in perennially ice-covered Lake Fryxell, Antarctica [J]. Journal of Plankton Research, 16(5): 527-541.
VINCENT W F. 2002. Cyanobacterial dominance in the polar regions [M]//The ecology of cyanobacteria. Springer Netherlands: 321-340.
VISSER P M, IBELINGS B W, VAN DER VEER B, et al. 1996. Artificial mixing prevents nuisance blooms of the cyanobacterium Microcystis in Lake Nieuwe Meer, the Netherlands [J]. Freshwater Biology, 36(2): 435-450.
WALLACE B B, BAILEY M C, HAMILTON D P. 2000. Simulation of vertical position of buoyancy regulating Microcystis aeruginosa in a shallow eutrophic lake [J]. Aquatic Sciences, 62(4): 320-333.
WALSBY A E, VAN RIJN J, COHEN Y. 1983. The biology of a new gas-vacuolate cyanobacterium, Dactylococcopsis salina sp.nov., in Solar Lake [J]. Proceedings of the Royal Society of London B: Biological Sciences, 217(1209): 417-447.
WALSBY A E. 1994. Gas vesicles [J]. Microbiological Reviews, 58(1): 94-144.
WHITTON B A. 2012. Ecology of cyanobacteria Ⅱ: their diversity in space and time [M]. Springer Science & Business Media: 169-172.
Seasonal Dynamics of Cyanobacteria Assemblage in Tropical Large Reservoirs, South China——Using Dashahe and Gaozhou Reservoirs as Examples
YUAN Yiwen1, XIAO Lijuan1,2, HAN Boping1,2
1. Department of Ecology, Jinan University, Guangzhou 510632, China; 2. Guangdong Center of Protection and Control of Cyanobacterial Blooms, Guangzhou 510632, China
To understand the seasonal dynamics of cyanobacterial assemblages and the driving factors in tropical large reservoirs in southern China,the composition and seasonal variation of cyanobacterial assemblages and environmental variables were investigated monthly and the critical driving factors in two tropic large reservoirs were analysed in 2010 and 2011. Fourteen cyanobacterial genera were identified. No large difference was detected in components of cyanobacterial genera between the two reservoirs, but the community structure and seasonal dynamics were evidently different. Species with large ecological breadth mostly became dominant, such as Anabaena, Dactylococcopsis, Microcystis. Gaozhou Reservoir was mesotrophic, with cyanobacterial biomass below 0.039 mg·L-1. High biomass occurred in the wet season, with a dominance of filamentous species, such as Limnothrix, Pseudanabaena and Dactylococcopsis. Dashahe Reservoir was eutrophic, and the biomass of cyanobacteria was higher than 0.23 mg·L-1and dominated with Microcystis and Anabaena. The cyanobacterial bloom usually occurred in the dry season, when the biomass of cyanobacteria ranged within 3 to 12 mg·L-1. Redundancy analysis showed that 7 environmental factors, TP, TN, temperature, NO3--N, PO43--P, Zeuand Zeu/Zmix, had significant effects on cyanobacterial community structure. And TP was most closely correlated with cyanobacteria community structure, followed by TN and temperature. Compared with mesotrophic water, the availability of light was lower and the limitation of nutrients was weaker, and the cyanobacterial genera with pseudovacuoles became dominant. In eutrophic Dashahe reservoir, Microcystis and Anabaena maintained a population around the year, with highest biomass in winter, without the “dormancy”stage that occurs in winter in the temperate zone. The mechanisms of cyanobacterial community succession are different between the tropics and other zones (subtropics and temperate zone). The effect of temperature on the cyanobacterial community is therefore indirect.
tropics; large reservoir; cyanobacteria; seasonal variation
10.16258/j.cnki.1674-5906.2015.12.016
X17
A
1674-5906(2015)12-2027-08
国家自然科学基金项目(21314050);广东省水利科技创新项目(201102)
袁一文(1991年生),男,硕士研究生,研究方向为淡水生态学研究。E-mail: wofeishanbei@126.com *通信作者:肖利娟,助理研究员,主要从事水域生态学研究。E-mail: tljxiao @jnu.edu.cn
2015-04-28
引用格式:袁一文, 肖利娟, 韩博平. 热带大型水库蓝藻群落季节动态特征——以大沙河和高州水库为例[J]. 生态环境学报, 2015, 24(12): 2027-2034.
