转基因大豆MON89788实时荧光PCR检测方法的建立
2015-12-13张国丛周兴虎祝长青
刘 欣,张国丛,周兴虎,祝长青,黄 明,*
(1.南京农业大学食品科技学院,南京肉制品加工产业创新中心,江苏 南京 210095;2.石家庄市农林科学研究院,河北 石家庄 050041;3.南京佳邦食品有限公司,江苏 南京 211225)
转基因大豆MON89788实时荧光PCR检测方法的建立
刘 欣1,张国丛2,周兴虎3,祝长青1,黄 明1,*
(1.南京农业大学食品科技学院,南京肉制品加工产业创新中心,江苏 南京 210095;2.石家庄市农林科学研究院,河北 石家庄 050041;3.南京佳邦食品有限公司,江苏 南京 211225)
为实现转基因大豆MON89788的标识管理,针对转基因大豆MON89788的品系特异性序列设计引物和TaqMan探针,建立转基因大豆MON89788实时荧光聚合酶链式反应(polymerase chain reaction,PCR)检测方法,并对该方法的特异性、灵敏度和重复性进行检测。结果显示:建立的转基因大豆MON89788实时荧光PCR检测方法能扩增出127 bp的产物,特异性强,灵敏度达到0.1%,约为40 个单倍体基因组拷贝,检测重复性好,可成功应用于实际样品检测。因此,建立的转基因大豆MON89788实时荧光PCR检测方法可以应用于转基因大豆MON89788大豆及其制品的检测。
转基因大豆;MON89788品系;实时荧光PCR;品系特异性检测;转基因标识
自1996年转基因作物开始商业化种植以来,每年都以惊人的速度发展,截至2012年全球转基因作物种植面积达到1.703亿 hm2,几乎是1996年(170万 hm2)的100 倍[1]。转基因作物在解决全世界日益严重的粮食危机的同时,也带来了食品安全和环境安全方面的诸多争议[2]。为了防止转基因生物可能存在的安全性问题,许多国家和地区制定了包括转基因生物标签制度在内的安全管理措施。我国于2001年发布了《农业转基因生物安全管理条例》,明确规定了在中国境内销售的农业转基因生物应当有明显的标识[3]。
标识管理制度的实施依赖于转基因产品检测技术,转基因检测技术包括蛋白质检测技术和核酸检测技术。近些年来,基于核酸的实时荧光聚合酶链式反应(polymerase chain reaction,PCR)因其高灵敏度、高特异性、无污染、可定量等优点,已成为主流的转基因生物检测方法。根据目标核酸的位置不同,PCR检测策略可以分为4 种,即筛选PCR检测、基因特异性PCR检测、构建特异性PCR检测和品系特异性PCR检测[4]。与前3 种方法相比,品系特异性PCR是检测外源插入载体与植物基因组的连接区DNA序列,具有非常高的特异性和准确性[5],已经成为目前转基因检测方法研究的重点,至今已经有许多转基因作物品系特异性检测方法建立并应用,如转基因大豆A2704-12和A5547-127[6]、转基因大米KMD1[7]、转基因玉米LY038[8]、转基因油菜Topas 19/2[9]。
转基因大豆MON89788品系是美国孟山都公司研发抗草甘膦大豆品种,已先后在美国、加拿大、日本和哥斯达黎加4 个国家商业化种植,并在菲律宾、澳大利亚、新西兰、墨西哥等11 个国家和地区批准用于食品和饲料加工原料[10]。我国虽然不种植转基因大豆,但是每年进口几千万吨转基因大豆用于食品或饲料加工原料,转基因大豆MON89788已于2011年批准进口我国用作加工原料[10]。本研究基于转基因大豆MON89788品系特异性序列设计引物和探针,建立转基因大豆MON89788实时荧光PCR检测方法,以实现转基因大豆MON89788的安全监管,满足转基因标识的需要。
1 材料与方法
1.1 材料与试剂
转基因大豆MON89788、A2704-12、A5547-127、GTS40-3-2,转基因玉米MON810、T25、BT176、BT11,转基因大米Bt63、KF6,转基因油菜GT73、MS8,非转基因大豆,质粒标准分子pMD19TMON89788以及相关检测样品(大豆颗粒、豆腐干、豆粕、豆奶粉) 江苏出入境检验检疫局动植物与食品检测中心。
植物基因组DNA提取试剂盒(DNAsecure Plant Kit,目录号:DP320-02) 北京Tiangen公司;TaqMan实时荧光定量PCR预混液FastStart Universal Probe Master(Rox,2×) 南京莱普泰生物科技有限公司;PCR引物与探针由上海辉睿生物技术有限公司合成。
1.2 仪器与设备
搅拌器 德国Vorwerk公司;杂交炉 德国GFL公司;J-E冷冻离心机 美国Beckman公司;Centrifuge 5417C微型离心机 德国Eppendorf公司;MB-102恒温振荡金属浴 日本Bioer公司;C130-1230V手掌离心机 美国Labnet公司;NanoDrop 1000微量紫外分光光度计 美国Thermo公司;LightCycler 480 II实时荧光PCR扩增仪 瑞士Roche公司。
1.3 方法
1.3.1 制样与DNA提取
固体样品大豆颗粒、豆腐干、豆粕称取约200 g样品,在经彻底清洗的合适粉碎装置中,将样品均质为粉末颗粒大小约0.5 mm。粉碎器皿清洗的具体步骤为40 ℃含有清洁液的温水中浸泡30 min,使用毛刷刷洗2 次,转移至清水中使用干净的毛刷刷洗4 次,用长流水冲洗10 min,吹风机吹干或者自然风干。
按照Tiangen试剂盒说明提取1~2 g样品DNA,DNA纯度应符合PCR检测要求。
1.3.2 实时荧光检测方法的建立及优化
根据GenBank上公布的转基因大豆MON89788的基因序列(登录号:FB572992.1),应用Primer Premier 5.0软件,设计出转基因大豆MON89788品系特异性引物和探针,使用荧光基团FAM作为探针的发光基团,扩增长度为127 bp。引物和探针见表1。

表1 转基因MON89788实时荧光PCR检测方法的引物、探针Table1 Primers and probe for real-time PCR
PCR反应体系为25 μL,包括2~5 μL DNA模板(50~200 ng),12.5 μL FastStart Universal Probe Master(Rox,2×),正、反向引物和探针,去离子水补齐体积。PCR反应条件为:95 ℃预变性10 min;95 ℃变性15 s;60 ℃退火1 min;45个循环。对两个引物和探针浓度进行优化,引物浓度优化梯度为400、300、200、150 nmol/L,相应探针浓度为引物浓度的一半,适宜的引物和探针浓度组合范围根据Ct值、荧光强度和扩增曲线确定。
1.3.3 特异性检测
以转基因 大豆MON89788、A2704-12、A5547-127、GTS40-3-2,转基因玉米MON810、T25、BT176、BT11,转基因大米Bt63、KF6和转基因油菜GT73、MS8的基因组DNA为模板,每个样品DNA稀释至50 ng/μL,加入2 μL DNA进行转基因大豆MON89788实时荧光PCR检测,同时设置阴阳性及空白对照,阳性对照为质粒标准分子pMON89788,阴性对照为非转基因大豆基因组DNA,空白对照为无菌水。
1.3.4 灵敏度检测
将研磨好的纯合MON89788品系大豆和非转基因大豆干粉按照质量百分比进行混合,配制4个不同转基因含量样品,包括5%、1%、0.5%和0.1%。每个样品DNA稀释至10 ng/μL,加入5 μL DNA作为模板,进行转基因大豆MON89788实时荧光PCR检测,每个样品进行3次重复实验,同时设置空白对照。
1.3.5 重复性检测
将转基因大豆MON89788的阳性样品分为3 个标本,进行实时荧光PCR扩增,实验分为3 次进行,每次设置3 个平行。通过计算3 个标本Ct值的标准差(s)和变异系数(coefficient of variation,CV)验证实时荧光PCR检测方法的重复性。
1.3.6 实际样品检测
应用建立的转基因大豆MON89788实时荧光PCR检测方法,对江苏进口的申报为含有转基因大豆MON89788的货物以及出口或进行质控的大豆及其加工品进行转基因大豆MON89788检测。
2 结果与分析
2.1 样品总DNA的提取
使用试剂盒法提取植物样品总DNA,利用NanoDrop 1 000微量紫外分光光度计测定DNA的纯度和浓度,DNA的OD260nm/OD280nm接近1.8,初步判断这些样品DNA可以进行PCR检测。
2.2 实时荧光PCR检测方法的建立及条件优化
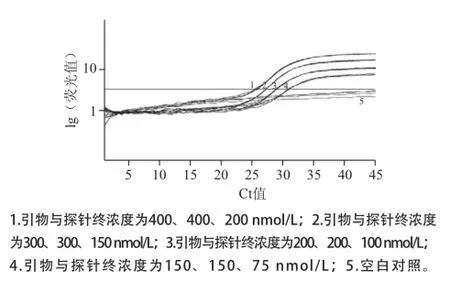
图1 转基因大豆MON89788实时荧光PCR检测方法引物与探针浓度优化Fig.1 Optimization of primer and probe concentrations for event-specific real-time PCR
不同的引物和探针终浓度配比结果如图1所示,引物与探针终浓度为150、150、75 nmol/L,200、200、100 nmol/L,300、300、150 nmol/L,400、400、200 nmol/L时均得到良好的扩增曲线,荧光强度依次增强,对应的Ct值分别为30.69±0.14、28.82±0.11、27.19±0.03、25.14±0.14,Ct值间存在极显著差异(P<0.01),不同的引物和探针终浓度对实验结果影响较大。在25 μL反应体系中,引物与探针终浓度为400、400、200 nmol/L时,即加入1 μL正、反向引物(10 nmol/L)和0.5 μL探针(10 nmol/L),可获得较高的扩增效率,扩增曲线呈典型的S型曲线。
2.3 实时荧光PCR检测方法的特异性
对转基因大豆MON89788、A2704-12、A5547-127、GTS40-3-2,转基因玉米MON810、T25、BT176、 BT11,转基因大米Bt63、KF6,转基因油菜GT73、MS8的基因组DNA进行扩增。如图2所示,只有转基因大豆MON89788基因组DNA与阳性对照成功扩增出转基因大豆MON89788品系特异性序列,其他11 种DNA样本及阴性对照、空白对照在45 个循环内没有出现实时荧光扩增曲线。可见,针对转基因大豆MON89788品系特异性序列的引物与探针特异性良好。

图2 转基因大豆MON89788实时荧光PCR检测方法特异性实验结果Fig.2 The specificity of event-specific real-time PCR
2.4 实时荧光PCR检测方法的灵敏度

图3 转基因大豆MON89788品系特异性实时荧光PCRR方法灵敏度实验结果Fig.3 The limit of detection of event-specific real-time PCR
对不同的转基因大豆MON89788含量的样品提取DNA,进行实时荧光PCR扩增。如图3所示,使用实时荧光PCR方法检测50 ng DNA模板中转基因含量为5%、1%、0.5%和0.1%的样品时,存在明显的扩增曲线,所得Ct值分别为29.65±0.11、32.11±0.06、33.20±0.06、35.57±0.20,Ct值均小于36。结果表明当转基因含量为0.1%时扩增良好,即建立的转基因大豆MON89788实时荧光PCR检测方法灵敏度可达0.1%,根据大豆基因组DNA大小[11](1 115 Mbp)计算,相当于约40 个单倍体基因组拷贝,能满足目前国际上的转基因标识制度的需要[12]。
2.5 实时荧光PCR检测方法的重复性
转基因大豆MON89788的阳性样品分为3 个标本,进行转基因大豆MON89788品系特异性检测,结果见表2,Ct值的标准差为0.12,CV为0.54% ,CV小于5%,在误差允许范围内。说明建立的转基因大豆MON89788实时荧光PCR检测方法重复性好,检测稳定性好。

表2 转基因大豆MON89788品系特异性实时荧光PPCCRR方法重复性实验结果Table2 Repeattability of event-specific real-time PCR
2.6 实时荧光PCR检测方法的实际应用
应用上述建立的转基因大豆MON89788实时荧光PCR检测方法,对江苏进口的70 批申报为含有转基因大豆MON89788的货物(大豆颗粒、豆粕)进行了检测,所有样品判断为阳性的条件为Ct值小于36,Ct值大于36判断结果为阴性,转基因大豆MON89788检测结果均为阳性,符合申报内容。同时对出口或进行质控的30 个大豆及其加工品(豆腐干、豆奶粉)进行转基因大豆MON89788检测,检测结果均为阴性。
3 讨论与结论
目前为止,已经有8 种转基因大豆品系(GTS40-3-2、A2704-12、MON89788、DP356043、DP305423、CV127、MON87701、MON87701×MON89788)被批准作为加工原料进入中国,各种与转基因大豆相关的产品越来越多地进入市场,同时转基因大豆及其制品的安全性问题也越来越受到人们的关注与讨论。为了保障消费者的知情权和选择权,建立准确、高效、快速的转基因大豆检测技术至关重要。
转基因检测技术可以分为蛋白质检测技术和核酸检测技术两大类。蛋白质检测技术主要包括蛋白质印迹法、酶联免疫吸附法等,存在检测成本高、所需时间长、蛋白质稳定性差等缺点,目前该类检测技术在实际工作中较少涉及;核酸检测技术主要包括PCR技术、分子杂交技术和基因芯片检测技术等,由于检测灵敏度高、特异性强、适用范围广、操作简便等原因已广泛地应用于各种转基因食品的日常检测中[13]。核酸检测技术中的TaqMan实时荧光PCR技术实现了对整个PCR过程的实时监测,省去了常规PCR中电泳等后续处理,有效解决了核酸的交叉污染问题,此外在PCR反应体系中加入TaqMan探针,使得非特异性产物不能与探针杂交从而增加了检测特异性,是目前应用广泛的转基因检测技术[14],已经成功应用于多种转基因植物的检测[15-17]。
在转基因植物中,外源插入DNA片段一般包括启动子、目的基因和终止子3 类元件,因此针对PCR扩增的目标序列的不同,其检测特异性也有很大差别。品系特异性PCR检测是通过检测外源插入DNA与植物基因组DNA的连接区序列实现的,由于外源插入载体的插入位点是唯一的,并且连接区序列是单拷贝的,所以品系特异性检测方法具有很高的特异性,能够区分具有相同构建的转基因品系[4-5]。本研究基于转基因大豆MON89788品系特异性序列建立了转基因大豆MON89788实时荧光PCR检测方法,灵敏度为0.1%,约为40个单倍体基因组拷贝,与欧盟研究中心的MON89788检测方法[18]相比更加灵敏,能够满足转基因检测需要,同时引物扩增片段长度短(127 bp),也适用于加工产品的检测。另外该方法和Kim[19]、李飞武[20]等建立的品系特异性常规PCR方法相比,检测灵敏度相近,操作简便,省去了PCR后续的电泳步骤,避免了对人体有害的染色剂溴化乙锭等的使用,减少了造成污染和假阳性的机会。
本研究建立的用于转基因大豆MON89788品系特异性检测的TaqMan实时荧光PCR方法特异性强、灵敏度高,可以应用于转基因大豆MON89788及其制品的检测,以满足转基因大豆MON89788的标识需要,值得推广和使用。
[1] JAMES C. 2012全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2013, 33(2): 1-8.
[2] SINGH O V, GHAI S, PAUL D, et al. Genetically modified crops: success, safety assessment, and public concern[J]. Applied Microbiology and Biotechnology, 2006, 71(5): 598-607.
[3] 张大兵, 郭金超. 转基因生物及其产品检测技术和标准化[J]. 生命科学, 2011, 23(2): 195-204.
[4] HOLST-JENSEN A, R☒NNING S B, L☒VSETH A, et al. PCR technology for screening and quantification of genetically modified organisms (GMOs)[J]. Analytical and Bioanalytical Chemistry, 2003, 375(8): 985-993.
[5] TAVERNIERS I, WINDELS P, van BOCKSTAELE E, et al. Use of cloned DNA fragments for event-specific quantification of genetically modified organisms in pure and mixed food products[J]. European Food Research and Technology, 2001, 213(6): 417-424.
[6] LI Xiang, PAN Liangwen, LI Junyi, et al. A2704-12 and A5547-127[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13188-13194.
[7] BABEKOVA R, FUNK T, PECORARO S, et al. Development of an event-specific real-time PCR detection method for the transgenic Bt rice line KMD1[J]. European Food Research and Technology, 2009, 228(5): 707-716.
[8] ZHANG Nan, XU Wentao, BAI Weibin, et al. Event-specific qualitative and quantitative PCR detection of LY038 maize in mixed samples[J]. Food Control, 2011, 22(8): 1287-1295.
[9] WU Guang, WU Yuhua, LU Changming, et al. Event-specific qualitative and quantitative PCR detection of genetically modified rapeseed Topas 19/2[J]. Food Chemistry, 2009, 112(1): 232-238.
[10] ISAAA’s GM Approval Database[DB/OL]. http://www.isaaa.org/ gmapprovaldatabase/.
[11] ARUMUGANATHAN K, EARLE E D. Nuclear DNA content of some important plant species[J]. Plant Molecular Biology Reporter, 1991, 9(3): 208-218.
[12] MARMIROLI N, MAESTRI E, GULL☒ M, et al. Methods for detection of GMOs in food and feed[J]. Analytical and Bioanalytical Chemistry, 2008, 392(3): 369-384.
[13] 詹世红, 陈楚芹, 李聪, 等. 转基因食品常用检测方法的研究现状及展望[J]. 安徽农业科学, 2009, 37(29): 14066-14069.
[14] 吴永彬, 肖维威, 马文丽. 实时荧光定量PCR技术在转基因食品检测领域中的应用[J]. 生物技术通讯, 2011, 22(4): 575-579.
[15] 王小花, 傅春玲, 王国卿, 等. TaqMan实时定量PCR技术检测大豆转基因成分[J]. 食品科技, 2009, 34(2): 264-268.
[16] 吴孝槐, 路勇. 利用实时荧光PCR方法检测转Bt基因大米[J]. 现代食品科技, 2009, 25(2): 211-220.
[17] di PINTO A, ALFANO F, GIORDANO A, et al. Quantitative realtime polymerase chain reaction for the presence of geneticallymodified maize in breaded “ready-to-cook” food products[J]. Food Control, 2008, 19(10): 1002-1005.
[18] European Union Reference Laboratory for GM Food and Feed. Eventspecific method for the quantification of soybean line MON89788 using real-time PCR validation report[R]. Ispra, Italy: Biotechnology and GMOs Unit-Community Reference Laboratory, Institute for Health and Consumer Protection, Joint Research Center, European Commission, 2008.
[19] KIM J H, JEONG D, KIM Y R, et al. Development of a multiplex PCR method for testing six GM soybean events[J]. Food Control, 2013, 31(2): 366-371.
[20] 李飞武, 李葱葱, 董立明, 等. 转基因大豆MON89788转化体特异性定性PCR检测[J]. 安徽农业科学, 2010, 38(13): 6679-6682.
Establishment of Event-Specific Real-Time PCR Method for Detection of Genetically Modified Soybean MON89788
LIU Xin1, ZHANG Guocong2, ZHOU Xinghu3, ZHU Changqing1, HUANG Ming1,*
(1. Nanjing Innovation Center of Meat Products Processing, College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. Shijiazhuang Academy of Agricultural and Forestry Sciences, Shijiazhuang 050041, China; 3. Nanjing Jiabang Food Co. Ltd., Nanjing 211225, China)
For implementation of labeling regulations, an event-specific real-time PCR method for the detection of genetically modified soybean MON89788 was established in this study. Primers and TaqMan probe were designed based on the event-specific sequence of MON89788 soybean. The specificity, sensitivity and repeatability of the developed method were examined, respectively. The results showed that the method could amplify a 127 bp product specifically; the limit of detection was 0.1% in 50 ng of soybean genomic DNA, approximately corresponding to 40 soybean haploid genome copies; and this method had good repeatability and could be successfully applied to the detection of real samples. These results indicated that the strain-specific real-time PCR method was suitable for the identification of genetically modified soybean MON89788 and its products.
genetically modified soybean; MON89788 event; real-time PCR; event-specific detection; transgenic labeling
S565.1
A
1002-6630(2015)04-0193-05
10.7506/spkx1002-6630-201504038
2014-03-12
公益性行业(农业)科研专项(201303083-2);江苏省科技支撑计划项目(BE2014304);南京市生物农业项目(2013)
刘欣(1989—),女,硕士研究生,主要从事肉品加工与质量控制研究。E-mail:liuxin_ld@sina.com
*通信作者:黄明(1970—),男,教授,博士,主要从事肉品加工与质量控制研究。E-mail:mhuang@njau.edu.cn
