化学杂交剂SQ-1在谷子叶片和小穗中的残留消解动态
2015-12-13朱启迪翁群珠张改生于永昂赵卓军王军卫马守才
朱启迪,翁群珠,张改生*,巨 岚,张 姣,于永昂,赵卓军,牛 娜,王军卫,马守才
(西北农林科技大学农学院,国家杨凌农业生物技术育种中心,国家小麦改良中 心杨凌分中心,小麦育种教育部工程研究中心,陕西省作物杂种优势研究与利用重点实验室,陕西 杨凌 7121 00)
化学杂交剂SQ-1在谷子叶片和小穗中的残留消解动态
朱启迪,翁群珠,张改生*,巨 岚,张 姣,于永昂,赵卓军,牛 娜,王军卫,马守才
(西北农林科技大学农学院,国家杨凌农业生物技术育种中心,国家小麦改良中 心杨凌分中心,小麦育种教育部工程研究中心,陕西省作物杂种优势研究与利用重点实验室,陕西 杨凌 7121 00)
建立化学杂交剂SQ-1在谷子叶片和小穗中残留检测的高效液相色谱法,并研究其在谷子叶片和小穗中的消解动态。样品经乙腈提取,N-丙基乙二胺净化,外标法定量。该检测方法在1~1 000 mg/L范围内,化学杂交剂SQ-1质量浓度与色谱峰面积呈良好的线性关系,线性方程为y=30 377x+27 634,相关系数为0.999 9,最低检出限为0.05 mg/kg。在10~500 mg/kg添加范围内,化学杂交剂SQ-1在谷子叶片和小穗中的平均回收率为 87.0%~95.5%,相对标准偏差为0.74%~2.28%。结果表明:化学杂交剂SQ-1可以从谷子叶片运输到小穗中,在小穗中的动态变化呈现出“先升高后降低”的趋势。其在谷子叶片中的半衰期为1.83~2.08 d,在喷施21 d后叶片中几乎检测不到化学杂交剂SQ-1残留,而在小穗中的半衰期为25.21~28.41 d,其消解速 度明显慢于叶片中的消解速度。
谷子;化学杂交剂;残留;消解动态;高效液相色谱
谷子是我国重要的粮食作物,同时又具有很好的营养保健功效。特别是其营养价值非常高,含有丰富的蛋白质、氨基酸以及各种微量元素,在国外被誉为“营养之王”[1-4]。谷子还具有抗干旱、耐贫瘠、适应性广等优良特点[5-8],但与其他作物相比,谷子产量较低,不过谷子具有很强的杂种优势,尤其是谷子的繁殖系数高,可以通过杂交种来提高谷子的产量和品质[9-10]。我国在谷子杂种优势利用方面给予了足够的重视,并取得了很大的进展,先后开展了“显性雄性不育育种”[11]、“光温敏不育两系育种”[12-13]、“化学杀雄育种”[14]等方面的研究,其中化学杀雄具有选择亲本灵活,可以自由配制组合,无细胞质负效应等优点[15-18],具有很广泛的应用前景。
SQ-1是我国自主研制的一种新型化学杂交剂,主要应用在小麦[19]、小黑麦[20]、谷子[14]、糜子[21]等粮食作物上,具有很好的杀雄效果,雄性不 育率能达到95%~100%。但是谷子喷施完化学杂交剂SQ-1后,其植株中是否有化学杂交剂SQ-1残留以及化学杂交剂SQ-1的动态消解方面的研究,尚未见报道。目前,化学杂交剂SQ-1的提取方法主要有液-液萃取法[15]、固相萃取法[22]、分散固相萃取法[19]等,液-液萃取法和固相萃取法有机溶剂消耗量大、操作过程复杂、费力耗时等缺点,一般很少使用。本实验采用分散固相萃取法提取化学杂交剂SQ-1,高效液相色谱法检测了谷子叶片和小穗中化学杂交剂SQ-1残留,并研究了其在谷子植株中的消解动态,旨在为化学杂交剂SQ-1在谷子上的安全合理应用提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
五九爪软谷和榆林地方品种香谷由西北农林科技大学柴岩教授提供;化学杂交剂SQ-1标准品由陕西省作物杂种优势研究与利用重点实验室提供;甲醇、乙腈(均为色谱纯)、甲酸 天津科密欧化学试剂有限公司;硫酸镁、氯化钠(均为分析纯);分散净化剂N-丙基乙二胺(primary secondary amine,PSA);实验用水美国Milli-poreco公司超纯水系统所制纯水。
1.2 仪器与设备
LC-15C高效液相色谱仪(紫外-可见双波长检测器)、Wondasil C18色谱柱 日本岛津科技有限公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;Milli-Q Biocel超纯水机 美国Milli-poreco公司;SK-1快速混匀器 常州国华电器公司;移液器 德国Eppendorf公司;Filter Unit滤膜(0.22 μm)。
1.3 方法
1.3.1 田间样品处理和采集
实验材料种植于西北农林科技大学试验田,参照杂交小麦大 田生产化学杂交剂SQ-1的喷施剂量,本实验采用高剂量(5 kg/hm2)喷施,喷施时间为谷子八叶期,喷施部位为谷子叶片。采集喷施化学杂交剂6 h及1、3、6、10、21 d后的叶片和1、3、6、10、21 d后小穗,同时喷施相同体积的水作为空白对照。采用多点随机取样法采集样品,用液氮迅速研磨样品,磨碎后—20 ℃保存备用。
1.3.2 样品前处理
准确称取1 g磨碎后的样品于15 mL的带盖离心管中,加入4 mL水,超声波提取10 min(功率400 W)。加入2 g硫酸镁和0.2 g氯化钠,然后在混匀器上充分混匀,再加入50 ☒L甲酸和5 mL乙腈,剧烈振荡1 min,8 000 r/min离心3 min。取1 mL上清液于2 mL离心管中,加入25 mg PSA,然后在混匀器上充分振荡1 min,8 000 r/min离心3 min,取上清液过0.22 ☒m滤膜,待测。
1.3.3 色谱条件
色谱柱:岛津Wondasil C18(250 mm×4. 6 mm,5 μm);流动性:V(甲醇)∶V(水)∶V(乙酸)= 70∶30∶0.1;流速:1 mL/min;柱温度:25 ℃;紫外检测波长:283 nm;进样量:20 ☒L。
1.3.4 SQ-1标准曲线的绘制
用移液器准确地移取适量的化学杂交剂SQ-1原药,然后用超纯水逐级稀释,配制成质量浓度为1、10、20、40、60、80、100、250、500、1 000 mg/L的标准溶液。以色谱峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线。
2 结果与分析
2.1 方法的线性关系、灵敏度、准确度与精密度
按照1.3.3节色谱条件测定配制好的化学杂交剂SQ-1标样峰面积,以峰面积对溶液质量浓度进行线性回归,线性方程为y=30 377x+27 634(R2= 0.999 9),在1~1 000 mg/L范围内,化学杂交剂SQ-1质量浓度与色谱峰面积呈良好的线性关系,最低检出限为0.05 mg/kg(按RSN=3计算)。
取1 g谷子叶片空白样品,分别添加10、100、500 mg/kg三个水平的化学杂交剂SQ-1标准样品,进行添加回收率实验,每个添加水平重复6 次,取1 g谷子小穗空白样品,分别添加10、25、50 mg/kg三个水平的化学杂交剂SQ-1标准样品,进行添加回收率实验,每个添加水平重复6 次,按照上述前处理方法和色谱条件进行测定,结果见表1。化学杂交剂SQ-1在叶片和小穗中的回收率为87.0%~95.5%,相对标准偏差为0.74%~2.28%,符合农药残留检测分析的标准。化 学杂交剂SQ-1标准样品、谷子叶片空白样品和空白样品添加化学杂交剂SQ-1的色谱图见图1。
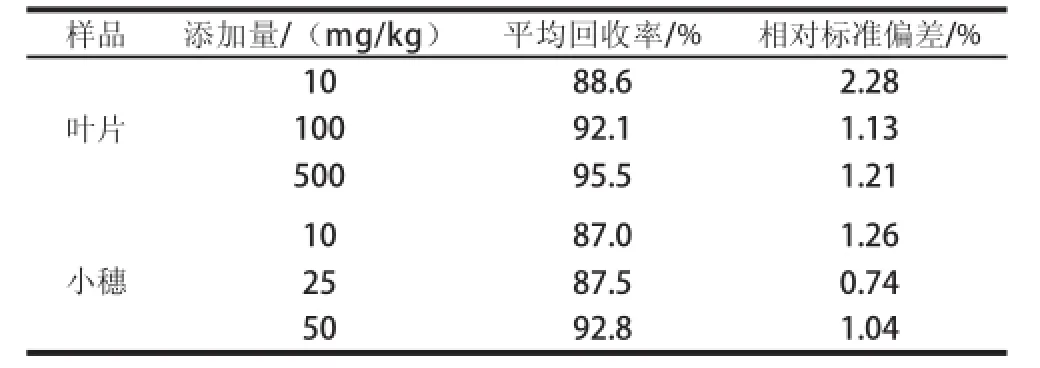
表1 化学杂交剂SQ-1的添加回收率Table1 Recoveries of chemical hybridizing agent SQ-1 in spiked samples

图1 SQ-1(100 mg/kg)(A)、空白叶片(B)和添加SQ--11(100 mg/kg)叶片(C)色谱图Fig.1 Chromatograms of SQ-1 (100 mg/kg) (A), blank leaves (B) and leaves spiked with SQ-1 (100 mg/kg) (C)
2.2 化学杂交剂SQ-1在谷子叶片中的消解动态
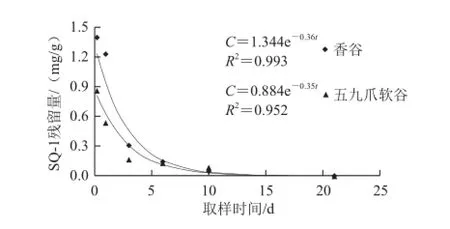
图2 化学杂交剂在谷子叶片中的消解动态Fig.2 Dynamic degradation curves of chemical hybridizing agent SQ-1 in foxtail millet leaves
谷子喷施化学杂交剂SQ-1后,在不同时间采样进行残留量测定分析。由图2可知:化学杂交剂SQ-1在谷子叶片中的残留量随着时间的延长而逐渐降低,其消解动态符合一级动力学方程。香谷在喷施6 h后叶片含量比较高,但是其消解速率比较快,它的消解曲线方程为C = 1.344e—0.36t,相关系数R2= 0.993,半衰期为t1/2= 1.83 d。五九爪软谷在喷施6 h后叶片含量比较低,但是其消解速率稍慢,它的消解曲线方程为C = 0.884e—0.35t,相关系数R2= 0.952,半衰期为t1/2= 2.08 d。
2.3 化学杂交剂SQ-1在谷子小穗中的消解动态
在谷子喷施化学杂交剂SQ-1后,运输到谷子小穗中需要一个过程,由图3可知,刚开始几天检测时其含量呈上升趋势,然后随着时间的延长又逐渐下降,其消解动态符合一级动力学方程,在香谷和五九爪软谷中消解曲线方程分别为C=168.4e—0.04t(R2= 0.992);C=128.2e—0.03t(R2= 0.948),降解半衰期分别为2 5.21 d和28.41 d。化学杂交剂SQ-1在香谷小穗中6 d后开始降解,而在五九爪软谷中3 d后就开始降解,这可能与谷子品种的特异性相关。
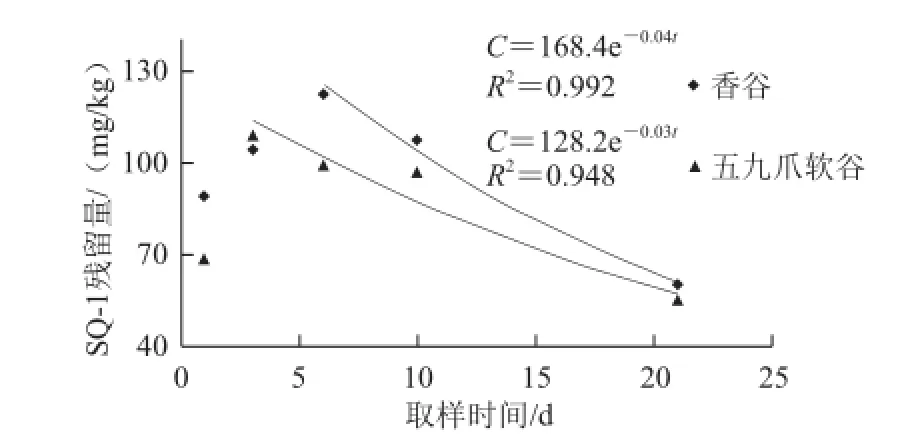
图3 化学杂交剂在谷子小穗中的消解动态Fig.3 Dynamic degradation curves of chemical hybridizing agent SQ-1 in foxtail millet spikelets
3 结 论
本实验建立了检测谷子叶片和小穗中化学杂交剂SQ-1残留的高效液相色谱法,前处理方法在QuEChERS方法基础上进行了改进,操作简单快捷,极大地提高了检测效率,完全符合农药残留分析的要求。研究结果表明:化学杂交剂SQ-1在谷子叶片的降解速度比较快,半衰期为1.83~2.08 d,而在谷子小穗中的降解速度比较缓慢,半衰期为25.21~28.41 d,呈现出“先增加后降低”的动态变化,它可以从谷子叶片运输到谷子小穗中,并在谷子小穗中积累然后随着时间的延长逐渐降解。化学杂交剂SQ-1喷施21 d后谷子叶片中几乎检测不到其残留,而小穗中还能检测到残留,一方面可能是因为喷施的剂量大于正常的剂量,从叶片运输到小穗中的化学杂交剂SQ-1比较多,另一方面是因为化学杂交剂SQ-1在小穗中降解比较缓慢。
[1] 王玉文, 李会霞, 田岗, 等. 谷子高异交结实雄性不育系的创制及应用[J]. 中国农业科学, 2010, 43(4): 680-689.
[2] 李国营, 朱志华, 李为喜. 谷子(Setaria italica)分子遗传研究进展[J].植物遗传资源学报, 2008, 9(4): 556-560.
[3] FUKUNAGA K, KAWASE M, KATO K. Structural variation in the Waxy gene and differentiation in foxtail millet [Setaria italica (L.) P. Beauv.]: implications for multiple origins of the waxy phenotype[J]. Molecular Genetics Genomics, 2002, 268(2): 214-222.
[4] KIM S K, SOHN E Y, LEE I J. Starch properties of native foxtail millet, Setaria italica Beauv.[J]. Journal Crop Science and Biotechnology, 2009, 12(1): 59-62.
[5] 张文英, 黄建明, 尉文彬. 我国谷子抗旱性研究进展[J]. 安徽农业科学, 2013, 41(4): 1469-1470.
[6] LATA C, PRASAD M. Association of an allele-specific marker with dehydration stress tolerance in foxtail millet suggests SiDREB2 to be an important QTL[J]. Journal of Plant Biochemistry and Biotechnology, 2014, 23(1): 119-122.
[7] 山仑, 徐炳成. 论高粱的抗旱性及在旱区农业中的地位[J]. 中国农业科学, 2009, 42(7): 2342-2348.
[8] FUKUNAGA K, KATO K. Mitochondrial DNA variation in foxtail millet, Setaria italica (L.) P. Beauv.[J]. Euphytica, 2002, 129(1): 7-13.
[9] 崔贵梅, 牛天堂, 张福耀. 谷子(Setaria italic Beauv.)高异交结实雄性不育系“81-16”的柱头性状观察[J]. 作物学报, 2007, 33(1): 149- 153.
[10] 夏雪岩, 刘正理, 程汝宏. 两个谷子新不育系几个性状的配合力评价和遗传力分析[J]. 中国农业科技导报, 2013, 15(1): 116-122.
[11] 袁进成, 石 云素, 胡洪凯, 等. 谷子显性雄性不育基因Msch的AFLP标记[J]. 作物学报, 2005, 31(10): 1295-1299.
[12] 赵治 海, 崔文生, 杜贵, 等. 谷子光(温)敏不育系821选育及其不育性与光、温关系的研究[J]. 中国农业科学, 1996, 29(5): 23-31.
[13] 郝晓芬, 王志民, 王根全, 等. SSR方法标记谷子光敏雄性不育基因[J].华北农学报, 2011, 26(5): 112-116.
[14] 宋瑜龙, 王亮明, 张改生, 等. 杀雄剂SQ-1诱导谷子雄性不育研究[J].作物学报, 2011, 37(9): 1695-1700.
[15] 朱启迪, 张改生, 赵新亮, 等. 超声辅助提取高效液相色谱法检测小麦籽粒中杀雄嗪酸的残留[J]. 分析化学, 2012, 40(3): 462-465.
[16] PARODI, GAJU M. Male sterility induced by the chemical hybridizing agent clofencet on wheat, Triticum aestivum and T. turgidum var. durum[J]. Ciencia E Investigacion Agraria, 2009, 36(2): 267-276.
[17] CHAKRABORTY K, DEVAKUMAR C. Evaluation of chemical compounds for induction of male sterility in wheat (Triticum aestivum L.)[J]. Euphytica, 2006, 147(3): 329-335.
[18] 张明珠, 袁蕾, 王俊生, 等. 顺乌头酸酶基因在杀雄剂SQ-1诱导小麦雄性不育花药中的表达分析[J]. 中国生物化学与分子生物学报, 2010, 26(8): 740-748.
[19] 朱启迪, 桑青, 王春平, 等. 高效液相色谱法测定小麦籽粒中杀雄嗪酸残留[J]. 分析化学, 2013, 41(4): 565-569.
[20] 张彩霞, 柴守诚, 董永梅. 等 化学杂交剂SQ-1诱导小黑麦雄性不育效果研究初报[J]. 陕西农业科学, 2005(3): 38-40.
[21] 崔秀辉. 化学杂交剂SQ-1诱导糜子雄性不育效果研究[J]. 作物学报, 2008, 34(1): 106-110.
[22] AOYAQI M, NIIYAMA K, NEMOTO S. Analytical method of clofencet in animal fishery products by LC/MS[J]. Journal of the Food Hygienic Society of Japan, 2011, 52(3): 156-160.
Residues and Decline of Chemical Hybridizing Agent SQ-1 in Leaves and Spikelets of Foxtail Millet
ZHU Qidi, WENG Qunzhu, ZHANG Gaisheng*, JU Lan, ZHANG Jiao, YU Yong’ang,
ZHAO Zhuojun, NIU Na, WANG Junwei, MA Shoucai (Key Laboratory of Crop Heterosis of Shaanxi Province, Wheat Breeding Engineering Research Center, Ministry of Education, Yangling Branch of State Wheat Improvement Center, National Yangling Agricultural Biotechnology & Breeding Center, College of Agriculture, Northwest A&F University, Yangling 712100, China)
A high performance liquid chromatography method was developed for determining chemical hybridizing agent SQ-1 and its dissipation curve in leaves and spikelets of foxtail millet. The samples were extracted with acetonitrile, cleaned up with N-propylethylenediamine (PSA) and quantified by the external standard method. There was a good linear relationship between the peak area and concentration of SQ-1 over the range from 1 to 1 000 mg/L, and the linear equation was y = 30 377x + 27 634, with a correlation coefficient of 0.999 9. T he lowest detectable concen tration was 0.05 mg/kg. The mean recoveries of SQ-1 in leaves and spikelet of foxtail millet varied from 87.0% to 95.5% with a relative standard deviation ranging from 0.74% to 2.28% at fortification levels of 10–500 mg/kg. The results indicated that SQ-1 could be transported from leaves to spikelets. The trend of SQ-1 residual dynamics was first increased and then decreased. The halflives of SQ-1 were 1.83–2.08 days in leaves and no SQ-1 pesticide residues were detected after 21 days. The half-lives of SQ-1 were 25.21–28.41 days in spikelets, and its degradation rate in spikelets was significantly lower than in leaves. Key words: foxtail millet; chemical hybridizing agent; residues; degradation kinetics; high performance liquid chromatography (HPLC)
S482.8
A
1002-6630(2015)04-0181-04
10.7506/spkx1002-6630-201504035
2014-03-25
国家高技术研究发展计划(863计划)项目(2011AA10A106);国家自然科学基金重大项目(311 71611;31371697);陕西省科技统筹创新工程计划课题(2014KTZB02-01-02)
朱启迪(1984—),男,博士研究生,研究方向为作物雄性不育机理。E-mail:zzhhqqdd@163.com
*通信作者:张改生(1951—),男,教授,博士,研究方向为作物杂种优势研究与利用。E-mail:zhanggsh58@aliyun.com
