茄枝多糖的分离纯化及成分分析
2015-12-13金莉莉王秋雨
魏 杰,吕 磊,金莉莉,王秋雨*
(辽宁大学生命科学院,辽宁 沈阳 110036)
茄枝多糖的分离纯化及成分分析
魏 杰,吕 磊,金莉莉,王秋雨*
(辽宁大学生命科学院,辽宁 沈阳 110036)
研究茄枝多糖的提取工艺和主要单糖组分。通过水提工艺,比较三氯乙酸(trichloroacetic acid,TCA)、Sevag、TCA与木瓜蛋白酶结合、Sevag与木瓜蛋白酶结合4 种脱除蛋白方法,使用DEAE-D22纤维素柱与Sephadex G-100柱层析精制获得茄枝多糖ESP1-1,并对其进行薄层色谱(thin layer chromatography,TLC)、高效液相色谱(high performance liquid chromatography,HPLC)检测与组分分析。木瓜蛋白酶与TCA法结合脱除蛋白效果最佳,蛋白清除率达到93%,多糖损失率为45.3%;TLC、HPLC检测与分析证明ESP1-1具有多糖的理化性质,主要由甘露糖、葡萄糖、果糖、木糖4 种单糖组成。研究结果可为茄枝多糖的开发应用提供理论支持。
茄枝多糖;分离纯化;单糖组成;高效液相色谱
多糖(polysaccharides)类化合物一般无细胞毒性,是开发抗肿瘤、免疫调节药物和功能性食品的重要原料。活性多糖成分是近年来研究的热点,利用天然多糖作为免疫调节剂有着广阔的应用前景。其中以植物多糖,尤其 是中草药中的水溶性多糖最为重要。植物多糖的生理药用作用明显,已经有多种多糖产品应用于保健、医疗方面,例如香菇多糖、灵芝多糖、虫草多糖等[1-3]。茄子在我国广泛种植,茄枝产量巨大,尚无任何加工利用。关于茄枝多糖(eggplant stick polysaccharide,ESP)的分离纯化、生物活性及药用价值等方面的基础研究尚未有报道。因茄枝来源广泛、价值低廉、收集方便,本实验以茄枝为原料,研究ESP提取工艺、理化性质、成分组成,为茄枝作为健康食品的原材料,以及ESP产业化生产提供理论支持。
1 材料与方法
1.1 材料与试剂
茄枝购自沈阳市场,经过烘干、粉碎后,过40 目筛真空包装保存备用。
木瓜蛋白酶、浓硫酸、三氯乙酸、无水乙醇、体积分数95%乙醇、苯酚、蒽酮、正丁醇、丙酮、氯仿、乙醚、异丙醇、磷酸、二苯胺、乙酸乙酯、乙酸、盐酸、氢氧化钠、氯化钠、阿拉伯糖(标准品)、半乳糖(标准品)、甘露糖(标准品)、木糖(标准品)、葡萄糖(标准品)、果糖(标准品)、碳酸钡、苯胺、1-苯基-3-甲基-5-吡唑啉酮、醋酸铵、乙腈(色谱级)、甲醇(色谱级)、G254硅胶板 国药集团化学试剂有限公司。
1.2 仪器与设备
2489高效液相色谱仪 美国Waters公司;DEAE-D22纤维素柱、Sephadex G-100 南宁东恒华道生物技术有限公司。
1.3 方法
1.3.1 ESP含量测定的工作曲线
精确移取葡萄糖标准溶液1 mL,加入体积分数4%苯酚溶液0.5 mL,摇匀,再加入5 mL浓硫酸,立即振荡,沸水浴中煮沸15 min,取出冷却至室温,另以1 mL蒸馏水作空白对照,重复以上步骤,于400~520 nm波长范围内测定吸光度[4],确定最大吸收波长为499 nm。
1.3.2 ESP提取工艺
参考相关研究结果[5-9],通过对料液比(茄枝与水的比)1∶50、1∶60、1∶70、1∶80、1∶90 5 个考察水平,提取温度50、60、70、80、90 ℃ 5 个考察水平,提取时间1.5、2、2.5、3、3.5 h 5 个考察水平,提取次数1、2、3、4、5 次5 个水平进行考察,进行单因素试验与正交试验的优化,得到最佳的ESP水提醇沉提取工艺。
1.3.3 ESP脱蛋白
分别使用三氯乙酸(trichloroacetic acid,TCA)法、Sevag法、TCA与木瓜蛋白酶解结合法、Sevag与木瓜蛋白酶解结合法对得到的ESP进行脱蛋白处理[10-13],重复6 次。用考马斯亮蓝染色法与苯酚-硫酸法分别测定4 种方法处理后的蛋白质含量以及多糖含量。
1.3.4 ESP纯化
ESP经过水提醇沉、脱蛋白后,分别通过DEAE-D22纤维素柱层析、Sephadex G-100柱层析纯化[14-18],收集多糖主峰,得到ESP1-1,低温浓缩后冷冻干燥。
1.3.5 ESP1-1的水解和薄层色谱(thin layer chromatography,TLC)分析
取纯化得到的ESP1-1样品20 mg,加1 mol/L硫酸10 mL,置于100 ℃水解8 h,取出冷却,加蒸馏水稀释,再用BaCO3中和至中性,过滤离心取上清液低温浓缩至5 mL得到ESP1-1单糖水解液,将半乳糖、葡萄糖、甘露糖、木糖、果糖、阿拉伯糖标准品以及水解后的ESP1-1样品在活化好的薄层硅胶板上分别点样,经展开剂展开,显色剂显色,观察各样点颜色与位置,初步判断ESP1-1样品的单糖组成[19-21]。
1.3.6 ESP1-1的高效液相色谱(high performance liquid chromatography,HPLC)分析[22-25]
将经过柱前衍生处理,离心取上清液并过滤所得的单糖标准品混合液和ESP1-1水解样品分别按照如下条件进行洗脱分析;HPLC条件为:Waters色谱系统;检测波长245 nm;色谱柱:Kromasil C18(150 m×4.6 mm,5 ☒m);柱温35℃;流速1 mL/min;进样量5 μL。流动相A乙腈,溶剂B醋酸铵pH 5.5;梯度模式:时间梯度,0 min→40 min→45 min→50 min,流动相B洗脱梯度:95%→10%→95%→95%,从所得洗脱图中可进一步判断ESP1-1样品中单糖组分。
2 结果与分析
2.1 ESP得率和脱蛋白
使用优化的水提醇沉提取ESP方法,ESP的提取率达到2.87%。对比4 种脱蛋白方法(Sevag法、TCA法、木瓜蛋白酶法与Sevag法结合、木瓜蛋白酶法与TCA法结合),将得到的ESP进行脱蛋白处理。由图1可知,不同的脱蛋白方法对蛋白脱除效果和多糖损失率影响差异很大,处理次数的增加能够提高蛋白脱除率,但是会伴随大量多糖的损失。采用与酶法结合的方法,可以很好地提高蛋白脱出效果,同时减少多糖的损失率。木瓜蛋白酶法与TCA法结合使用后,在处理4 次时,蛋白清除率达到93%,多糖损失率为45.3%,与其他3 种方法相比,在提高蛋白清除率的情况下降低多糖损失率,效果相对较好。
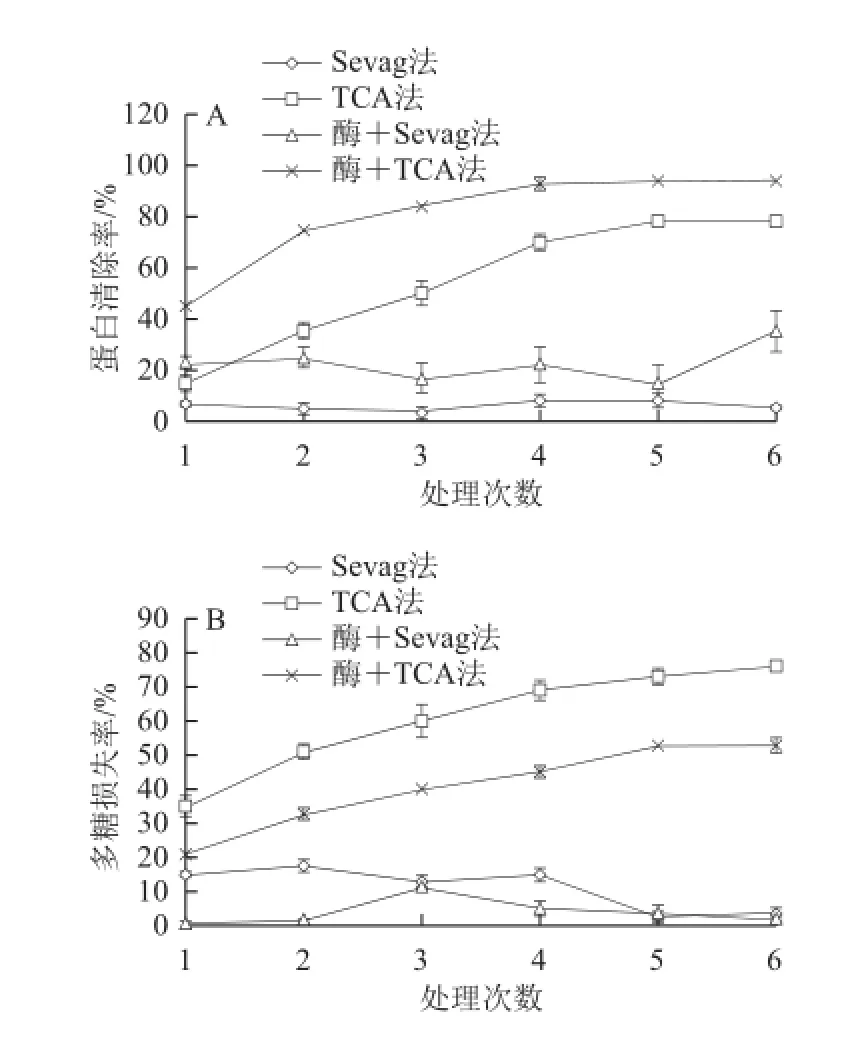
图1 4 种脱蛋白方法的蛋白清除率(A)、多糖损失率(B)比较Fig.1 Comparison of removal rates of protein and loss rates of polysaccharides with four deproteinization methods
2.2 ESP的DEAE-D22纤维素分离
将脱蛋白工艺后得到的ESP收集,冻干,获得纯化的ESP,将ESP过DEAE-D22纤维素柱进行初级分离[18]。由图2可知,经过纤维素柱洗脱后得到3 个组分,按先后顺序分别为ESP1、ESP2和ESP3。组分ESP1收集体积最大,约占90%。本实验仅对ESP1进行了进一步分离纯化和组分分析。

图2 DEAE-22纤维素层析柱洗脱曲线Fig.2 Elution curve of polysaccharide on DEAE-22 cellulose column
2.3 ESP的Sephadex G-100分离
将ESP1浓缩冻干,得到淡黄色粉末,经过Sephadex G-100进一步分离,得到一个单独的洗脱峰,合并收集洗脱峰,浓缩,冻干得到精制ESP1-1,将收集的ESP1-1按照同样的条件再进行一次Sephadex G-100分离处理,如图3所示,ESP1-1基本是成分单一的多糖。
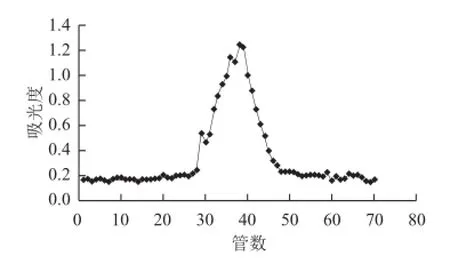
图3 Sephadex G-100层析柱洗脱曲线Fig.3 Elution curve of polysaccharide on Sephadex G-100 column
2.4 ESP的TLC分析

图4 ESP的TLCC结果Fig.4 TLC results of polysaccharides from eggplant branches
由图4可知,根据ESP1-1在TLC结果的位置可以初步判断ESP含有甘露糖和葡萄糖。
2.5 ESP的HPLC分析

图5 6 种单糖混合标准品(A)及ESP1-1(B) HPLC图谱Fig.5 HPLC chromatograms of mixture of six monosaccharide standards and ESP1-1
由图5可知,ESP1-1的单糖组成有葡萄糖、甘露糖、木糖和果糖。
3 结 论
本实验对ESP的提取工艺和单糖成分进行研究与分析。按照前期获得的水提醇沉工艺提取茄枝粗多糖,以蛋白清除率、多糖损失率为评价指标,选择酶法与TCA法相结合的方法脱除蛋白,经过DEAE-D22纤维素柱与Sephadex G-100柱层析进行分级分离,收集主要洗脱峰,合并洗脱液,浓缩、透析、冻干得到精制的纯ESP1-1。ESP1-1的TLC、HPLC检测与组分分析,证明ESP1-1主要由甘露糖、葡萄糖、果糖、木糖4 种单糖组成。本研究结果可为ESP的 开发应用提供理论数据支持。
[1] 邓小云, 丁登峰, 戴美红. 植物多糖药理作用研究进展[J]. 中医药导报, 2006, 12(9): 86-88.
[2] 王庭欣, 王庭祥, 庞佳宏. 植物多糖生活活性研究进展[J]. 食品研究与开发, 2005, 26(6): 200-201.
[3] 骆新峥. 植物多糖的研究现状[J]. 质量技术监督研究, 2010, 3(9): 46-50.
[4] 王玮. 苯酚-硫酸法测定猕猴桃根中多糖含量[J]. 药学进展, 2010, 34(5): 225-227.
[5] 陈军辉, 谢明勇, 聂少平. 西洋参多糖的定量测定[J]. 食品与生物技术学报, 2005, 24(5): 72-76.
[6] 张晓莉, 李玉婷, 王亚贤. 红花多糖的提取与含量测定[J]. 中国实验方剂学杂志, 2010, 16(7): 19-21.
[7] 孙汗巨, 潘丽军. 油菜花多糖的提取及纯化研究[J]. 食品科学, 2006, 27(12): 433-434.
[8] 郭金龙, 陈有君, 孙国琴. 苯酚-硫酸法测定杏鲍菇多糖方法的研究[J].食品科学, 2008, 29(12): 555-558.
[9] 王黎明, 夏文水. 蒽酮-硫酸法测定茶多糖含量的研究[J]. 食品科学, 2005, 26(7): 185-188.
[10] 佟苗苗, 瞿延君, 王添敏. 急性子多糖脱蛋白方法研究[J]. 中药材, 2011, 34(2): 296-298.
[11] 徐建祥, 晏志云, 赵谋明. 酶法脱蛋白技术用于螺旋藻多糖提取工艺的研究[J]. 食品与发酵工业, 1997, 24(3): 24-28.
[12] JUNG S, LAMSAL B P, STEPIEN V, et al. Functionality of soy protein produced by enzyme-assisted extraction[J]. Journal of the American Oil Chemists’ Society, 2006, 83(1): 71-74.
[13] 梁军, 夏永刚, 杨炳友. 麻黄多糖中蛋白含量测定及脱蛋白方法的比较[J]. 中医药学报, 2011, 39(2): 73-75.
[14] CHEN Ruizhan, LIU Zhiqiang, ZHAO Jimin, et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from Acanthopanax senticosus[J]. Food Chemistry, 2011, 127(2): 434-440.
[15] LIU Chun, WANG Hongling, CUI Zhumei, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4): 1310-1316.
[16] 常建红, 刘延吉, 田晓艳. 东北枸杞多糖分离纯化及鉴定[J]. 沈阳农业大学学报, 2009, 40(5): 616-619.
[17] 陶俊, 文汉. 油茶籽多糖分离纯化和结构分析[J]. 食品工业科技, 2011, 32(6): 132-135.
[18] LIU Huihui, FAN Yanli, WANG Wenhang, et al. Polysaccharides from Lycium barbarum leaves: isolation, characterization and splenocyte proliferation activity[J]. International Journal of Bilolgical Macromolecules, 2012, 51(4): 417-422.
[19] 张桂, 李俊英, 陈学武. 薄层层析法测定纤维素材料水解液中混合糖的研究[J]. 理化检验: 化学分册, 2002, 38(2): 81-82.
[20] LI Rui, CHEN Weichang, WANG Weipeng, et al. Extraction, characterization of Astragalus polysaccharides and its immune modulating activities in rats with gastric cancer[J]. Carbohydrate Polymers, 2009, 78(4): 738-742.
[21] 赵玉萍. 七种展层剂对真菌多糖组分分析的影响[J]. 食品工业科技, 2006, 27(11): 109-110.
[22] YANG Qian, WANG Siwang, XIA Yanhua. HPLC analysis of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes activity and Bax, Bcl-2 expression[J]. International Journal of Biological Macromolecules, 2010, 46(2): 167-172.
[23] 马晓丽, 孟磊, 孙莲. HPLC分析大蒜多糖中的单糖[J]. 中国现代应用药学杂志, 2007, 26(7): 585-587.
[24] WANG Dongying, ZHAO Yan, JIAO Yadong. Antioxidative and hepatoprotective effects of the polysaccharides from Zizyphus jujube cv. Shaanbeitanzao[J]. Carbohydrate Polymers, 2012, 88: 1453-1459.
[25] XU Hui, WU Pinru, SHEN Zhengyu. Chemical analysis of Hericium erinaceum polysaccharides and effect of the polysaccharides on derma antioxidant enzymes, MMP-1 and TIMP-1 activities[J]. International Journal of Biological Macromolecules, 2010, 47(1): 33-36.
Extraction and Monosaccharide Composition Analysis of Polysaccharides from Eggplant B ranches
WEI Jie, L☒ Lei, JIN Lili, WANG Qiuyu*
(School of Life Science, Liaoning University, Shenyang 110036, China)
Objective: To study the extraction and monosaccharide composition of polysaccharides from eggplant bra nches. Methods: The aqueous extract of eggplant branches was deprotenized by four different methods, trichloroacetic acid (TCA), Sevag, combination of TCA with papain, combination of Sevag with papa in. Further purification was conducted by DEAE-D22 cellulose and Sephadex G-100 gel column chromatograph sequentially. The obtained polysaccharide was analyzed by thin-layer chromatography (TLC) and high performance liquid chromatography (HPLC). Results: A polysaccharide, named as ESP-1, was obtained. Meanwhile, the best deproteinization method was achieved by the combined use of TCA and papain, resulting in a deproteinization rate of 93% and a polysaccharide loss of 45.3%. By TLC and HPLC, the polysaccharide was confirmed based on its physicochemical properties. In addition, ESP1-1 was mainly composed of mannose, glucose, fructose and xylose.
polysaccharide from eggplant branches; purification; monosaccharide composition; high performance liquid chromatography (HPLC)
Q78
A
1002-6630(2015)04-0168-04
10.7506/spkx1002-6630-201504032
2014-07-02
沈阳市科技计划项目(F12-277-1-40);辽宁省教育厅一般项目(L2013007)
魏杰(1977—),女,副教授,博士,研究方向为食品微生物工程。E-mail:weijie@lnu.edu.cn
*通信作者:王秋雨(1961—),男,教授,博士,研究方向为食品生物技术。E-mail:qiuyuwang@lnu.edu.cn
