MR扩散加权成像表观扩散系数与乳腺浸润性导管癌病理分级相关性研究
2015-12-13张卫苏丹柯罗宁斌金观桥谢东韦苇黄向阳康巍
张卫,苏丹柯,罗宁斌,金观桥,谢东,韦苇,黄向阳,康巍
广西医科大学附属肿瘤医院影像中心, 南宁 530021
随着MR技术的不断发展,扩散加权成像(diffusion-weighted imaging,DWI)作为MR功能学成像,已广泛应用于乳腺癌疾病的诊断,且有较高的敏感度及特异度。目前,DWI是MR探测活体水分子布朗运动的唯一手段,通过表观扩散系数(apparent diffusion coefficient,ADC)判断水分子布朗运动的受限情况[1-2]。乳腺浸润性导管癌不同病理分级间的肿瘤细胞密度、异型性及细胞内外容积大小等不同,对水分子热运动的情况影响不同。目前,国内外文献[3-5]均对乳腺癌不同病理分级与ADC值的相关性进行过探讨,但由于感兴趣区(region of interest,ROI)及测量方法不同,得出的结论亦不尽相同。本研究利用ADCmean和ADCmin对乳腺癌不同病理分级有无相关性进行探讨,以期得出更能反映乳腺癌病理分级的ADC值。
1 材料与方法
1.1 临床资料
收集我院2011年5月-2013年5月期间经术后病理证实乳腺癌66例,术前2~6周内均行MR检查,入组病例均为女性,年龄32~76岁,平均年龄51.61岁。入组病例均经有经验的病理科医生进行HE染色及病理分级。
1.2 设备和扫描方法
受检者取俯卧位,采用西门子公司Magnetom Avanto l.5 T超导磁共振仪,专用乳腺相控阵线圈,双侧乳腺自然悬垂于线圈,MR常规序列扫描参数:T1WI-FLASH,TR 8.6 ms,TE 4.7 ms;T2WI-TIRM,TR 5600 ms,TE56 ms,TI170 ms;动态增强扫描(DCE-MRI),TR4.43 ms,TE1.73 ms,层厚1 mm(连续无间断扫描),Flip angle 10°,FOV340×340 mm,矩阵=512×338。对比剂采用钆喷酸葡胺(Gd-DTPA),剂量0.1 mmol/kg,速率2 ml/s,对比剂团注结束后以相同速率注入20 ml生理盐水。增强前行蒙片扫描,注入对比剂后延迟25 s连续扫描5次;DWI序列使用单次激发平面回波成像(echo-planar imaging,EPI)技术取2个不同的扩散敏感系数b=0 s/mm2~800 s/mm2,TR5800 ms,TE83 ms图像输入西门子配套工作站,软件版本NU-MARIS 4自动生成ADC图。
1.3 ADC值测量
ROI划取整个病灶避开较明显的坏死、液化、出血、囊变及钙化区(参考T1WI、T2WI及DCE-MRI)等作为ROI,进行ADC值测量,取ROI的ADC均值及最小值,分别定义为ADCmean和ADCmin。ADC值测量均由放射科有经验的医生进行测量。
1.4 乳腺癌病理分级及分组
采用Elston和Ellis改良的Bloom-Richardson半定量分级法[6],根据腺管形成、核多形性异型性、核分裂像计数3项指标进行评分:(1)腺管形成>75%为1分,10%~75%为2分,<10%为3分;(2)核多形性异型性:相当于正常导管上皮、规则、一致为1分;大于正常导管上皮2.5倍,明显多形异形为3分;中间大小,中度多形异形为2分;(3)核分裂像计数:在细胞生长活跃区,视野直径0.44 mm,视野面积0.152 mm2,计数(/10HPF)核分裂0~5个为1分;6~10个为2分;≥11个为3分。以上3项相加,总分3~5分为Ⅰ级,分化好;6~7分为Ⅱ级,中分化;8~9分为Ⅲ级,分化差。首先依据以上病理分级将Ⅰ级、Ⅱ级、Ⅲ级相应的ADC值分为1、2、3三组;其次依据预后复发评估的不同分为A、B、C三组,将病理Ⅰ级且不伴有淋巴结转移纳入A组,病理Ⅱ级且不伴有淋巴结转移纳入B组,任何病理分级伴有淋巴结转移的及病理Ⅲ级纳入C组[5-6]。
1.5 统计学分析
计量资料以平均数±标准差(x±SD)表示,检验标准设定α=0.05,采用 SPSS19.0统计软件进行单因素方差分析(One-way ANOVA)、LSD检验、Spearman等级秩相关,分析ADC值与不同病理分级间是否存在相关性。

图1 浸润性导管癌病理Ⅰ级。A为ADC图,右乳外上象限见略低信号结节,ADCmean=1.368×10-3 mm2/s,ADCmin=1.062×10-3 mm2/s;B为病理图,镜下腺管>75%,细胞排列规则一致,异性型少,未见核分裂,病理分级为Ⅰ级(HE染色,×100)图2 浸润性导管癌病理Ⅱ级。A为ADC图,左乳内下象限见稍低信号结节,ADCmean=0.97×10-3 mm2/s,ADCmin=0.74×10-3 mm2/s;B为病理图,部分腺管形成,细胞多形性和异性型较明显,核浆比增大,核深染,病理分级为Ⅱ级(HE染色,×100)图3 浸润性导管癌病理Ⅲ级。A为ADC图,右乳外下象限见低信号肿物,ADCmean=0.896×10-3 mm2/s,ADCmin=0.444×10-3 mm2/s;B为病理图,细胞排列松散,细胞大小不一,形状各异,细胞核大深染,病理分级为Ⅲ级(HE染色,×100)Fig.1 Invasive ductal carcinoma grade Ⅰ,A:ADC map,hypointensity node in upper outer quadrant of the right breast,ADCmean=1.368×10-3mm2/s,ADCmin=1.062×10-3 mm2/s; B:Photomicrograph,an invasive ductal carcinoma SBR gradeⅠ,tubule formation >75%,normal pancreatic ductal epithelial,regular and fairly uniform(hematoxylin-eosin staining,original magnifi cation 100×).Fig.2 Invasive ductal carcinoma g rade Ⅱ,A:ADC map,hypointensity node in inferior inner quadrant of the left breast,ADCmean=0.97×10-3 mm2/s,ADCmin=0.74×10-3mm2/s; B:Photomicrograph,an invasive ductal carcinoma SBR gradeⅡ,nuclear pleomorohism was moderate,nuclear cytoplasm ratio increases,nuclear stained( hematoxylin-eosin staining,original magnification 100×).Fig.3 Invasive ductal carcinoma grade Ⅲ,A :ADC map,hypointensity node in inferior outer quadrant of the right breast,ADCmean=0.896×10-3mm2/s,ADCmin=0.444×10-3mm2/s.B:Photomicrograph,an invasive ductal carcinoma SBR gradeⅢ,nuclear pleomorphic was obviously,nuclear stained( hematoxylin-eosin staining,original magnifi cation 100×).
2 结果
在病理分级(即1~3)组中,采用One-way ANOVA检验,ADCmean值(F=0.963,P=0.387)在组内不存在统计学差异,ADCmin值(F=23.793,P=0.000)在组内差异显著,再对ADCmin值进行LSD检验两两比较(表1)。在预后复发(即A~C)组中,采用One-way ANOVA检验,ADCmean值(F=3.465,P=0.037)与ADCmin值(F=56.726,P=0.000)在组内差异均存在统计学意义,再经LSD检验进行两两比较,ADCmean值仅在B与C间差异显著,ADCmin值在各组间均差异显著(P<0.05)(表2)。对ADCmin值采用Spearman等级秩相关分析,ADCmin值在1~3组及A~C组中相关系数r分别为-0.615(P=0.000<0.01)、-0.754(P=0.000<0.01)。浸润性导管癌病理Ⅰ级、Ⅱ级、Ⅲ级相关图见图1~图3。
3 讨论
DWI是一种MR功能成像,是目前可以探测活体水分子热运动(布朗运动)惟一一种无创性检查,通过ADC值进行量化。现已证实ADC值对乳腺良恶性病变鉴别有较高的敏感性和特异性[7]。ADC受多种因影响,如细胞密度、细胞的排列方式、细胞外容积大小、细胞浆比、细胞膜等膜结构、大分子物质的吸附作用等影响。组织分化程度越低,细胞密度增加、排列紧密、细胞外容积减小,且肿瘤细胞内胞核增大、细胞器增多、胞浆减少致细胞内水分子运动减慢,故ADC值也越低。
3.1 ADC值与乳腺癌病理分级、预后复发组的相关性
本研究结果显示,ADCmean值在病理分级、预后复发组中均值差异均无统计学意义,与Kim SH等[5]报道的ADC值与传统预后因素如肿瘤大小、腋窝淋巴结转移情况、病理分级不具有相关性的结论一致。但Costantini M等[3]及邓丹琼等[4]指出乳腺癌病理级别越高,单位面积内腺管结构数量越多、肿瘤细胞密度越大及细胞异型性越显著,细胞核浆比就越大,细胞外容积就越小,水分子扩散受限就越显著,导致ADC值越低。因此,ADC值与病理分级具有相关性,乳腺癌的ADC值可以预测乳腺癌的分化程度,但邓丹琼等[4]报道的Ⅰ级(1.09×10-3mm2/s)、Ⅱ级(0.58×10-3mm2/s)、Ⅲ级(0.2×10-3mm2/s)值,与Costantini M等[3]报道的Ⅰ级(1.25×10-3mm2/s)、Ⅱ级(1.02×10-3mm2/s)、Ⅲ级(0.92×10-3mm2/s)和笔者的结果差异均较大,而本研究结果ADCmin值在病理分级、预后复发组中具有一定的相关性,以上种种究其原因,可能与以下方面有关。
乳腺浸润性导管癌的病灶内纤维化、微小液化及坏死区、黏液等不同病理成分对ROI内ADC值特别是最大值的影响,造成局部测量的ADCmean对肿瘤病理特性的反映存在一定的差异性[8]。
乳腺癌肿瘤内微血管密度(microvascular vessel density,MVD)、血管内皮生长因子表达(vascular endothelial growth factor,VEGF)等原因,导致乳腺肿瘤细胞生长速度不同,引起腺管数量、核多形性异型性及核分裂像数目不等,从而造成肿瘤内部水分子扩张受限程度不一致,Hirano M等[8]指出病灶内ADC最大值反映的是细胞最疏松区域,ADC最小值反映的是细胞最密集区域,所以,局部ADC值测量及病灶整体ADCmean值对肿瘤本身不同区域的细胞密度、细胞外容积等表达程度有一定的差异性,加上肿瘤病灶内纤维化、微小坏死灶等影响,特别是对ADC最大值的影响,导致ADC均值对肿瘤病理特性的反映存在一定的差异,ADCmin值可以更为准确的反映肿瘤内部病理分级程度、不同病理级别肿瘤分化的差异性[8],本研究结果也显示ADCmin值与病理分级具有一定的相关性。
Liu Y等[9]报道乳腺癌发生腋窝淋巴结转移的VEGF表达增加,乳腺癌VEGF表达增加,肿瘤内出现大量的新生毛细血管,引起肿瘤内MVD增加,这与Kanngurn S等[10]报道乳腺肿瘤MVD与腋窝淋巴结转移呈正相关结论一致,肿瘤内MVD增加,肿瘤细胞生长加快,促使细胞外容积变小,细胞密度增加,从而导致水分子扩散受限,ADC值减低。Pervez S等[11]发现肿瘤S期细胞比例(S-phase fraction,SPF)增高常伴有淋巴结转移,S期是DNA合成和复制的时期,SPF值是反映肿瘤增殖的较好指标,SPF值增大,肿瘤细胞增生活跃,细胞倍增时间短,细胞密度、核浆比增大,导致水分子扩散越受限,ADC越低。由此可以发现伴有腋窝淋巴结转移的乳腺肿瘤,大部分会伴有VEGF表达、MVD及SPF值较高,导致乳腺肿瘤ADC值较低,因此,乳腺癌伴有腋窝淋巴结转移的病灶ADC值常较低,这可能是导致ADCmin与A、B、C相关性较ADCmin与乳腺癌病理分级相关性密切的重要因素。
因此,本研究认为ADCmean与ADCmin选择不同对肿瘤病理分级、传统预后因素相关性评估存在差异,ADCmin值更能反映肿瘤的病理特征。
综上所述,ADCmin值可以作为对乳腺癌术前治疗方案的制定及预后复发进行初步评估的一种指标,ADCmin值与病理分级、预后复发组内具有一定的相关性,特别与A、B、C三级相关密切,呈显著负相关。
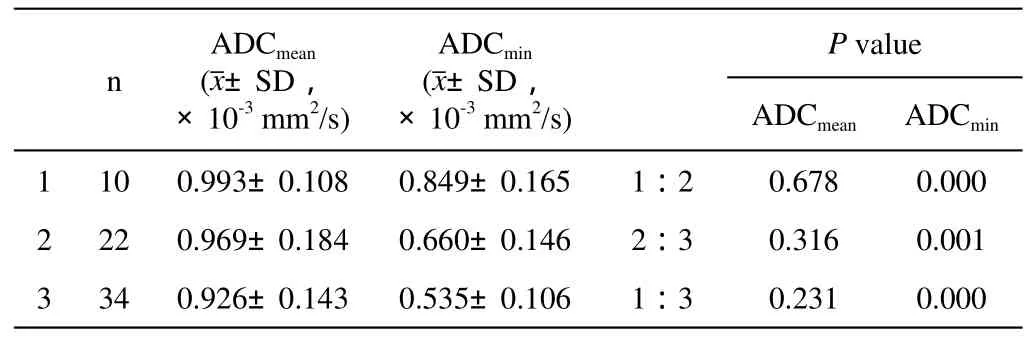
表1 乳腺癌不同病理分级的ADC值测量结果及经LSD检验组内进行两两比较结果Tab.1 Results of ADC values in different histopathologic grades of breast cancer and the results of pairwise comparions within groups examined by LSD test

表2 乳腺癌不同预后分组的ADC值测量结果及经LSD检验组内进行两两比较结果Tab.2 Results of ADC values in different prognostic groups of breast cancer and the results of pairwise comparions within groups examined by LSD test
3.2 本研究的局限性
本研究病理Ⅰ级病例数较少,乳腺癌伴有腋窝淋巴结转移的病例未经免疫组化标记VEGF、MVD及SPF,存在一定的局限性,有待增加病例数及免疫组化标记后进一步研究。
[References]
[1]He ZY,Mangroo A,Li ZY,et al.Estimation of DWI and DCE-MRI in the small mass lesions of the breast on MR imaging at 3.0 T.Chin J Magn Reson Imaging,2012,3(2):120-124.何之彦,Ateelesh Mangroo,李志宇,等.3.0T MR扩散加权和动态增强对乳腺小肿块性病灶的诊断价值.磁共振成像,2012,3(2):120-124.
[2]Wei W,Huang ZK,Long LL,et al.Diagnosis in 3.0 T MRI of infiltrating ductal carcinoma of breast.Chin J Magn Reson Imaging,2012,3(6):434-439.韦苇,黄仲奎,龙莉玲,等.乳腺浸润性导管癌的3.0T MRI诊断.磁共振成像,2012,3(6):434-439.
[3]Costantini M,Belli P,Rinaldi P,et al.Diffusion-weighted imaging in breast cancer:relationship between apparent diffusion coefficient and tumor aggressiveness.Clin Radiol,2010,65(12):1005-1012.
[4]Deng DQ,Tu R,You XG,et al.Relevant Study of ADC Values on DWI and Histopathologic Classification of Breast Cancer.J Clin Radiol,2013,32(10):1428-1431.邓丹琼,涂蓉,尤小光,等.磁共振扩散加权成像ADC值与乳腺癌病理组织分级的相关性研究.临床放射学杂志,2013,32(10):1428-1431.
[5]Kim SH,Cha ES,Kim HS,et al.Diffusion-weighted imaging of breast cancer:correlation of the apparent diffusion coefficient value with prognostic factors.J Magn Reson Imaging,2009,30(3):615-620.
[6]Elston CW,Ellis IO.Pathological prognostic factors in breast cancer.I.The value of histological grade in breast cancer:experience from a large study with long-term follow-up.Histopathology,1991,19(5):403-410.
[7]Wang YY,Chang XD,Fu JH,et al.Relationships between 3.0 T MRI features and prognostic factors of patients in breast invasive ductal carcinoma.Chin J Magn Reson Imaging,2014,5(2):132-137.王盈盈,常晓丹,付娇慧,等.乳腺浸润性导管癌3.0TMRI表现与预后因子相关性研究.磁共振成像,2014,5(2):132-137.
[8]Hirano M,Satake H,Ishigaki S,et al.Diffusion-weighted imaging of breast masses:comparison of diagnostic performance using various apparent diffusion coefficient parameters.AJR Am J Roentgenol,2012,198(3):717-722.
[9]Liu Y,Wang G,Xu WG,et al.Relevance of tumor angiogenesis in occurrence and development of breast cancer.National Medical Journal of China,2009,89(24):1687-1689.
[10]Kanngurn S,Thongsuksai P,Chewatanakornkul S.Chalkley microvessel but not lymphatic vessel density correlates with axillary lymph node metastasis in primary breast cancers.Asian pac J Cancer prev,2013,14(1):583-587.
[11]Pervez S,Khan MN,Nasir MI,et al.Comparative predictive value of three prognostic markers--S-phase fraction,pCNA and Mitotic count on axillary lymph node metastasis in carcinoma breast.J Ayub Med Coll Abbottabad,2007,19(1):3-5.
