乳腺癌MRI的特征性表现与腋窝淋巴结转移的相关性分析
2015-12-13谢龙龙刘晟王维刘文简练彭和香
谢龙龙,刘晟,王维,刘文,简练,彭和香
中南大学湘雅三医院放射科,长沙410013
乳腺癌是严重危害女性健康的恶性肿瘤之一。乳腺癌的预后与许多指标有关,如肿瘤大小、组织学分级、组织学类型、癌基因表达情况,其中腋窝淋巴结转移也是其中重要一方面[1]。已有研究显示乳腺肿块短长径及恶性强化表现与乳腺癌转移和预后有着密切关系[2]。本研究旨在通过探讨乳腺癌的MRI的特征性表现与腋窝转移淋巴结之间的相关性,为临床早期判断淋巴结性质,进行较好临床治疗策略的制定和实施提供新指标,并较好地评估预后。
1 材料和方法
1.1 材料
2010年7月至2014年7月在某医院住院并经术后病理证实的乳腺癌患者44例(排除术前化疗的患者),均行腋窝淋巴结清扫,证实26例有同侧腋窝淋巴结转移,患者均为女性,年龄23~74 岁,平均(46.28±13.64)岁。其中浸润性导管癌32例,非浸润性导管癌12例,包括浸润性小叶癌9例,导管内癌3例。
1.2 研究方法
所有患者在接受手术治疗前均行磁共振扫描,MRI扫描使用1.5 T 超导MR扫描仪(德国西门子)及专用乳腺表面线圈,患者俯卧位双侧乳腺线圈槽内,胸自然悬垂于壁紧贴线圈。常规扫描矢状位(SAG)及横断位(TRA),使用自旋回波(SE)TlWI:TR550 ms,TE 4.7 ms;快速自旋回波(TSE)T2WI:TR 5000 ms,TE 56 ms;脂肪抑制(FLASH)成像FLASl4/T2WI:TR 5000 ms,TE 108 ms。FOV 34 cm × 34 cm,层厚3 mm。增强扫描:采用T1WI压脂横、矢状位,用高压注射器经手背静脉注入对比剂Gd-DTPA 15 ml,按0.1 mmol/kg。层厚4 mm,矩阵256×256,激励次数3次,扫描时间1~3 min。并签署知情同意书。
1.3 图像分析
由两名高年资影像学医师对44例乳腺癌患者病变MR动态增强MR的特征进行分析,分别选择乳腺癌肿块短径及长径极值的层面,测量乳腺癌肿块的短长径值,并计算其比值;统计患者肿块呈边缘强化的早期强化率,当两名医师诊断意见不一致时咨询上级意见。
行病理证实腋窝是否存在淋巴结转移;选取呈边缘强化的乳腺癌作为兴趣区,按照公式早期强化率(%)=[(增强后病灶信号强度-增强前病灶信号强度)/增强前病灶信号强度]×100%,得出病灶边缘的早期强化率。
1.4 统计学分析
采用SPSS 18.0统计软件包进行处理。以病例数为计数单位,采用两独立样本t检验分析,P<0.05差异有统计学意义。
2 结果
2.1 乳腺癌肿块短径与长径之比与腋窝淋巴结转移的相关性
44例乳腺癌患者病灶的短径与长径的比值在0.278~1之间波动,当其比值越大时,同侧腋窝淋巴结转移率越小。其中淋巴结阳性组(n=26)的乳腺癌肿块短径与长径之比是(0.483±0.174),淋巴结阴性组(n=18)的乳腺癌肿块短径与长径之比是(0.756±0.11),两者差异有统计学意义(P=0.001<0.05,t=5.892)。
2.2 边缘强化的乳腺癌(n=32)早期强化率与淋巴结转移的相关性结果(表1)

表1 边缘强化的乳腺癌(n=32)早期强化率与淋巴结转移的相关性结果Tab.1 Correlation between edge reinforcement tumors' early intensive rate of breast cancer and axillary metastasis
3 讨论
乳腺癌已成为女性最常见的恶性肿瘤,发病率高,死亡率仅次于肺癌,严重危害女性健康。根据近几年相关数据统计[3],乳腺癌淋巴结转移最常见及最早受累的部位是同侧腋窝,因此乳腺癌手术治疗是否行腋窝淋巴结清扫已有很多相关报道及研究,随着MRI高分辨率表面线圈技术的改进及新的成像技术发展,MRI已经成为乳腺癌检出、诊断和分期最有前途的检查方式,术后切除的肿块大小与MR评估的范围误差极小[4]。淋巴结转移已成为评估乳腺癌预后的重要指标[5],因此对淋巴结的转移如果能做到尽早诊断和及时治疗可降低死亡率,改善患者预后。另一方面如果发现测定腋窝淋巴结为阴性,则可以避免外科手术腋窝淋巴结清扫这一过度治疗带来的一系列后遗症,如淋巴水肿、疼痛、肩膀运动受限等。
磁共振成像(magnetic resonance imaging,MRI)作为一种无创检测手段,是乳腺癌早期发现、早期诊断、早期治疗的主要手段[6],因MRI检查具有极高的软组织分辨力,可多序列成像,且快速成像序列显示形态学表现,故而成为对乳腺癌检出率非常有效的辅助性诊断手段[7]。相关文献显示,MRI可以对乳腺癌病灶准确定位并能较准确测量肿块短径与长径,因此可通过计算其比值与乳腺癌腋窝淋巴结转移的相关性,为临床治疗方案选择提供依据[8-9]。
磁共振动态增强扫描目前是临床研究的热点及重点之一,能对肿瘤血管生成及其预后进行评价。通常检查需要应用顺磁性对比剂钆双胺,它对乳腺肿瘤本身并无生物学特异性,但乳腺癌具备丰富血供、肿瘤供血血管壁具有较好的通透性及细胞外间隙变窄等病生理学特点,故对比剂能在肿瘤组织内随机分布。动态增强对比剂首次通过组织这一早期强化阶段信号强度的增加即早期强化率,主要与对比剂在血管内的分布有关,反映了组织的微血管数量及其分布。大多研究已表明[8,10],动态增强扫描作为一种无创性检查,通过分析乳腺肿瘤动态增强早期强化特点,可推测肿瘤组织的微血管数量分布情况。因此,通过检测乳腺癌早期增强率来反映这些肿瘤细胞的血管构成特点,评估肿瘤的恶性程度,有望据此在治疗前预测乳腺癌淋巴结是否阳性,对选择与设计临床治疗方案有重要的指导意义。
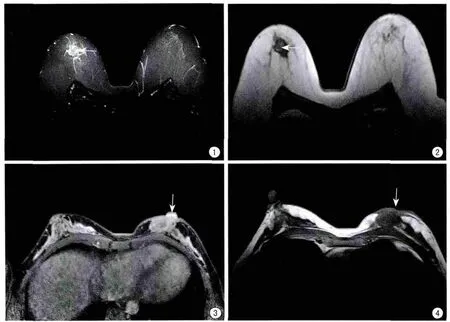
图1~2 右乳示肿块(←)最长径为2.0 cm,最短径为1.8 cm,其短长径之比为0.900,术后经病理证实后无腋窝淋巴结转移 图3~4 左乳示肿块(↓)最长径为3.1 cm,最短径为1.3 cm,其短长径比为0.419,术后经病理证实后存在左侧腋窝淋巴结转移Fig.1—2 The longest diameter of right breast mass(←)is 2.0 cm,the shortest diameter is 1.8 cm,the shortlong diameter ratio is 0.900,without axillary lymph node metastasis after confi rmed by pathology after surgery.Fig.3—4 The longest diameter of left breast lumps(↓)is 3.1 cm,the shortest diameter is 1.3 cm,the shortlong diameter ratio is 0.419,and the left side axillary lymph node had metastasised after confi rmed by pathology after surgery.
本研究发现,乳腺癌腋窝淋巴结阳性组乳腺癌肿块的短长径之比为(0.483±0.174),乳腺癌腋窝淋巴结阴性组乳腺癌肿块的短长径之比为(0.756±0.11),可见乳腺癌患者MR上肿块的短径与长径的比值越大,同侧腋窝淋巴结转移率越小,差异具有统计学意义(t=2.957,P<0.005)。MRI图像上肿块短长径之比越大,该肿块越接近圆形,因此类圆形的乳腺癌肿块其恶性度相对来说越低,同侧腋窝淋巴结转移率就越低(见图1~4)。国内学者王旭等[11]的研究表明不同TNM分期肿块的长、短径变化率、最大截面积比差异有统计学意义。本研究结果分析与其结论相似,均可提示乳腺癌的恶性程度、淋巴结转移与乳腺癌肿块短长径有关联。虽然本研究病例数较少,未能准确得知淋巴结阳性与阴性交界点时乳腺癌肿块短长径的比值,但已经得出了肿块的短长径之比越大腋窝淋巴结阳性的概率就越大这一结论,说明通过MR测定乳腺癌肿块的短长径之比,对预测淋巴结的性质具有重要的指导意义。
同时,本研究还发现乳腺癌磁共振动态增强早期强化率与同侧腋下淋巴结转移呈显著正相关性。此次研究笔者首先统计44例乳腺癌患者中呈边缘强化的共有32例,其中24例存在腋窝淋巴结转移。为提高本研究敏感性及特异性,故选取32例呈边缘强化的乳腺癌作为入组研究病例,测量并计算其边缘早期强化率。发现24例淋巴结阳性的患者乳腺肿块早期强化率均值为(70.12±22.70),8例淋巴结阴性患者早期强化率均值为(56.37±15.60),差异具有统计学意义(P<0.01)。上述研究结果说明动态增强早期强化率可较全面反映肿瘤血管的分布特点及形成特征,早期强化率越大的24例患者,对应同侧腋窝淋巴结转移率也越大,原因就是其肿瘤血供越丰富,结构特异性越大,肿瘤的恶性程度越高[12-13]。国内已有学者[14]指出早期强化率与乳腺癌微血管密度成正相关性,又证明微血管密度与淋巴结转移有关,本研究结果分析在其基础上能直接提示肿瘤的早期边缘强化率与转移淋巴结呈正相关,说明早期边缘强化率反映了肿瘤血管生长和分布密切相关,早期强化率相对越高,乳腺癌患者预后相对较差。
4 结论
磁共振成像中乳腺癌肿块的短长径之比、肿瘤早期边缘强化率均对乳腺癌患者腋窝淋巴结的良恶性鉴别中有一定指导意义,进而能为临床选择适当治疗方案及评估预后提供一定的参考依据。
本研究尚存在一些不足之处,研究中未对不同病理型的乳腺癌患者淋巴结转移分别进行比较,后续研究尚需进行多中心的研究和大数据细化样本分类进行统计学分析。
[References]
[1]Fiona J.Gilbert,Ruth M.L.Warren,Gek Kwan-Lim,et al.Cancers in BRCA1 and BRCA2 Carriers and in Women at High Risk for Breast Cancer:MR Imaging and Mammographic Features.Radiology,2009,252(2):358-368.
[2]De Azambuja E,Cardoso F,De Castro G Jr,et al.Ki-67 as prognostic marker in early breast cancer:a meta-analysis of published studies involving 12155 patients J.Br J Cancer,2007,96(10):1504 -1507.
[3]Lim SW,Kim HW,Jun HY,et al.TCL-SPIONenhanced MRI for the detection of lymph node metastasis in murine experimental model.Acad Radiol,2011,18(4):504-511.
[4]Nehmat Houssami,MBBS,Daniel F.Hayes.Review of Preoperative Magnetic Resonance Imaging(MRI)in Breast Cancer.CA:A Cancer Journal for Clinicians,2009,59(5):290-302.
[5]Chuanming Li,Shan Meng,Xinhua Yang,et al.The value of T2* in differentiating metastatic from benign axillary lymph nodes in patients with breast cancer-a preliminary in vivo study.Plos one,2014,9(2):1-7.
[6]Zhang Q,Wang ZC,Xian JF,et al.Relationships between dynamic contrast-enhanced MRI and pathological types and immunohistochemical findings of patients in breast cancer.Chin J Magn Reson Imaging,2012,3(6):430-433.张青,王振常,鲜军舫,等.乳腺癌增强MRI特征和病理、免疫组化指标的相关性研究.磁共振成像,2012,3(6):430-433.
[7]C.Marcotte-Bloch,C.Balu-Maestro,E.Chamorey,et al.MRI for the size assessment of pure ductal carcinoma in situ(DCIS):a prospective study of 33 patients.European Journal of Radiology,2011,77(3):462-467.
[8]Tuncbilek N,Karakas HM,Okten OO.Dynamic magnetic resonance imaging in determining histopathological prognostic factors of invasive breast cancers.Eur J Radiol,2005,53(2):199-205.
[9]Cooper KL,Meng Y,Harnan S,et al.Positron emission tomography(PET)and magnetic resonance imaging(MRI)for the assessment of axillary lymph node metastases in early breast cancer:systematic review and economic evaluation.Health Technol Assess,2011,15(4):1-134.
[10]Wei W,Xie D,Su DK,et a1.Correlation on MRI non-morphological features and C-erbB-2 expression ofbreast cancel.Chin J Magn Reson Imaging,2014,5(4):269-273.韦苇,谢东,苏丹柯,等.乳腺癌MRI非形态学特征与C-erbB2表达的相关性研究.磁共振成像,2014,5(4):269-273.
[11]Wang X,Huang SH,Liu XH,et al.Evaluation of the combined use of ultrasound elastography and color doppler in the diagnosis and TNM classifi cation of breast cancer.Tianjin Med J,2014,42(2):119-122.王旭,黄淑华,刘新红,等.联合应用超声弹性成像及彩色多普勒在诊断乳腺癌及评价TNM分期中的价值.天津医药,2014,42(2):119-122.
[12]Baudu LD,Murakami J,Murayama S,et al.Patterns of peripheral enhancement in breast masses:correlation of findings oncontrast medium enhanced MRI with histolodicfeatures an tumor angiogenesis.J Comput Assist Tomogr,1997,21(3):421-430.
[13]Loo CE,Teertstra HJ,Rodenhuis S,et al.Dynamic contrastenhanced MRI for prediction of breast cancer response to neoadjuvant chemotherapy:initial results.AJR Am J Roentgenol,2008,191(5):1331-1338.
[14]Liu SZ,Huang T.Angiogenesis and dynamic contrast enhanced MRI of breast cancer:preliminary results.Chinese Journal of Clinical Oncology,2005,32(9):516-519.刘书政,黄韬.磁共振成像动态增强对乳腺癌血管生成的研究.中国肿瘤临床学,2005,32(9):516-519.
