电针百会穴对APP/PS1双转基因小鼠学习记忆及脑源性神经营养因子表达的影响①
2015-12-13陈吉祥吴羽楠郑雅媗卓沛元张颖铮陈立典
陈吉祥,吴羽楠,郑雅媗,卓沛元,张颖铮,陈立典
电针百会穴对APP/PS1双转基因小鼠学习记忆及脑源性神经营养因子表达的影响①
陈吉祥1,吴羽楠1,郑雅媗2,卓沛元1,张颖铮1,陈立典1
目的观察电针百会穴对APP/PS1双转基因小鼠学习记忆功能及脑源性神经营养因子(BDNF)表达的影响,探讨电针治疗阿尔茨海默病的作用机制。方法将30只4月龄雌性APP/PS1双转基因小鼠随机分为模型组、百会组和非穴组,每组10只,另取10只同窝阴性野生小鼠为野生组。百会组电针百会穴,非穴组电针非穴,干预28 d,野生组和模型组不干预。采用Morris水迷宫实验观察小鼠学习记忆能力;免疫组化技术观察小鼠大脑皮质β-淀粉样蛋白的沉积;Western blotting和RT-PCR法检测小鼠皮质脑源性神经营养因子(BDNF)蛋白和基因的表达情况。结果与模型组相比,百会组小鼠逃避潜伏期缩短(P<0.05),跨越平台次数明显增加(P<0.01);β-淀粉样蛋白的沉积减少(P<0.05);BDNF蛋白和基因的表达明显增多(P<0.01)。非穴组与模型组相比无显著性差异(P>0.05)。结论电针百会穴可改善APP/PS1双转基因小鼠的学习记忆功能,其作用机制可能与增加大脑皮质BDNF蛋白和基因的表达,降低β-淀粉样蛋白的沉积有关。
电针;百会穴;APP/PS1;学习记忆;脑源性神经营养因子;小鼠
[本文著录格式]陈吉祥,吴羽楠,郑雅媗,等.电针百会穴对APP/PS1双转基因小鼠学习记忆及脑源性神经营养因子表达的影响[J].中国康复理论与实践,2015,21(6):642-647.
CITED AS:Chen JX,Wu YN,Zheng YX,et al.Effects of electroacupuncture at Baihui(DU20)on learning and memory and expression of brain-derived neurotrophic factor inAPP/PS1 double-transgenic mice[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(6):642-647.
阿尔茨海默病(Alzheimer's disease,AD)是一种以认知功能进行性减退为临床特征的神经退行性疾病[1]。AD的病理特征为细胞外β-淀粉样蛋白(β-amyloid peptide,Aβ)沉积所形成的老年斑(senior patch,
SP),细胞内Tau蛋白过度磷酸化所形成神经原纤维缠结(neurofibrillary tangles,NFTs),以及神经元的大量丢失[2]。近年来研究发现,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)在AD患者大脑中的表达下降,并且与认知功能损害密切相关[3-4]。调控BDNF表达,可以降低Aβ的毒性作用,改善突触的可塑性,从而提高认知功能[5]。因此,BDNF与AD的病理过程以及治疗密切相关。
百会为督脉、足太阳之会,常用于治疗心神病症。研究表明,电针百会穴可以改善认知功能障碍[6-9],然而其确切机制并不清楚。本研究通过观察电针百会穴对APP/PS1双转基因小鼠学习记忆能力、Aβ的沉积以及BDNF基因和蛋白表达的影响,探讨其作用机制。
1 材料与方法
1.1 实验动物与分组
30只雌性APP/PS1双转基因小鼠[B6C3-Tg(APPswe,PSEN1dE9)85Dbo/MmJNju]以及10只同窝阴性野生小鼠购于南京大学模式动物研究所,于福建中医药大学实验动物中心SPF级实验室饲养。
采用随机数字表法将4月龄APP/PS1双转基因小鼠随机分成模型组、百会组和非穴组,每组均为10只。另外10只同窝阴性野生小鼠为野生组。实验过程均严格按照国际动物保护和使用指南的规定进行。
1.2 主要试剂
Aβ1-42和BDNF抗体:ABCAM。DAB免疫组化试剂盒:福州迈新生物科技有限公司。β-actin抗体以及辣根过氧化物酶二抗:Cell Signaling Technology。BDNF及β-actin引物:上海生工生物工程有限公司。逆转录试剂盒:PROMEGA。
1.3 干预措施
百会组参考《实验针灸学》[10]取小鼠百会穴,使用华佗牌30号0.5寸毫针,G6805电针仪,电压峰值2 V,以针体轻轻抖动为度,疏密波,频率1 Hz,每次30 min,每天1次,共治疗28 d。非穴组取胁下非经非穴点,具体定位为髂后上棘上2 mm,脊柱旁开3 mm,该点避开督脉及胁部穴位,其他与百会组相同。野生组和模型组置于普通笼中饲养,予同等条件抓取,不给予任何治疗。
1.4 Morris水迷宫实验
水迷宫为一圆桶形水池,直径120 cm,深50 cm,水深30 cm,水温恒温26℃左右,池壁上4个等距离点分水池为4个象限,池壁外标4个入水点,在第三象限放置平台。平台直径6 cm,高28 cm,没于水面下2 cm,水池周围参照物保持不变。各组小鼠均于处死前5 d行Morris水迷宫检测,连续4 d进行定位航行实验,观察逃避潜伏期,第5天进行空间探索实验,观察规定时间内小鼠穿越平台的次数。
具体实验方案如下[11]。①定位航行实验,将受试小鼠按顺时针方向依次由第一象限、第二象限、第三象限和第四象限入水点面向池壁放入水中。记录90 s内寻找平台的时间(逃避潜伏期)。如果小鼠在90 s内找到平台,并停留3 s以上,记录实际逃避潜伏期;如果在90 s内未找到平台,由实验者将其引上平台并停留10 s,逃避潜伏期记录为90 s。历时4 d,每天4次。②空间探索实验,定位航行实验全部结束后,次日进行空间探索实验。撤去平台,然后选第一象限与定位航行实验相同的入水点将小鼠面向池壁放入水中,分别记录90 s内小鼠穿越原平台相应位置的次数。水迷宫全过程通过安装在水迷宫上方的摄像机监测,传入电脑记录和储存,再运用行为轨迹跟踪系统软件进行分析和数据处理。
1.5 取材及检测方法
1.5.1 取材
干预结束后,小鼠腹腔注射10%水合氯醛0.3 ml/ 100 g麻醉。每组取5只小鼠经左心室依次灌注生理盐水和4%多聚甲醛溶液,随后迅速断头取脑,脑组织浸泡于4%多聚甲醛溶液中,24 h后常规梯度乙醇脱水、二甲苯透明、石蜡包埋,做连续冠状脑切片,切片厚5 μm。余下小鼠不经心脏灌注直接断头取脑,分离脑组织,-80℃保存,以备提取蛋白和RNA。
1.5.2 免疫组化
石蜡切片常规脱蜡入水,在0.01 mol/L枸橼酸钠溶液(pH 6.0)中抗原修复10 min;3%H2O2室温孵育10 min,以消除内源性过氧化物酶的活性;PBS冲洗5 min,共3次,10%正常山羊血清封闭,室温孵育10 min;倾去血清,勿洗,滴加兔抗小鼠Aβ1-42一抗工作液(1∶100),置于湿盒中4℃过夜;PBS冲洗5 min,共3次,滴加适量生物素标记山羊抗兔二抗工作液,室温孵育10 min;PBS冲洗5 min,共3次,滴加辣根过氧化物酶标记链霉卵白素工作液,室温孵育10 min;PBS冲洗5 min,共3次,DAB显色剂显色2 min,自来水充分冲洗;苏木素复染,PBS返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片观察。每张组织切片随机选取6个部位进行拍摄,应用LEICA Application Suite V4进行图像采集,采用Image-Pro Plus 6.0软件进行图像分析。
1.5.3 蛋白免疫印迹法(Western blotting)
取小鼠大脑皮质组织,按100 mg脑组织中加入细胞裂解液1 ml和PMSF储存液10µl,研磨均匀后静置
30 min,取上清,4℃,13000 r/min离心5 min,吸取上清,BCA测定蛋白浓度。加入上样缓冲液加热变性后,SDS-PAGE电泳,转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上。用5%脱脂奶粉室温封闭2 h,加入BDNF一抗(1∶1000)孵育,4℃过夜,加入相应二抗(1∶5000)室温1 h。避光配置显色液并覆盖PVDF膜,反应1 min后运行Bio-Image分析系统显影成像及Image-Pro Plus软件对扫描图像的目的条带进行灰度值分析。以β-actin为内参,按公式计算目的蛋白相对含量:
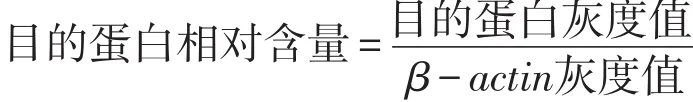
1.5.4 聚合酶链反应技术(RT-PCR)
取小鼠大脑皮质组织,200 mg脑组织中加入Trizol 1 ml研磨,震荡30 s;加氯仿0.2 ml,剧烈摇动30 s,室温3 min;4℃,12000 r/min离心15 min,轻轻吸取上层无色水相,移入另一个EP管中(约0.5 ml);加等体积异丙醇,室温放置10 min;4℃,12000 r/min离心10 min;在管底部可见微量RNA沉淀。加入75%乙醇1 ml,振荡,4℃,7500 r/min离心5 min;弃上清,小心吸取残留乙醇,开盖干燥5 min,用DEPC水20 μl溶解RNA,检测RNA浓度,根据RNA浓度,计算RNA体积。
按照逆转录试剂盒以及相关引物说明书加入相应量的试剂进行聚合酶链反应。
PCR扩增参数为94℃预变性3 min,94℃变性30 s,54℃~62℃退火30 s,70℃延伸30 s,变性、退火、延伸共35个循环,最后70℃延伸5 min。
BDNF引物序列为:
F:CTGAGCGTGTGTGACAGTATTAGCG,
R:CAGCCTTCCTTCGTGTAACCCAT。
β-actin引物序列为:
F:ACTGGCATTGTGATGGACTC,
R:CAGCACTGTGTTGGCATAGA。
将PCR扩增产物在1.5%琼脂糖凝胶上电泳。电泳结束后使用Model Gel 2000凝胶成像系统(BioRad, Model Gel Doc 2000,USA)对目的基因及对照基因PCR产物的灰度进行比较分析,从而得出mRNA的相对含量。
1.6 统计学分析
应用SPSS 18.0软件进行统计学处理,所得数据均以(±s)表示。计量资料采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 学习记忆功能
2.1.1 定位航行实验
与野生组相比,模型组小鼠平均逃避潜伏期明显延长(P<0.01);与模型组相比,百会组小鼠平均逃避潜伏期则缩短(P<0.05),而非穴组小鼠平均逃避潜伏期与模型组相比无显著性差异(P>0.05)。见表1。
2.1.2 空间探索实验
与野生组相比,模型组小鼠跨越平台次数明显减少(P<0.01);与模型组相比,百会组小鼠跨越平台次数则明显增多(P<0.01),而非穴组小鼠跨越平台次数与模型组相比无显著性差异(P>0.05)。见表1。
2.2 Aβ的沉积
免疫组化结果显示,与野生组相比,模型组小鼠大脑皮质Aβ的沉积明显增多(74.16±17.42 vs.20.82± 6.14,P<0.01);与模型组相比,百会组小鼠Aβ的沉积明显减少(49.42±16.52 vs.74.16±17.42,P<0.05);非穴组小鼠Aβ的沉积与模型组相比无显著性差异(67.68± 13.58 vs.74.16±17.42,P>0.05)。见图1。
2.3 BDNF蛋白的表达
与野生组相比,模型组小鼠大脑皮质BDNF蛋白表达量明显下降(P<0.01);与模型组相比,百会组小鼠大脑皮质BDNF蛋白表达量明显增加(P<0.01),而非穴组小鼠大脑皮质BDNF蛋白的表达与模型组相比无显著性差异(P>0.05)。见图2。
2.4 BDNF基因的表达
与野生组相比,模型组小鼠大脑皮质BDNF基因的表达明显下降(P<0.01);与模型组相比,百会组小鼠大脑皮质BDNF基因的表达明显增加(P<0.01),而非穴组小鼠大脑皮质BDNF基因的表达与模型组相比无显著性差异(P>0.05)。见图3。

表1 各组小鼠逃避潜伏期及跨越平台次数比较
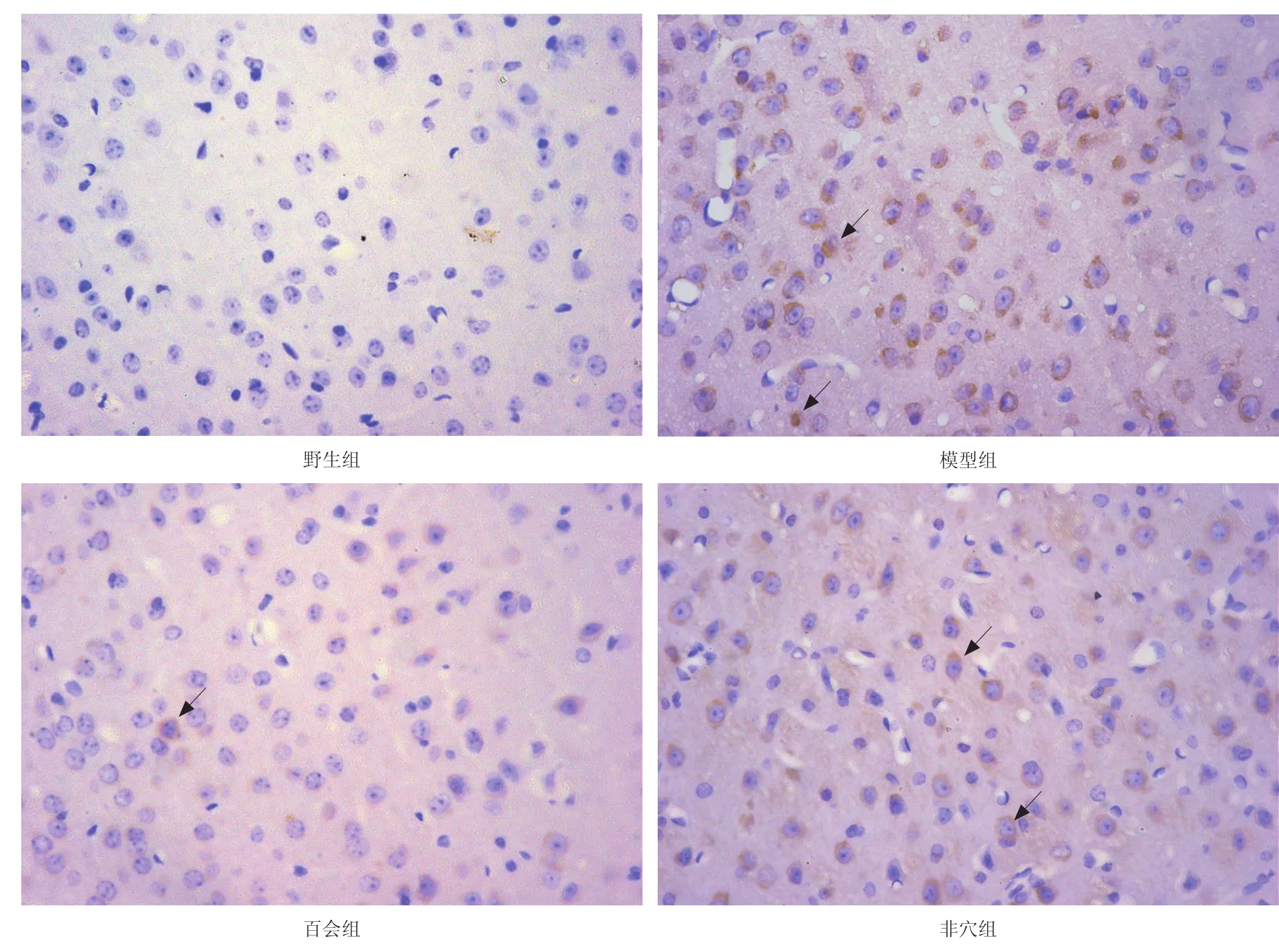
图1 各组小鼠大脑皮质Aβ的沉积(免疫组化,400×)
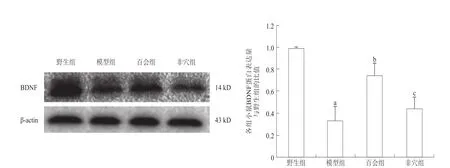
图2 各组小鼠大脑皮质BDNF蛋白的表达(n=5)
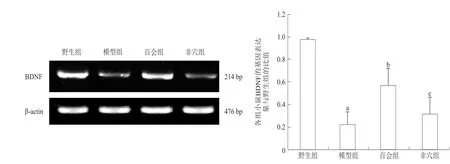
图3 各组小鼠大脑皮质BDNF基因的表达(n=5)
3 讨论
AD是一种以认知功能进行性减退为临床特征的神经退行性疾病。目前,AD的药物治疗主要针对中枢胆碱能系统、中枢组胺能系统以及5-羟色胺受体。这些药物治疗虽然可以在某种程度上缓解AD的临床症状,但是并不能阻止AD的病理进程[12]。研究表明,电针可以改善AD的认知功能障碍[6-9],但是其确切的作用机制并不清楚。
AD在中医理论体系中见于“呆病”、“健忘”、“癫狂”等证的描述中,以气郁痰结、肾精亏虚、瘀血阻于脑络为痴呆发病的主要原因。督脉上至风府,入属于脑,历代医家素有“病变在脑,首取督脉”之说。百会为督脉、足太阳之会,位居巅顶,其深处即为脑,常用于治疗心神病症。我们之前报道电针督脉穴位改善脑梗死大鼠的学习记忆功能[13]。本研究中,我们通过观察电针百会穴对APP/PS1双转基因小鼠学习记忆功能及BDNF表达的影响,探讨电针治疗AD认知功能障碍的作用机制。
APP/PS1双转基因小鼠模拟AD的病理过程,是一种广泛应用于AD研究的可靠动物模型[14]。该动物模型同时携带具有瑞典型突变位点(Swedish KM594/ 595NL)的人鼠嵌合型APP基因(Mo/Hu APP695)和具有第9个外显子(dE9)突变的人PS1基因,这两种突变基因共同作用,加速Aβ的产生和沉积,在早期出现认知功能障碍等行为学异常[15]。
本研究中,通过Morris水迷宫实验以及免疫组化检测Aβ的沉积,与野生鼠相比,APP/PS1双转基因小鼠逃避潜伏期延长,跨越平台次数减少,Aβ的沉积增多,这说明APP/PS1双转基因小鼠大脑Aβ加速沉积,空间学习记忆功能受损。电针百会穴可以改善APP/PS1双转基因小鼠空间学习记忆功能,并且降低Aβ的沉积,减少其毒性作用。这与之前其他研究所得出的结论相一致[16-17]。
BDNF是神经营养素家族中的一员,它的主要作用是调节神经元的增值和分化以及突触的可塑性,与学习和记忆密切相关[18]。研究表明,BDNF的基因和蛋白在AD早期的皮质和海马区大量减少,并且与认知功能的下降密切相关[19-20]。本研究证实,与野生组相比,模型组小鼠大脑皮质BDNF的基因和蛋白的表达均明显减少。另有研究表明,调控BDNF的表达可以减少AD的神经元凋亡,增加突触可塑性,改善学习和记忆功能[21-22],增加BDNF的表达可以降低Aβ的毒性作用[23]。这些研究表明,调控BDNF的表达是AD治疗的一种很有前景的手段。
马骏等的研究显示,电针不同的穴位,采用不同的波形以及艾灸均能促进AD模型BDNF蛋白的表达,促进其认知功能的恢复[24-26]。然而,这些研究均未采用APP/PS1双转基因小鼠,且未设置非穴组作为对照从基因和蛋白两个层面观察BDNF的表达。
本研究通过28 d的电针百会穴治疗,百会组APP/ PS1双转基因小鼠大脑皮质BDNF基因和蛋白的表达均明显增加,而非穴组BDNF基因和蛋白的表达与模型组差异没有统计学意义。这些结果说明,电针百会穴改善APP/PS1双转基因小鼠学习记忆功能的作用机制可能与增加大脑皮质BDNF蛋白和基因的表达有关。
综上所述,电针百会穴可改善APP/PS1双转基因小鼠的学习记忆功能,其作用机制可能与增加大脑皮质BDNF蛋白和基因的表达,降低Aβ的沉积有关,但有待进一步研究。
[1]Querfurth HW,Laferla FM.Alzheimer's disease[J].N Engl J Med,2010,362(4):329-344.
[2]Serrano-Pozo A,Frosch MP,Masliah E,et al.Neuropathological alterations in Alzheimer disease[J].Cold Spring Harb Perspect Med,2011,1(1):a6189.
[3]Weinstein G,Beiser AS,Choi SH,et al.Serum brain-derived neurotrophic factor and the risk for dementia:the Framingham Heart Study[J].JAMANeurol,2014,71(1):55-61.
[4]Lee J,Fukumoto H,Orne J,et al.Decreased levels of BDNF protein in Alzheimer temporal cortex are independent of BDNF polymorphisms[J].Exp Neurol,2005,194(1):91-96.
[5]Tapia-Arancibia L,Aliaga E,Silhol M,et al.New insights into brain BDNF function in normal aging and Alzheimer disease[J].Brain Res Rev,2008,59(1):201-220.
[6]董洪涛,白英.电针治疗老年性痴呆对其认知电位影响的临床研究[J].中国应用生理学杂志,2003,19(1):94-96.
[7]赵凌,张富文,张虹,等.电针治疗轻度认知功能障碍:多中心随机对照研究[J].中国针灸,2012,32(9):779-784.
[8]Wang F,Zhong H,Li X,et al.Electroacupuncture attenuates referencememoryimpairmentassociatedwithastrocytic NDRG2 suppression in APP/PS1 transgenic mice[J].Mol Neurobiol,2014,50(2):305-313.
[9]周丽,张允岭,曹卉娟,等.针刺治疗血管源性轻度认知障碍的系统评价[J].中国中西医结合杂志,2013,33(12):1626-1630.
[10]李忠仁.实验针灸学[M].北京:中国中医药出版社,2003.
[11]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc,2006,1(2):848-858.
[12]Ballard C,Gauthier S,Corbett A,et al.Alzheimer's disease[J].Lancet,2011,377(9770):1019-1031.
[13]Feng X,Yang S,Liu J,et al.Electroacupuncture ameliorates cognitive impairment through inhibition of NF-kappaB-mediated neuronal cell apoptosis in cerebral ischemia-reperfusion injured rats[J].Mol Med Rep,2013,7(5):1516-1522.
[14]Bilkei-Gorzo A.Genetic mouse models of brain ageing and Alzheimer'sdisease[J].PharmacolTher,2014,142(2): 244-257.
[15]Radde R,Bolmont T,Kaeser SA,et al.Abeta42-driven cerebral amyloidosis in transgenic mice reveals early and robust pathology[J].EMBO Rep,2006,7(9):940-946.
[16]李旭颖.电针改善阿尔茨海默病双转基因小鼠认知功能并减轻β样淀粉酶沉积和促进神经发生的研究[D].西安:第四军医大学,2012.
[17]白杨,薛卫国,高亮,等.电针对APP/PS1转基因AD鼠Morris水迷宫学习记忆及脑皮层Aβ水平的影响[J].针灸临床杂志, 2014,30(8):74-77.
[18]Binder DK,Scharfman HE.Brain-derived neurotrophic factor[J].Growth Factors,2004,22(3):123-131.
[19]Phillips HS,Hains JM,Armanini M,et al.BDNF mRNAis decreased in the hippocampus of individuals with Alzheimer's disease[J].Neuron,1991,7(5):695-702.
[20]Nagata T,Kobayashi N,Shinagawa S,et al.Plasma BDNF levels are correlated with aggressiveness in patients with amnestic mild cognitive impairment or Alzheimer disease[J].J Neural Transm,2014,121(4):433-441.
[21]Meng C,He Z,Xing D.Low-level laser therapy rescues dendrite atrophy via upregulating BDNF expression:implications forAlzheimer'sdisease[J].JNeurosci,2013,33(33): 13505-13517.
[22]Xiao Q,Wang C,Li J,et al.Ginkgolide B protects hippocampal neurons from apoptosis induced by beta-amyloid 25-35 partly via up-regulation of brain-derived neurotrophic factor[J].Eur J Pharmacol,2010,647(1-3):48-54.
[23]Arancibia S,Silhol M,Mouliere F,et al.Protective effect of BDNF against beta-amyloid induced neurotoxicity in vitro and in vivo in rats[J].Neurobiol Dis,2008,31(3):316-326.
[24]马骏,王彦春,王述菊,等.电针对阿尔茨海默病模型大鼠海马区神经营养因子及其受体表达的影响[J].针灸临床杂志, 2010,26(7):63-66.
[25]王晓兰,孙国杰,杜艳军,等.艾灸预处理对阿尔茨海默病模型大鼠海马CA1区NGF和BDNF表达的影响[J].中国康复, 2011,26(5):323-326.
[26]周围,吕小笑,张巍.电项针疏、密波对AD模型大鼠空间记忆能力及海马区BDNF/TrkB mRNA的影响[J].针灸临床杂志, 2013,29(12):46-48.
Effects of Electroacupuncture at Baihui(DU20)on Learning and Memory and Expression of Brain-derived Neurotrophic Factor inAPP/PS1 Double-transgenic Mice
CHEN Ji-xiang1,WU Yu-nan1,ZHENG Ya-xuan2,ZHUO Pei-yuan1,ZHANG Ying-zheng1,CHEN Li-dian1
1.College of Rehabilitation Medicine,Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350122, China;2.College of Pharmacy,Fujian University of Traditional Chinese Medicene,Fuzhou,Fujian 350122,China
Objective To explore the effects of electroacupuncture at Baihui(DU20)acupoint on learning and memory and its possible mechanism through the expression of brain-derived neurotrophic factor(BDNF)in APP/PS1 double-transgenic mice.Methods 30 female APP/PS1 double transgenic mice were randomly divided into model group,DU20 group and non-acupoint group,and 10 wild type mice consisted of wild group.DU20 group received electroacupuncture at Baihui and the non-acupoint group received electroacupuncture at non-acupoint for 28 days.Learning and memory was tested by Morris water maze.Deposition of β-amyloid(Aβ)peptide was determined by immunohistochemical staining.The expression of BDNF in cortex was examined by RT-PCR and Western blotting.Results Compared with the model group,DU20 group ameliorated the learning and memory ability of APP/PS1 double-transgenic mice(P<0.05),decreased the deposition of Aβ peptide(P<0.05)and upregulated the gene and protein levels of BDNF(P<0.01).There was no significant difference between the model group and non-acupoint group(P>0.05).Conclusion Electroacupuncture at DU20 acupoint could ameliorate learning and memory in APP/PS1 double-transgenic mice.The mechanism may be related to increase the expression of BDNF and decrease the deposition ofAβ.
electroacupuncture;Baihui(DU20);APP/PS1;learning and memory;brain-derived neurotrophic factor;mouse
10.3969/j.issn.1006-9771.2015.06.003
R749.1
A
1006-9771(2015)06-0642-06
2014-12-31
2015-01-30)
福建省康复技术协同创新中心资助项目(No.X2012004-协同)。
1.福建中医药大学康复医学院,福建福州市350122;2.福建中医药大学药学院,福建福州市350122。作者简介:陈吉祥(1988-),男,河南罗山县人,硕士研究生,主要研究方向:脑血管病的中西医结合康复治疗。通讯作者:陈立典(1963-),男,福建政和县人,教授,博士研究生导师,主要研究方向:脑血管病的中西医结合康复治疗。E-mail:fjtcm1958@sina.com。
