共聚焦激光扫描显微镜在Mohs显微切除术中的应用
2015-12-13峰周锟姜晓玲李
孙 峰周 锟姜晓玲李 强
共聚焦激光扫描显微镜在Mohs显微切除术中的应用
孙 峰1周 锟1姜晓玲2李 强1
目的: 明确共聚焦激光扫描显微镜(CLSM)在Mohs显微切除术中的应用价值。方法: 对46例皮肤肿瘤患者行Mohs显微切除术,对57例标本(36例患者行1次手术切除,9例2次,1例3次)的侧面和底面行CLSM扫描及快速冰冻病理切片检查。结果: 病理检查示:46例标本未检测到肿瘤组织,11例标本检测到肿瘤细胞组织,CLSM示:45例标本未检测到肿瘤组织,12例标本检测到肿瘤组织。CLSM扫描与快速冰冻病理切片之间在检测有无肿瘤组织方面无明显差异(P>0.05)。结论: 在Mohs显微切除术中CLSM可以代替快速冰冻病理检测肿瘤组织残留。
Mohs显微切除术; 共聚焦激光扫描显微镜; 皮肤肿瘤
Mohs显微切除术是皮肤外科技术与特殊冰冻组织切片相结合的一种手术方法,是皮肤外科最重要的术种之一,特别是治疗皮肤恶性肿瘤,不仅尽可能的一次手术完整彻底切净肿瘤组织,降低肿瘤复发率,伤口易于愈合,而且能最大限度地减少皮肤缺损面积,为进一步整形修复打下良好的基础。但快速冰冻病理切片技术要求较高,一般基层医疗机构开展困难,制约了Mohs显微切除术进一步的发展。
共聚焦激光扫描显微镜(confocal laser scanning microscopy,CLSM)是近年来新兴的具有高分辨率的光学成像系统,常被用于皮肤病特别是皮肤肿瘤的诊断。本研究旨在Mohs显微切除术中对比分析CLSM与快速冰冻病理切片结果,明确CLSM是否能够替代快速冰冻病理切片在Mohs显微切除术中应用,现报道如下。
1 材料与方法
1.1 临床资料 选择2013年9月至2014年9月期间来我院就诊的46例皮肤肿瘤患者,其中鳞状细胞癌17例,基底细胞癌13例,湿疹样癌10例,恶性黑素瘤6例。男26例,女20例。年龄45~8l岁,平均63.6岁。
1.2 方法
1.2.1 手术方法 在Mohs显微外科手术标记图上标记肿瘤位置和形态,局部常规消毒后,沿肿瘤边缘外3~5 mm处作标记线(为了记录肿瘤与周围正常组织相对恒定的位置关系,要垂直于手术切口标记线划一刀痕),并沿标记线切除肿物。基底细胞癌和Bowen病患者的皮损外扩大切除3 mm,鳞状细胞癌扩大切除5mm,原位黑素细胞瘤及乳房外Paget病扩大切除2 cm,深及脂肪层,对每次切除的肿瘤组织包裹手术贴膜后,固定于标本固定器上,首先进行CLSM扫描,然后分割成小标本并编号,置入标本运输盒内相应方格中(标本编号需与运输盒中方格的序号一致),同时在标记图上标记标本分割、染色和编号情况,送标本处理间进行冰冻切片,检测侧面和底面,以快速冰冻病理切片检查结果为依据,结果阴性,则行皮瓣成形术修复皮损结束手术。结果阳性,继续行切除术。1
1.2.2 CLSM操作方法 获取每位进行Mohs显微切除术患者离体组织的CLSM图像,取患者切除的离体组织,运用手术贴膜包裹后滴入无菌生理盐水,将组织环置于贴有手术贴膜的离体组织上,将组织环与受检组织相连,根据成像部位,旋转探头,得到最佳的成像角度,定位好粘合窗和组织表面,开始对组织进行成像;成像时,选择Z轴控制选项,然后调整Z值,直至看到粘合窗的图像,根据具体情况,调整激光功率;进行VivaBlock(XY序列)扫描、VivaStack(Z序列)扫描,选择最佳图像,进行保存,确定是否完全切除肿瘤组织。
1.3 统计学方法 数据资料采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
46例患者,以快速冰冻病理切片阴性为准,切除1次者36例,2次者9例,3次1例,总计57例标本进行检查,其中病理阴性46例,阳性11例,CLSM阴性45例,阳性12例,病理阴性中CLSM阳性1例,病理检查阳性的CLSM全阳性(表1)。
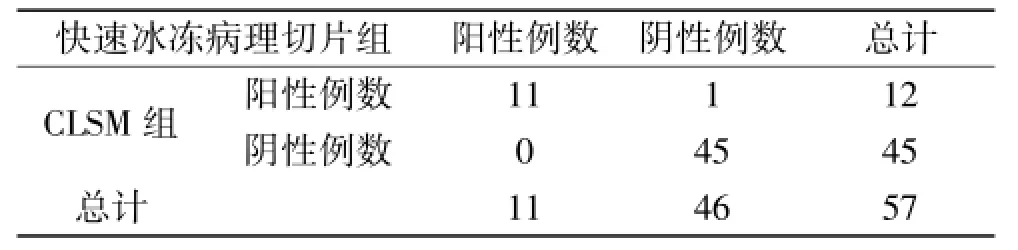
表1 两种检测结果比较
经SPSS 13.0统计分析,两组检查结果差异无统计学意义(P>0.05),说明CLSM检查与冰冻病理检查无明显差异。
3 讨论
皮肤肿瘤Mohs显微切除术需要快速冰冻病理技术支持,基层医疗机构不具备条件,制约了Mohs显微切除术的开展。
CLSM是近年来新兴的具有高分辨率的光学显微镜,其采用激光作为光源,在传统光学显微镜基础上采用共轭聚焦原理和装置,并利用计算机对所观察的对象进行数字图像处理。其具有无创、原位、实时、动态、三维重建等特点,2-5从而可以保证在细胞生理状态下进行诊断,还可实时动态对同一组织多次成像,减少了传统切片制作过程中人为因素的影响,由于CLSM具有较好的敏感性和特异性,可以检测表皮和真皮乳头层,并达到较高的分辨率,清晰地显示细胞和细胞器,其达到的深度是200~250μm,有研究对肿瘤组织使用CLSM,发现瘤细胞在镜下清晰成像,镜下胞核明亮,瘤细胞在瘤团周边排列成栅栏状,中央排列不规则,与传统组织学影像相似,被用于皮肤疾病特别是皮肤肿瘤的诊断和鉴别诊断。6同时还可以帮助手术者快速确定皮肤肿瘤的皮损边界,评估手术的范围。7-9有研究指出在 Mohs显微切除术中,运用CLSM提供的离体组织快速光学反射成像替代快速冰冻切片,可以提高手术速度,同时常规的病理常使用垂直方向的皮肤各生理切面,而CLSM可提供皮肤横向的光学切面,可以动态的检测肿瘤,可以实现同一个深度(XY轴)和同一点不同深度(Z轴)的成像,相当于在皮肤活体生理状态下进行无损伤的系列“光学切片”。因而 CLSM在中国又被形象地称为“皮肤CT”,更易于被外科医生接受。10,11
本研究通过对57份标本分别进行CLSM扫描及快速冰冻病理切片检查,经统计学检验,CLSM检查与快速冰冻病理切片检查无显著性差异。该结果提示CLSM观察到的结果与快速冰冻病理切片检查结果具有较好的一致性,CLSM可以替代快速冰冻病理切片在Mohs显微切除术中应用。该结果中病理阴性的标本CLSM显示为阳性,此标本取样来自于基底细胞癌的患者,追究出现假阳性的原因是由于CISM操作者对于基底细胞癌影像掌握不够深入所致,需要加强对CLSM操作医师专业技能的培训与学习。本研究发现,快速冰冻病理切片制作、检查时间需要在45 min左右,而运用CLSM提供快速成像,大约需要10 min,且无需染色,可以动态的观察肿瘤组织,不受肿瘤组织种类的影响。同时大大的减少患者因多次麻醉造成的损伤,缩短了手术时间。快速冰冻病理切片制作、检查费用大约在700元,CLSM费用大约在160元,因此更易于被外科医生和患者接受。
总之,我们认为CLSM是一项具有临床应用前景的技术,在Mohs显微切除术中运用CLSM,不仅可以减少患者多次麻醉的损害,缩短手术时间、减少检查费用,而且还可以实时动态地观察皮肤肿瘤边界,连续观察切除组织每一平面,对可疑部分可进行多次、重复观察,提供客观、量化的评估指标。尽管运用CLSM尚存在组织固定困难,扫描深度较浅等不足12但CLSM的运用即可以提高外科病理学的管理而且还可以指导任何人体组织的显微手术。10
1李航.皮肤外科系列讲座(五)-Mohs显微描记手术.中国美容医学,2008,17(12):1807-1810.
2李欢,徐丽敏.共聚焦激光扫描共焦显微镜在皮肤科的应用.国际皮肤性病学杂志,2007(1):27-29.
3Gonzalez S,Rajadhyaksha M,Rubinstein G,et al.Characterixation of psoriasis in vivo by reflectance confocalmicroscopy.J Med,1999,30(5-6):337-356.
4 Swind le LD,Thomas SG,Freeman M,etal.View of normal human skin in vivo as observed using fluorescent fiber-optic confocalmicroscopic imaging.J Invest Dermatol,2003,121:706-7l2.
5 Rajadhyaksha M,Gonzalez S,Zavislan JM,etal.In vivo confo-
calscanning lasermicroscopy of human skin II:advances in instru-mentation and comparison with histology.J Invest Dermatol,l999,113(3):293-303.
6 Chung VQ,Dwyer PJ,Nehal KS,et al.Use of ex vivo confocal scanning lasermicroscopy during Mohs surgery for nonmelanoma skin cancers.Dermatol Surg,2004,30(12pt1):1470-1478.
7 Sauermann K,Gambichler T,Jaspers S,etal.Histometric data obtained by in vivo confocai laser scanning microscopy in patients with systemic sclerosis.BMC Dermatol,2002,8(2):8.
8 Choi J,Choo J,Chung H,et al.Direct observation of spectral differences between normal and basal cell carcinoma(BCC)tissues using confocal Raman microscopy.Biopolymers,2005,77 (5):264-272.
9 Tannous ZS,Mihm MC,Flotte TJ,etal.In vivo examination of lentigomaligna and malignantmelanoma in situ,lentigomaligna type by near-infrared reflectance confocalmicroscopy:comparison of in vivo confocal images with histologic sections.J Am Acad Dermatol,2002,46(2):260-263.
10Rajadhyaksha M,Menaker G,Flotte T,et al.Confocal examination of nonmelanoma cancers in thick skin excisions to potentially guidemohsmicrographic surgery without Frozen histopathology.J Invest Dermatol,2001,117(5):1137-1143.
11刘华绪,葛华勇,张福仁.反射式共聚焦激光扫描显微镜的原理.中国麻风皮肤病杂志,2010,26(12):860-862.
12 Paddock SW.Confocal laser scanning microscopy.Biotechniques,1999,27(5):922-996.
(收稿:2014-12-05 修回:2015-03-31)
Application of con focal laser scanningm icroscope in Mohs surgery
SUN Feng,ZHOU Kun,JIANG Xiao-ling,et al.Tai’an Skin Disease Hospital,271000
Objective:To determ ine the value of confocal laser scanningmicroscope(CLSM)in detection of tumormargins after Mohsmicrographic surgery.M ethods:Fifty-seven samples from 46 patients(once surgery in 36 patients,twice in 9 patients,three times in 1 patient)were detected by CLSM and fast frozen biopsy.Results:There was no tumor tissue in 46 samples and tumor tissue seen in 11 samples by fast frozen biopsy and there was45 samples and tumor tissue seen in 12 samples under CLSM.There was no significantdifference between CLSM scanning and fast frozen biopsy in detecting the margins of the tumors(P>0.05). Conclusion:CLSM can be used in allocating themargins of the tumor in Mohsmicrographical surgery for the substitute of fast frozen biopsy.
Mohsmicroscopic surgery;confocal laser scanningmicroscopy;skin tumor
1泰安市岱岳区皮肤病防治所,山东泰安,271000 2解放军第88医院病理科,山东泰安,271000
