白藜芦醇对UVA照射人成纤维细胞的光保护作用
2015-12-13卫陈凰徐学刚李远宏吴
雷 卫陈 凰徐学刚李远宏吴 严∗
·论著·
白藜芦醇对UVA照射人成纤维细胞的光保护作用
雷 卫1,2陈 凰1,3徐学刚1李远宏1吴 严1∗
目的: 明确白藜芦醇对长波紫外线(UVA)照射人成纤维细胞的光保护作用。方法: 细胞培养后,分为UVA组、UVA+0.01 mmol/L白藜芦醇组、0.01 mmol/L白藜芦醇组及空白对照组。采用MTT法检测细胞增殖活性,ELISA法检测上清液中白介素(IL)-1β蛋白水平,RT-PCR检测细胞中核因子-κB(NF-κB)、基质金属蛋白酶(MMP)-1,-3的mRNA水平。结果: 0.01mmol/L白藜芦醇组可提高UVA照射引起的细胞增殖活性的降低,降低UVA照射引起的IL-1β蛋白及细胞NF-κB、MMP-1和MMP-3mRNA的高表达。结论: 0.01mmol/L白藜芦醇可能通过抑制IL-1β和NF-κB及其介导的MMPs表达,从而抑制UVA照射对人成纤维细胞造成的光损伤。
白藜芦醇; 长波紫外线; 成纤维细胞
照射到地球表面的紫外线包括95%~98%的UVA和2%~5%的UVB。尽管UVA和UVB照射都会引起光老化,但UVA的剂量是UVB的10~1000倍,而且UVA照射一般深达真皮而作用于皮肤成纤维细胞。1紫外线照射可引起皮肤细胞的DNA损伤,是各种类型皮肤肿瘤的主要环境危险因素。2细胞核因子-κB(NF-κB)是一种与炎症有关的核转录因子,它可被紫外线和炎症因子激活,诱发IL-1、TNF-α、基质金属蛋白-1(MMP-1)等的表达。3UVA直接照射于人成纤维细胞可诱发MMP-1和MMP-3基因水平和蛋白水平的高表达,4,5从而导致胶原蛋白质量和数量的变化。6UVA照射还可诱发活性氧族(ROS)包括过氧化氢、超氧阴离子、单线态氧、羟基自由基、一氧化氮等的蓄积。7单线态氧可诱发IL-1的产生,8进而提高ROS活性,9,10最后诱导MMP-1和MMP-3高表达。4,11
白藜芦醇是自然界中的重要多酚类抗氧化剂,具有抗癌活性。12,13在白藜芦醇化学防护过程中,NF-κB、前炎症因子和MMPs等因子进行了不同程度的参与。有研究表明,白藜芦醇可通过干扰NF-κB活性调节人类角质形成细胞的炎症反应。14体外研究发现,白藜芦醇可通过抑制NF-κB的抑制蛋白(IκB)磷酸化和降解来阻断IL-1β刺激的人软骨细胞NF-κB p65亚单位活性。15体外研究发现,白藜芦醇可通过在mRNA和蛋白水平作用于MMP-1和MMP-3来发挥其抗炎和抗异化作用。15本研究中,我们将白藜芦醇加入到UVA照射的人成纤维细胞培养液中,检测与MMPs相关指标mRNA和蛋白水平的表达情况。
1 材料与方法
1.1 材料 DMEM培养基、胎牛血清、DS培养基(DMEM+10%胎牛血清);胰蛋白酶(Hyclone公司,日本);白藜芦醇(纯度>98%,雅诗兰黛公司,美国);ELISA试剂盒(R&D,美国);噻唑蓝(MTT);SSA-01型UVA照射仪(上海希格玛高技术有限公司,照射强度3.2 mW/cm2);550型酶标仪(Bio-Ran Laboratories Inc.,Hercules,加拿大);二氧化碳培养箱(BB16,德国);倒置相差显微镜(Olympus,日本)。
1.2 方法
1.2.1 细胞培养 取健康人包皮环切术后包皮组织,用含双抗(青霉素100 000 U/L、链霉素100 mg/L)的PBS缓冲液漂洗3次,在无菌条件下用眼科剪尽量剔除皮下脂肪组织,剪成0.5 cm×0.5 cm的皮片,加入0.25%的胰蛋白酶4℃消化过夜。次日分离真表皮,将真皮部分剪碎后加入适量0.25%的胰蛋白酶37℃消化5 min,加入完全培养基终止消化,200目尼龙网过滤,过滤后的细胞1000 r/min离心5 min,弃上清,加入适量完全培养基接种在25 cm2培养瓶中,置于37℃、5%CO2、饱和湿度条件的培养箱孵育。每3天换液1次,约3天左右可见贴壁的梭形成纤维细胞,2周左右单层梭形的成纤维细胞铺满瓶底。用0.25%的胰蛋白酶1∶2消化传代,取第4代对数生长期细胞用于进一步的实验。
1.2.2 检测白藜芦醇对细胞增殖的影响 实验分为UVA组、UVA+0.01mmol/L白藜芦醇组、白藜芦醇组及空白对照组。制备5×104/mL的细胞悬液,每孔200μL接种于96孔板。UVA组、UVA+0.01 mmol/L白藜芦醇组:UVA照射光源与细胞间距离为15 cm,UVA照射剂量为5 J/cm2,UVA照射时吸去培养基,加少量PBS缓冲液,照射结束后吸弃PBS缓冲液,按上述实验分组即刻加入含终浓度为0、0.01 mmol/L白藜芦醇(母液为200 mmol/L,二甲基亚砜配制)的DS培养基200μL。白藜芦醇组:加入含终浓度为0.01 mmol/L白藜芦醇(母液为200 mmol/L,二甲基亚砜配制)的DS培养基200μL。每组设6个复孔,继续培养6、24、48、72 h后,采用MTT法检测:加入MTT液(5 g/L,PBS配制)20μL,继续孵育4 h,弃去孔内培养基,加入150μL DMSO,避光震荡10min,直到紫蓝色沉淀完全溶解,于酶标仪450 nm波长处读取吸光度(A值)。独立重复实验3次。细胞存活率=(实验组A值-调零孔A值)/(空白对照组A值-调零孔A值)×100%。
1.2.3 酶联免疫吸附试验(ELISA)检测IL-1β分泌量 制备密度为5×104/mL的细胞悬液,定量接种于6孔板,按上述分组要求处理细胞,每组3个复孔。继续培养6、24、48、72 h后收集细胞上清液,将上清液按照试剂说明书要求加入已包被抗体的96孔板中,于酶标仪450 nm波长处读取A值。
1.2.4 RT-PCR检测体外培养成纤维细胞NF-κB、MMP-1、MMP-3 mRNA水平 细胞用PBS洗3次,使用RNAisoTMPlus试剂盒提取总RNA。据逆转录说明书,根据总RNA量加入适量的5×PrimeScriptR RTMster Mix及RNase-free水。反转录反应条件: 37℃15 min,85℃ 5 s,4℃。将所有的样本浓度调整至相当于RNA浓度30 ng/μL。在含有反转录产物的PCR反应液中,分别加入NF-κB、MMP-1、MMP-3引物。NF-κB引物:上游引物5'CGCATCCAGACCAACAACAACC-3',下游引物5'AGAGCCGCACAGCATTCAGG-3';MMP-1引物:上游引物5'CATGCCATTGAGAAAGCCTTCC-3',下游引物 5'AGAGTTGTCCCGATGATCTCC-3':MMP-3引物:上游引物5'GACAAAGGATACAACAGGGACCAAT-3',下游引物 5' TGAGTGAGTG ATAGAGTGGGTACAT-3';β-actin做内参照引物,上游引物5'TGCGTTACACCCTTTCTTG-3',下游引物5'ACCTTCACCGTTCCAGTTT-3'。PCR反应体积为25μL。反应条件:预变性95℃ 30 s,循环条件为:95℃ 10 s、60℃ 30 s,共40个循环。扩增产物经琼脂糖凝胶电泳,紫外凝胶成像系统扫描成像扩增产物。
1.3 统计学方法 应用SPSS 17.0软件包进行统计分析,所有数据以¯x±s表示。采用单因素方差分析进行检验,多重比较采取SNK检验。P<0.05为有统计学意义。
2 结果
2.1 细胞增殖率 0.01 mmol/L白藜芦醇对正常人成纤维细胞的细胞增殖活性无影响。UVA照射后6 h时细胞增殖率较空白对照降低大约10%,24 h时恢复至接近正常,48 h和72 h又下降至很低水平。0.01 mmol/L白藜芦醇加入UVA照射的细胞后,各个时间点的细胞增殖活性均得到了很好的保护(图1,图2)。
2.2 细胞因子IL-1β测定 空白对照组和白藜芦醇组的细胞上清液中IL-1β蛋白水平接近,且各个时间点之间无统计学差异(P>0.05)。UVA照射后,IL-1β蛋白水平在相应时间点上升了近15%(P<0.05),48 h时达高峰。0.01 mmol/L白藜芦醇加入UVA照射的细胞后,这种高水平又降至正常水平。(图3)
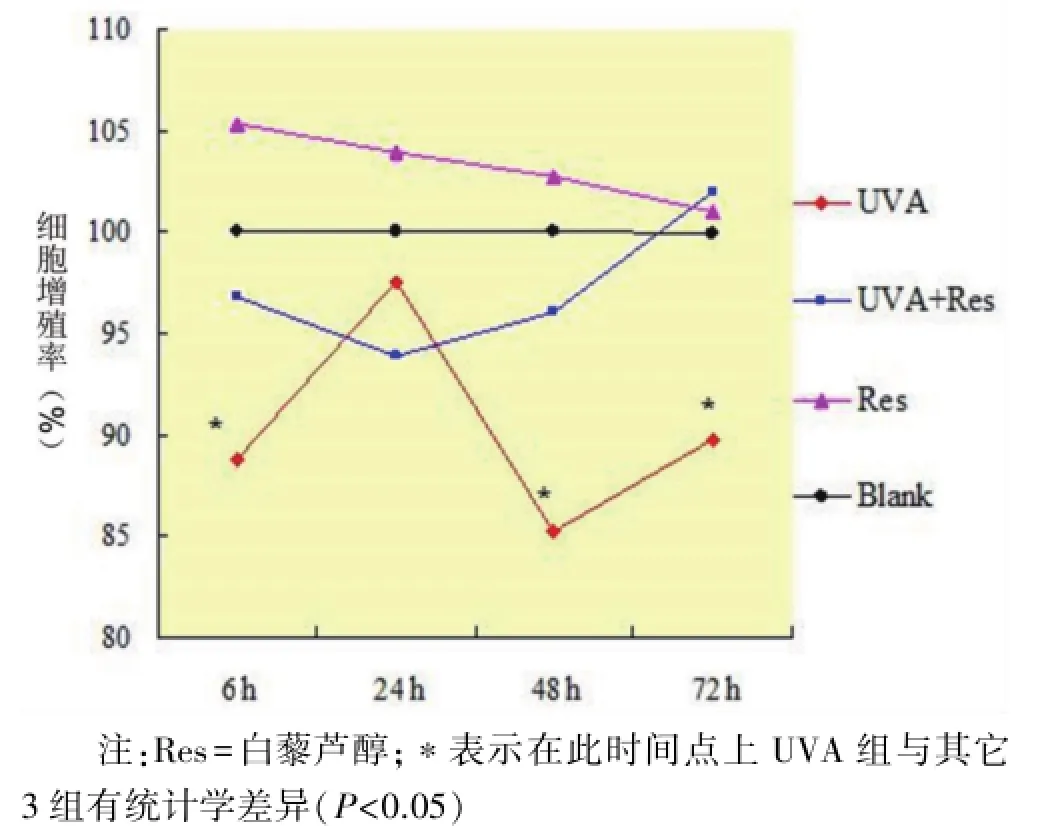
图1 MTT检测细胞增殖活性
2.3 RT-PCR检测结果
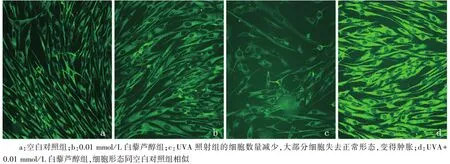
图2 倒置相差显微镜下人成纤维细胞形态(6 h时)
2.3.1 NF-κB 与空白对照组和白藜芦醇组相比,UVA组的NF-κBmRNA表达在6 h和24 h时显著升高约40%(P<0.05),48 h进一步升高,72 h时回落至正常水平(P>0.05)。加入0.01 mmol/L白藜芦醇后,可在6 h、24 h和48 h逆转上述高表达。(图4)
2.3.2 MMP-1和MMP-3 各个时间点上,空白对照组和白藜芦醇组的MMP-1 mRNA和MMP-3 mRNA无明显差异(P>0.05)。UVA照射后,这两个指标的mRNA表达显著升高,从6 h至48 h呈现正弦曲线趋势(高峰在24 h)。其中,MMP-1升高约85%,MMP-3升高约65%。72 h时,MMP-1 mRNA回落至正常水平,而MMP-3 mRNA反弹至较高水平。经0.01 mmol/L白藜芦醇处理后,MMP-1 mRNA水平在6 h至48 h得到了很好的抑制;而MMP-3 mRNA水平则在24 h至72 h被显著抑制(P<0.05)。(图5)
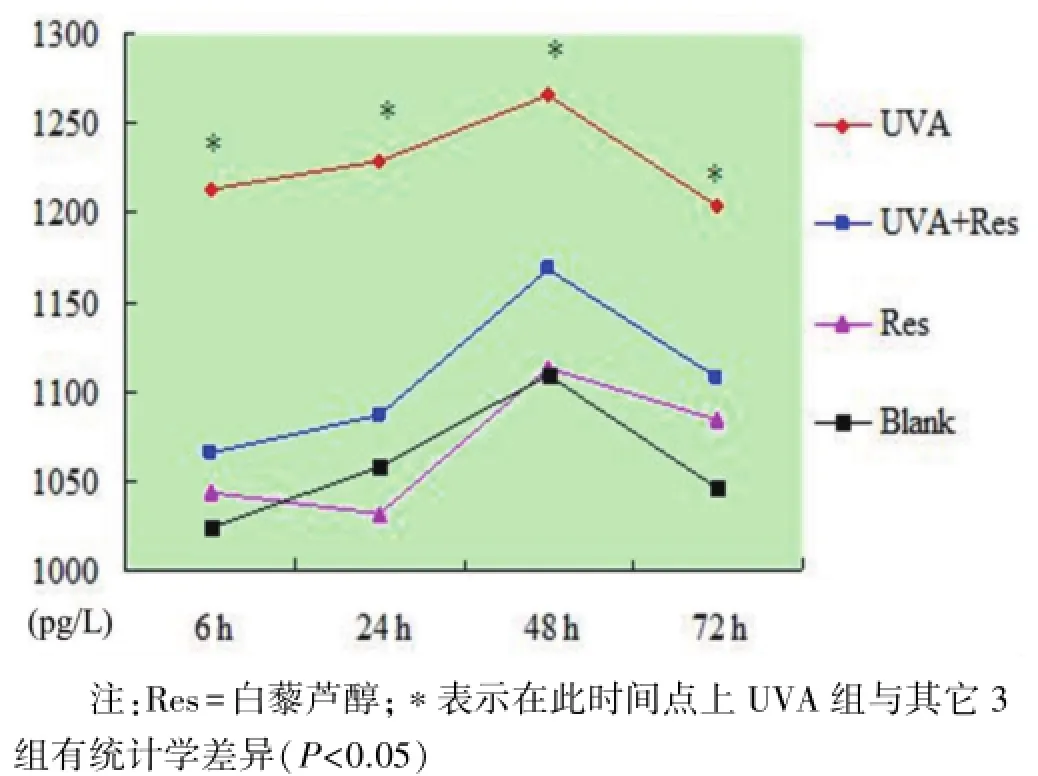
图3 ELISA检测细胞上清液中IL-1β蛋白表达
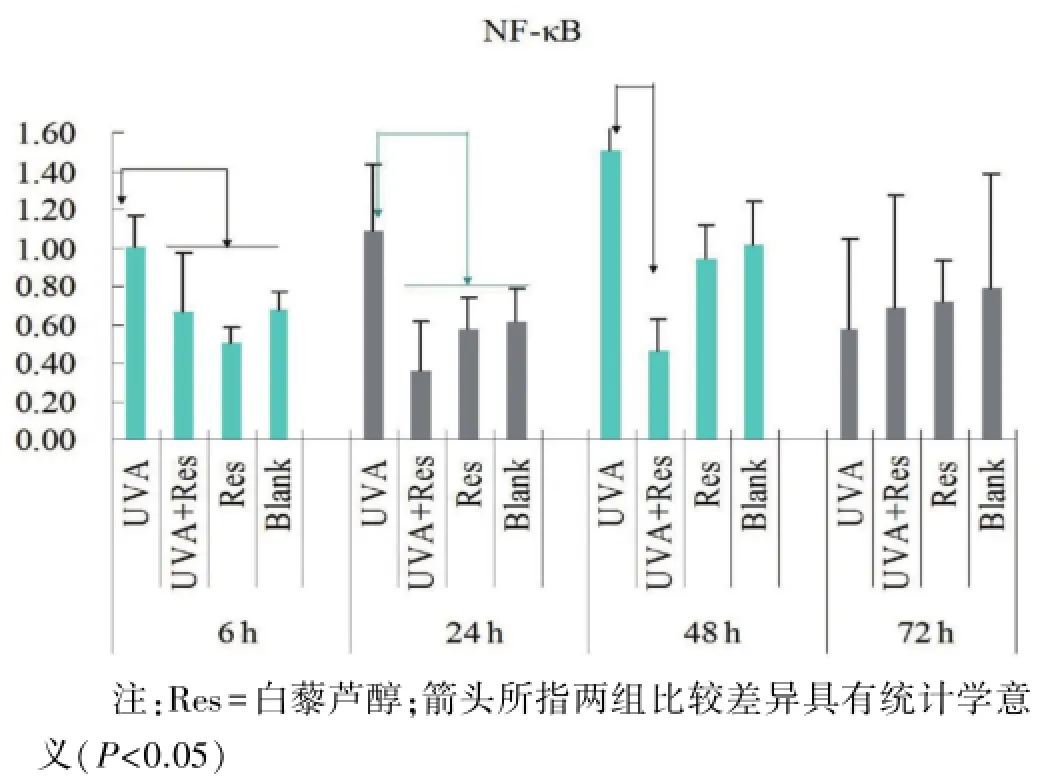
图4 RT-PCR检测细胞NF-κB mRNA表达
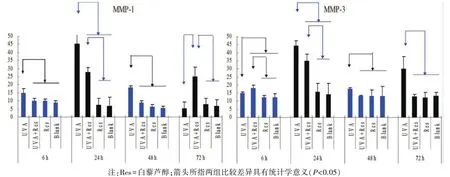
图5 RT-PCR检测细胞MMP-1mRNA和MMP-3mRNA表达
3 讨论
目前越来越多的研究证实白藜芦醇具有光保护作用,如抑制、延迟或逆转紫外线照射引起的破坏作用。然而,白藜芦醇存在不稳定的缺点,因为它容易转化成非活性的cis-形式(尤其在接受紫外线照射后更是如此),16,17且其自由基清除的特性使得它对于外源性的ROS更敏感。修饰白藜芦醇结构可增强白藜芦醇光保护作用和稳定性,有学者将白藜芦醇类似物加入到一种中性洗剂中,其光保护因子(SPF)和UVA保护因子均较之前有所增加,在另一项研究中,多酚甲基化有效地阻止了代谢结合反应,从而很大程度地增加了白藜芦醇的稳定性。182007年,有学者推出了一种新型白藜芦醇,即三磷酸白藜芦醇。这种白藜芦醇在角质层酸性磷酸盐的帮助下,通过渗透入皮肤并且转换成白藜芦醇原型而有效地传递活性复合物进入皮肤组织。19我们的前期研究将这种白藜芦醇外涂于日光模拟器照射的人体皮肤上,发现其可通过抑制日晒伤细胞形成和降低黑素形成来减轻日晒伤和晒黑。20本研究对此种白藜芦醇对UVA照射人成纤维细胞光保护作用进行了初步的实验研究。
本研究中,仅给予白黎芦醇处理的成纤维细胞与空白对照组细胞的增殖活性相近,提示0.01 mmol/L白黎芦醇对细胞无毒性,安全性好。经单次5 J/cm2UVA照射后,6 h时成纤维细胞的增殖活性即受到抑制,24 h时回复到接近正常水平,此后又被抑制。24 h时的回复可能是一种反馈机制在起作用,因为细胞内线粒体功能在UVA照射短期内会更加活跃,在此时间段更多的外源性MTT经琥珀酸脱氢酶还原成了不溶性的紫色结晶物。21但是随着时间推移这种作用被UVA后续破坏作用压倒,因此细胞增殖率在24 h以后进一步下降,直至72 h仍未能回复。加入0.01 mmol/L白黎芦醇至UVA照射的成纤维细胞后,上述4个时间点的细胞增殖活性均得到了很好的保护。
Gonzales等提出白黎芦醇和姜黄素可下调脂肪细胞TNF-α介导的NF-κB途径。22Jha的研究亦发现白黎芦醇可抑制严重急性胰腺炎患者NF-κB活性及与之密切相关的细胞因子IL-1和TNF-α。23Gonzales认为抗氧化剂的这种抑制作用可能是通过抑制NF-κB p65亚单位的核迁移和IκB降解而发挥作用,最终导致炎症因子如IL-1β和TNF-α等生成减少。22在我们的研究中,0.01 mmol/L白黎芦醇于6 h、24 h和48 h显著抑制了UVA照射诱导的成纤维细胞NF-κB mRNA高表达。UVA照射后6 h和24 h上清液中IL-1β蛋白呈现高表达,且一直持续到照射后72 h,0.01 mmol/L白黎芦醇加入后可显著抑制这种高表达。上述结果提示白黎芦醇可能通过抑制NF-κB及IL-1β发挥抵御光损伤的作用,与以往的研究结果一致。
还有研究表明,IL-1β可上调脂肪细胞内MMP-1 mRNA和MMP-3 mRNA的表达,而白黎芦醇可剂量依赖地抑制TNF-α诱发的MMP-1和MMP-3产生。24,25SIRT1是一种天然的白黎芦醇激活剂,可下调人类真皮成纤维细胞MMP-1和MMP-3表达。26我们的研究中,0.01 mmol/L白黎芦醇显著地抑制了成纤维细胞MMP-1 mRNA(6~48 h)和MMP-3 mRNA (24~72 h)的表达。上述结果与以往研究结果均提示白黎芦醇可能通过抑制IL-1β及与其密切相关的MMP-1和MMP-3发挥细胞保护作用。
综上所述,0.01 mmol/L白黎芦醇通过保护细胞增殖活性、下调IL-1β蛋白分泌、下调NF-κB、MMP-1及MMP-3 mRNA表达,逆转UVA照射诱导的人成纤维细胞光损伤,从而发挥抗光老化作用。
1Meunier L.Ultraviolet light and dendritic cells.Eur JDermatol,
1999,9(4):269-275.
2 Mason RS,Reichrath J.Sunlight vitamin D and skin cancer.Anticancer Agents Med Chem,2013,13(1):83-97.
3 Tanaka YT,Tanaka K,Kojima H,et al.Cynaropicrin from Cynara scolymus L.suppresses photoaging of skin by inhibiting the transcription activity of nuclear factor-kappa B.Bioorg Med Chem Lett,2013,23(2):518-523.
4 Gao D,Bing C.Macrophage-induced expression and release of matrix metalloproteinase 1 and 3 by human preadipocytes ismediated by IL-1 beta via activation of MAPK signaling.J Cell Physiol,2011,226(11):2869-2880.
5 Kut C,Hornebeck W,Groult N,et al.Influence of successive and combined ultraviolet A and B irradiations on matrix metalloelastases produced by human dermal fibroblasts in culture. Cell Biol Int,1997,21(6):347-352.
6 Kohl E,Steinbauer J,Landthaler M,et al.Skin ageing.JEur Acad Dermatol Venereol,2011,25(8):873-884.
7 Narayanapillai S,Agarwal C,Tilley C,et al.Silibinin is a potent sensitizer of UVA radiation-induced oxidative stress and apoptosis in human keratinocyte HaCaT cells.Photochem Photobiol,2012,88(5):1135-1140.
8W laschek M,Wenk J,Brenneisen P,et al.Singlet oxygen is an early intermediate in cytokine-dependent ultraviolet-A induction of interstitial collagenase in human dermal fibroblasts in vitro. FEBSLett,1997,413(2):239-242.
9 Chi PL,Chen YW,Hsiao LD,etal.Heme oxygenase 1 attenuates interleukin-1β-induced cytosolic phospholipase A 2 expression via a decrease in NADPH oxidase/reactive oxygen species/activator protein 1 activation in rheumatoid arthritis synovial fibroblasts.Arthritis Rheum,2012,64(7):2114-2125.
10 Kojima H,Kunimoto H,Inoue T,et al.The STAT3-IGFBP5 axis is critical for IL-6/gp130-induced premature senescence in human fibroblasts.Cell Cycle,2012,11(4):730-739.
11 Zaw KK,Yokoyama Y,Abe M,etal.Catalase restores the alteredmRNA expression of collagen andmatrixmetalloproteinases by dermal fibroblasts exposed to reactive oxygen species.Eur JDermatol,2006,16(4):375-379.
12 Caddeo C,Teskac K,Sinico C,et al.Effect of resveratrol incorporated in liposomes on proliferation and UV-B protection of cells.Int JPharm,2008,363(1-2):183-191.
13 Signorelli P,Ghidoni R.Resveratrol as an anticancer nutrient: molecular basis,open questions and promises.JNutr Biochem,2005,16(8):446-449.
14 Potapovich AI,Lulli D,Fidanza P,et al.Plant polyphenols differentiallymodulate inflammatory responses of human keratinocytes by interfering with activation of transcription factors NFkappaB and AhR and EGFR-ERK pathway.Toxicol Appl Pharmacol,2011,255(2):138-149.
15Wuertz K,Quero L,SekiguchiM,etal.The red wine polyphenol resveratrol shows promising potential for the treatment of nucleus pulposus-mediated pain in vitro and in vivo.Spine (Phila Pa 1976),2011,36(21):E1373-1384.
16 Aggarwal BB,Bhardwaj A,Aggarwal RS,et al.Role of resveratrol in prevention and therapy of cancer:preclinical and clinical studies.Anticancer Res,2004,24(5A):2783-2840.
17Mendes JB,Riekes MK,de Oliveira VM,et al.PHBV/PCL microparticles for controlled release of resveratrol:physicochem ical characterization,antioxidant potential,and effect on hemolysis of human erythrocytes.ScientificWorldJournal,2012,2012:542937.
18PoloniniHC,Lima LL,Goncalves KM,et al.Photoprotective activity of resveratrol analogues.Bioorg Med Chem,2013,21 (4):964-968.
19 Lee JS,Park KY,Min HG,et al.Negative regulation of stress-induced matrix metalloproteinase-9 by Sirt1 in skin tissue. Exp Dermatol,2010,19(12):1060-1066.
20Wu Y,Jia LL,Zheng YN,et al.Resveratrate protects human skin from damage due to repetitive ultraviolet irradiation.J Eur Acad Dermatol Venereol,2013,27(3):345-350.
21Ray RS,Agrawal N,Sharma A,et al.Use of L-929 cell line for phototoxicity assessment.Toxicol In Vitro,2008,22(7): 1775-1781.
22 Gonzales AM,Orlando RA.Curcumin and resveratrol inhibit nuclear factor-kappaB-mediated cytokine expression in adipocytes.Nutr Metab(Lond),2008,5:17.
23 Jha RK,Ma Q,Sha H,et al.Emerging role of resveratrol in the treatment of severe acute pancreatitis.Front Biosci(Schol Ed),2010,2:168-175.
24Moon MH,Jeong JK,Lee YJ,etal.SIRT1,a class IIIhistone deacetylase,regulates TNF-alpha-induced inflammation in human chondrocytes.Osteoarthritis Cartilage,2013,21(3):470-480.
25 Toegel S,Wu SQ,Otero M,et al.Caesalpinia sappan extract inhibits IL1beta-mediated overexpression ofmatrix metalloproteinases in human chondrocytes.Genes Nutr,2012,7(2):307-318.
26Ohguchi K,Itoh T,Akao Y,et al.SIRT1 modulates expression of matrix metalloproteinases in human dermal fibroblasts. Br JDermatol,2010,163(4):689-694.
(收稿:2014-11-10 修回:2014-11-17)
Protective effects of resveratrol on photo-damage of human fibroblasts induced by UVA
LEIWei,CHEN Huang,XU Xue-gang,et al.Department ofDermatology,No.1 Hospital ofChina Medical U-niversity,Shenyang,110001
Objective:To determine the protective effects of resveratrol on photo-damage of human fibroblasts induced by UVA.M ethods:Human fibroblastswere random ly divided into UVA group,0.01 mmol/L resveratrol group,UVA combined with 0.01mmol/L resveratrol group and blank control group.The proliferation of fibroblastswas detected by MTT.The level of IL-1βprotein was detected by ELISA.The levels ofmRNA expression of NF-κB,MMP-1,-3 weremeasured by RT-PCR.Results:0.01 mmol/L resveratrol increased the level of fibroblasts proliferation which decreased after UVA-induced and decreased the levels of IL-1βprotein,NF-κB and MMP-1,-3mRNA which increased after UVA-induced.Conclusion:Themechanism of the protective of resveratrol on the photo-damage of human fibroblast induced by UVA may be through regulating the expression of IL-1β,NF-κB and MMPs.
resveratrol;UVA;fibroblast
国家自然科学基金(青年科学基金项目)(编号:81301388)
1中国医科大学附属第一医院皮肤科,沈阳,110001 2武汉市中西医结合医院(武汉市第一医院)皮肤科,武汉,430000 3深圳市天美医疗美容医院激光科,深圳,518000∗通信作者
