残存概率法灭菌程序的设计与验证*
2015-12-10
残存概率法灭菌程序的设计与验证*
徐含青潘建良宋姗姗昝勤楠 / 苏州市计量测试研究所
摘要对使用残存概率灭菌法灭菌过程进行程序设计,并用合适的方法对过程进行验证。试验结果表明,该灭菌程序实现了灭菌设备在受控状态下运行,从而达到了需要的灭菌效果。
关键词灭菌;验证;残存概率;F0值
0 引言
随着人类社会的不断进步和发展,微生物的进化和变异对人类的影响日益加剧,从非典爆发到H7N9禽流感蔓延,无不威胁着人类社会文明的发展,人们不得不对灭菌质量提出更高的要求。WHO(世界卫生组织)与世界各国都致力于制定合理的灭菌规范和标准,用以评价灭菌效果和验证灭菌工艺。常用的灭菌方法可分为物理灭菌和化学灭菌。物理灭菌又分为干热灭菌、湿热灭菌、射线灭菌和滤过灭菌。其中干热灭菌器包含干热灭菌柜、隧道式灭菌系统,射线灭菌包含辐射灭菌、紫外灭菌等。化学灭菌包含气体灭菌和药液灭菌,其中气体灭菌主要包括环氧乙烷灭菌和臭氧灭菌等,药液灭菌包括甲醛灭菌等。
常规的湿热灭菌程序有过度杀灭法以及国际上现今流行的残存概率法。如何根据不同的被灭活产品及需要达到无菌保证水平(SAL)进行残存概率法灭菌程序的设计与验证,是本文研究的重点。
1 残存概率法灭菌的原理与方法设计
传统的灭菌方法称为过度杀灭法。在假设生物负荷最差情况下,来确定使被灭菌品达到微生物存活概率(SAL)10-6的杀灭时间。该方法针对于被灭活产品耐热性比较高、不存在长时间高温产生后续降解或者影响后续产品稳定性的因素。
1.1几个重要参数1.1.1DT值
耐热参数:在规定的灭菌条件下,使所用生物指示剂的数量下降一个对数单位,或杀灭90%所需的时间。在湿热灭菌中,D值需注明参照温度,即以DT表示。例如,一个D121℃=1.4 min的生物指示剂系统,表示在121 ℃下杀灭90%的芽孢需要1.4 min,其原理如图1所示。
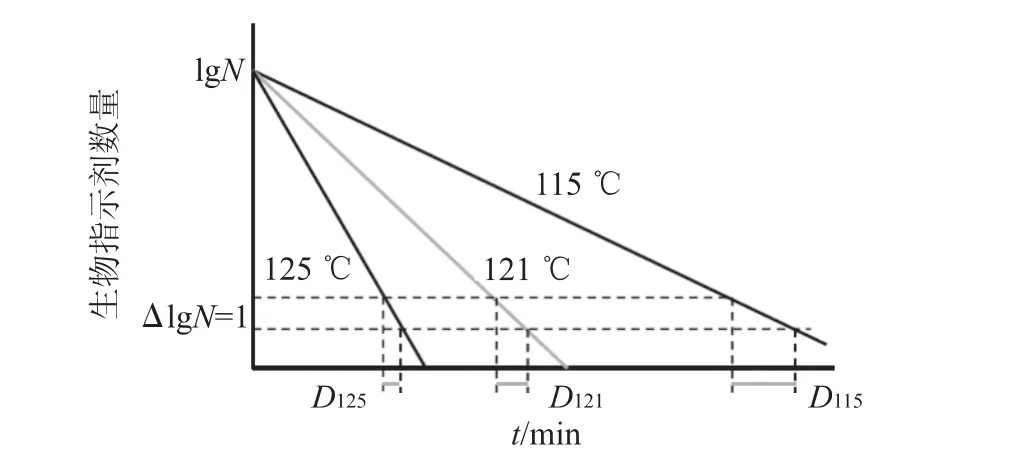
图1 耐热参数原理图
1.1.2F值
累计杀灭时间:灭菌效力的度量值。F(T,Z)是在规定的Z值下,一个灭菌程序赋予一被灭菌物品在参照温度T ℃下的等效灭菌时间,简称T ℃灭菌时间,是灭菌率L对时间的积分值。
1.1.3Z值
降低一个lgD所需要升高的温度:即灭菌时间降低到原来的1/10所需要升高的温度或在相同灭菌时间内,杀灭99%的微生物所需要提高的温度。其实验值一般为:湿热灭菌Z=10、干热灭菌Z=20、干热灭菌除热源Z=54。
1.1.4L值
灭菌率:用式(1)计算
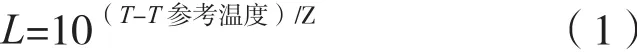
式中,参照温度121.1 ℃在数学上近似250°F,实际工作中为简化计算,一般采用121 ℃。
1.1.5F0值
标准灭菌时间:是指Z取10 ℃时,一个湿热灭菌程序赋予被灭菌品121.1 ℃下灭菌的等效灭菌时间。例如,当生物指示剂的Z取10 ℃,F(T = 121.1 ℃,Z=10 ℃)赋予被灭菌品8 min的程序,或F0为8,与一个116 ℃灭菌25.9 min方形灭菌波是等效的(F0均为8),使用式(2)计算:
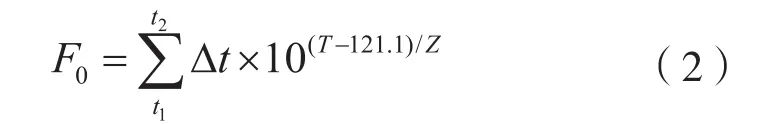
1.2残存概率法灭菌原理
残存概率法对产品的后续降解可产生最小的影响水平,有利于被灭活产品的稳定性。正是由于这个原因,该方法更适合于耐热性较差的灭菌物品,也是当前湿热灭菌的主要工艺。残存概率法的灭菌原理基于微生物的死亡符合一级动力学规则,杀灭率是耐热性的函数,与微生物的数量无关。残存概率曲线可用如下函数与图2表示:
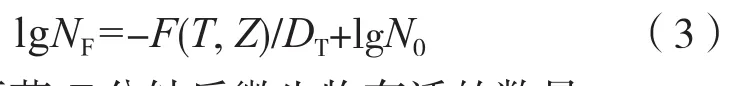
式中:NF— 灭菌F 分钟后微生物存活的数量;
N0— 初始微生物的数量;
F(T,Z) — 灭菌程序在确定的温度系数Z下的T ℃等效灭菌时间;
DT— 微生物以分钟为单位的T ℃耐热参数,该特定温度必须与F值计算中所采用的温度相一致
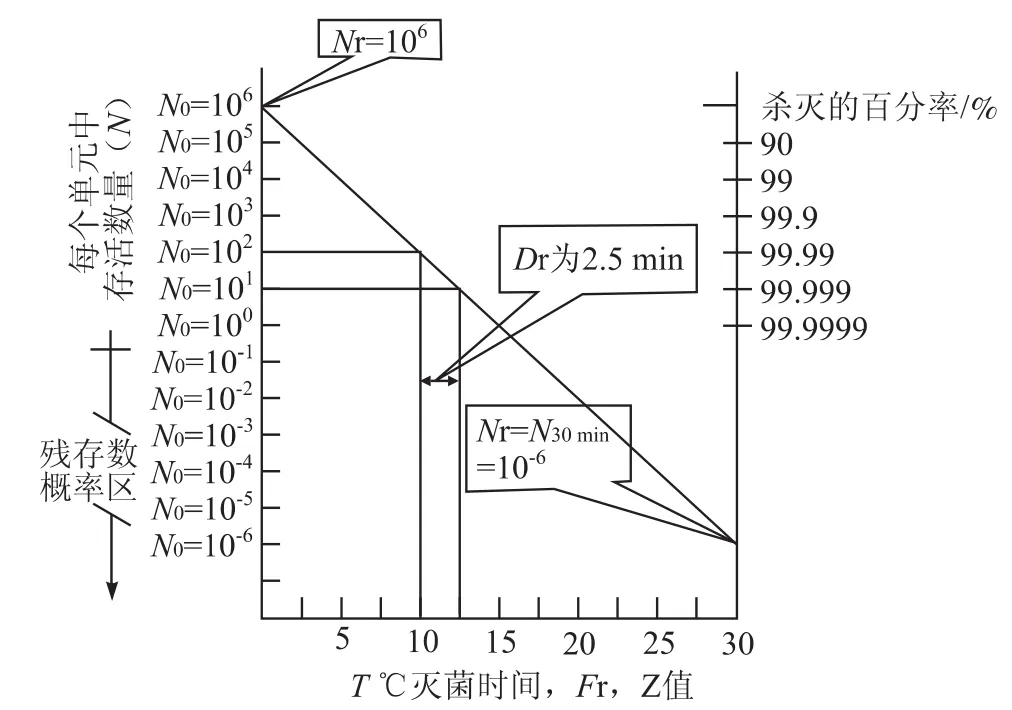
图2 “残存概率法”灭菌原理
1.3残存概率法灭菌方法设计
根据以上参数与原理,即可设计出一定无菌保证水平(SAL)的灭菌程序。自然界中很少能够检到D121℃> 0.5 min的微生物,为设计过程降低风险,取DT值为2.5 min,为风险点的5倍,初始微生物数量一般制药企业可达万级水平,为降低设计过程风险,放大取初始微生物数量100倍,假定为106。
如果灭菌设计时间为30 min,经计算即可得到NF为10-6,也就是说,灭菌30 min,无菌保证水平(SAL)为一百万分之一。设计过程如下,该过程也就是常用的过度杀灭过程:
lgNF=-F0/2.5+lg106
lgNF=-30/2.5+lg106
lgNF=-12+6
lgNF=-6
NF=10-6
而常规的设计程序需要验证其F0值,也就是根据设计程序来计算出等效的标准灭菌时间。将公式重新排列,设计过程如下,取DT值为2.5 min,为风险点的5倍,目标无菌保证水平为2 000,设计过程如下:
F0=(lgN0-lgNF)DT
F0=(lg106-lg2×103)×2.5
F0=(6-3.3)×2.5
F0=6.75 min
根据以上设计过程,即可根据实际情况进行风险评估,假设初始的微生物数量,适量放大DT值的取值倍数来任意设计灭菌程序,以达到一定的无菌保证水平(SAL)目标。
2 残存概率法灭菌过程的实验验证
由于我国《药品生产验证指南》(2003版)、《消毒技术规范》《药典》均没有对物理参数进行验证的实际操作规范可以参考,现依据欧盟标准EN554《Validation and routine control of sterilization by moist heat-English version of DIN EN554》和英国标准HTM2010《Health Technical Memorandum 2010》进行物理参数验证,并根据上述标准的技术指标,对检测结果进行分析。
2.1选用的测试设备
如表1所示。
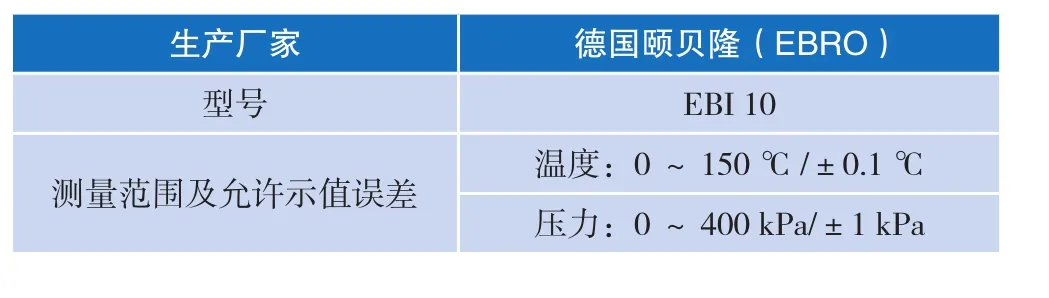
表1 测试设备技术指标
2.2测试对象
如表2所示。
2.3布点情况
分布方式为12个温度点,1个压力测试点,测量时传感器测量探头不能接触料架表面,根据HTM2010的建议,排水口处分布1个温度点,其他温度点均匀分布,如图3所示。
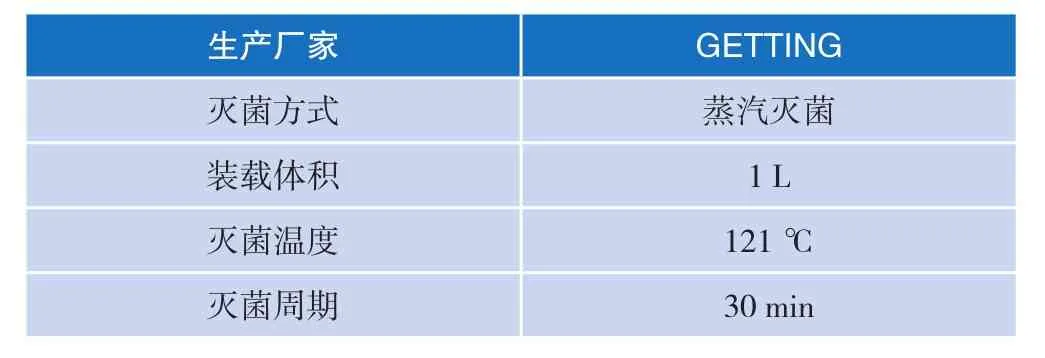
表2 测试对象技术指标
2.4灭菌目的
负载SAL≤10-6。
2.5验证部分
由于数据量极大,截取部分数据如表3所示。
2.6计算F0值
计算部分由于数据量极大,截取部分数据如表4所示。

图3 传感器布放位置实物图
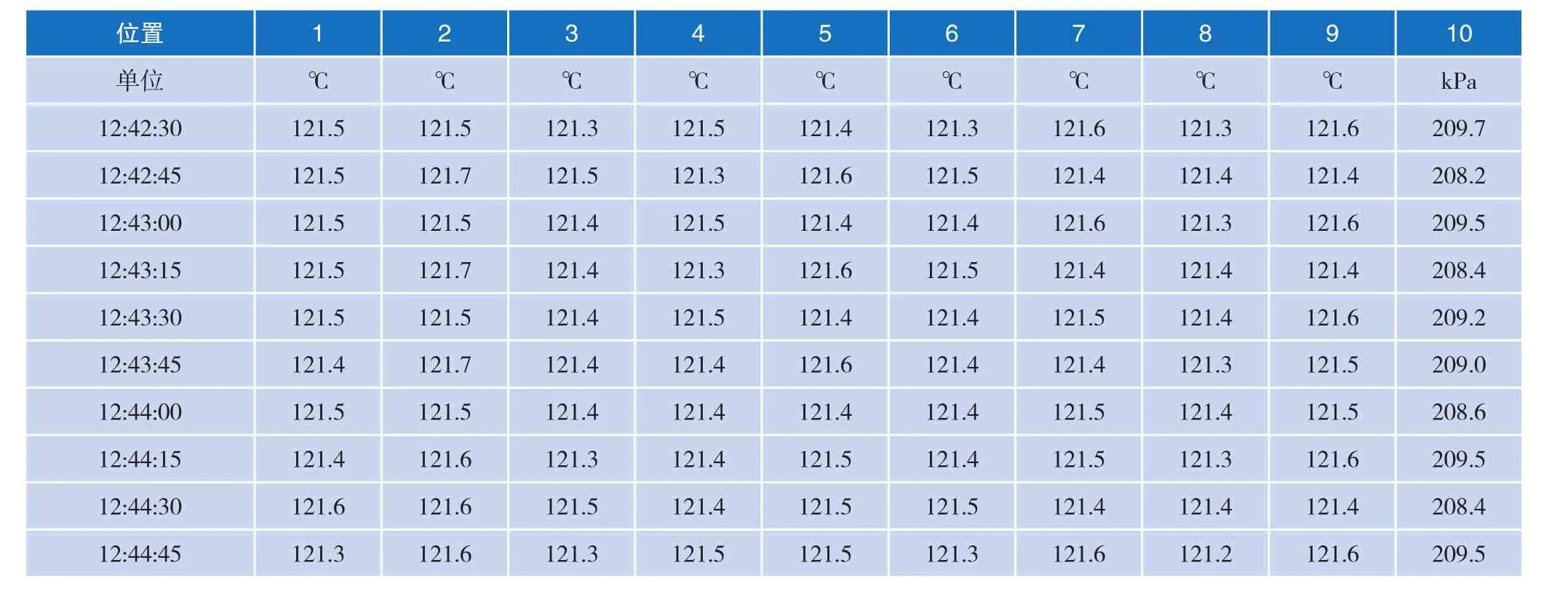
表3 验证实际数据
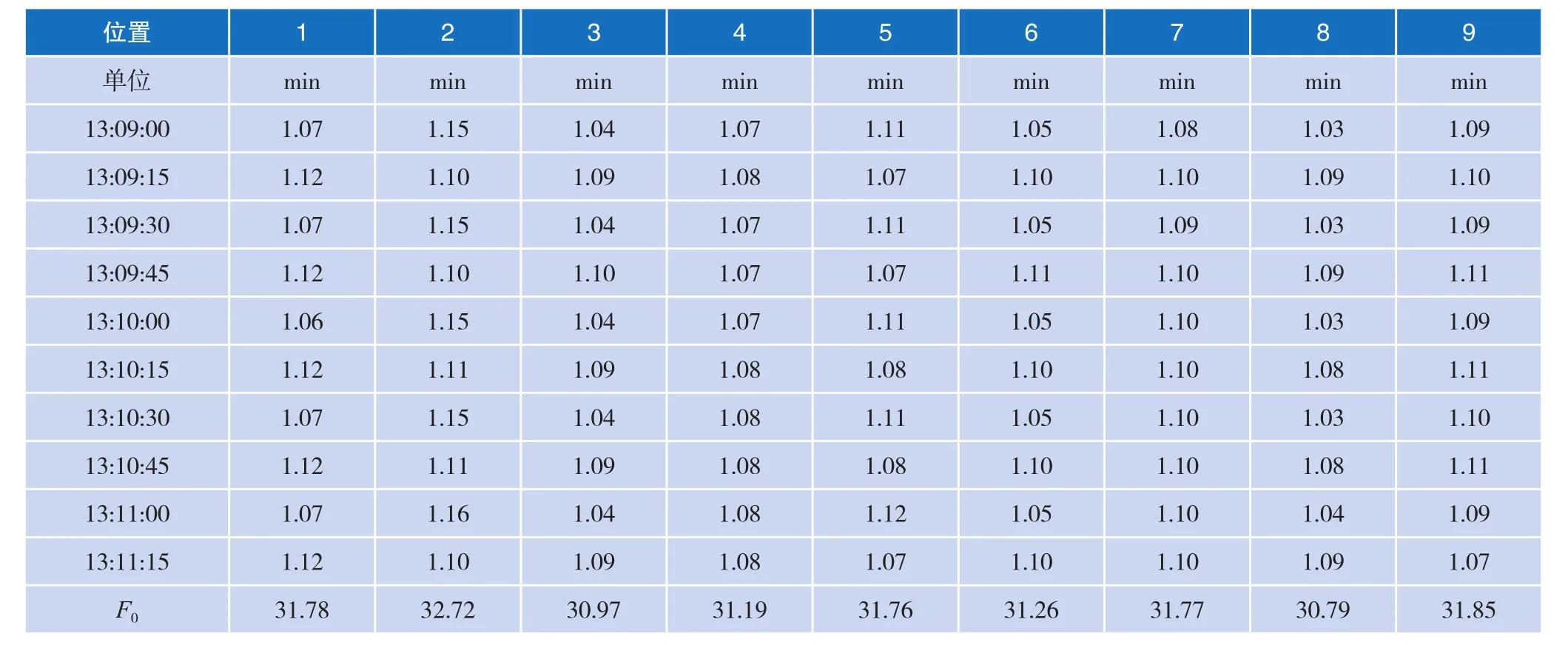
表4 F0值实际计算过程数据
3 结语
通过以上一系列原理与验证实验过程的叙述,深入分析了残存概率法灭菌程序在生物制药企业无菌保证工艺过程中的应用,在实践过程中,需要依
据以上原理来验证各个设计出来的灭菌过程的质量,综合考虑空载、满载、半载等各种装载的影响,以及蒸汽质量对热穿透效果的影响。国内由于GMP实施的时间较晚,技术能力还比较薄弱,很多先进的理念还没有及时采用,导致很多风险点的产生,因此必须不断学习总结,在采用国际先进标准的同时,善于分析,从而解决应用过程中的实际问题,为进一步提高积累经验。
参考文献:
[1] 全国温度计量技术委员会.JJF1308、2011[S].北京:中国质检出版社,2011.
[2] 江苏省热工计量专业技术委员会.JJF(苏) 96-2010[S].南京:江苏省质量技术监督局,2010.
[3] 国家食品药品监督管理局药品认证管理中心.药品生产验证指南[S].北京:化学工业出版社,2003.
[4] Anon. Sterilization of medical devices—validation and routine control of sterilization by moist heat:EN554 [S].European Committee for Standardization,1994.
[5] Anon. Health Technical Memorandum (HTM) 2010-sterilization
validation and verification [M] . NHS Estates, An Executive Agency of the British Department of Health,1998.
Design and verification of the sterilization program according to bioburden based process
Xu Hanqing, Pan Jianliang, Song Shanshan,
Zan Qingnan
(Suzhou Institute of Measurement and Testing Technology)
Abstract:According to bioburden based process, a sterilization program has been designed, and verificated by appropriate means. The testing results showed that sterilizing equitments operated in a controlled state, and the desired effect of sterilization has been achieved.
Key words:sterilization; verification; bioburden based process; F0value
*基金项目:苏州市科技基础设施建设计划资助项目(ZXJ2013002)
