3D打印技术与骨科植入物研发现状及其瓶颈突破思路
2015-12-10汤啸天王燎
汤啸天 王燎
◆现代医学与法律
3D打印技术与骨科植入物研发现状及其瓶颈突破思路
汤啸天 王燎
植入物是骨肌系统治疗的核心要素,其社会及经济影响巨大。骨科植入物国产化及个体化需求倒逼研发工作;在骨科植入物研究领域中,3D打印技术的临床应用已经铺平了道路,基于3D打印技术的骨科植入物研发亟待法治化保障。个体化生产是3D打印技术的优势也是法律限制的瓶颈,需改革创新方能突破3D打印技术医疗应用瓶颈。破解3D打印技术个体化生产医疗器械难题的思路:第一,报请国家食药监局批准在上海建立3D打印技术临床应用试点;第二,建议签署《合作共识备忘录》共同防范风险;第三,建议开发特殊意外保险推进科学技术创新。
3D打印技术;骨科植入物;科技创新;法治保障;瓶颈突破
骨肌系统疾患尽管一般不直接导致死亡,但却是最普遍的求医原因之一,是导致残疾、工作能力丧失和生活质量下降的最常见原因。为唤起公众对骨肌系统疾患的重视,世界卫生组织将21世纪的首个十年定为“骨与关节十年”。
近年来,日益加重的人口老龄化更是导致骨肌系统疾病发病率在全球范围内逐年上升。过半数老年人由于关节退行性变而长期处于慢性疾病状态。据推算,40%超过50岁的妇女在其有生之年将发生至少一次骨质疏松性骨折。以美国为例(3亿人口),每年有超过1.3亿人次患者因骨肌系统疾患就诊;2005年,全美约1亿成人、近50%存在超过3个月的骨肌系统疾患状态,甚至是其他系统疾患的两倍以上;2012年,骨肌系统发病率已超过50%(见图1)。[1]此外,交通运输的高速化导致交通事故损伤显著增加,这在交通管理体制尚不完善的发展中国家更为严重,治疗该类损伤可占健康支出的25%。中国作为一个未富先老的发展中国家,同时具有老龄相关骨肌系统疾患及创伤性损伤,骨肌系统疾患更为严重,造成有效劳动力下降,加重社会经济负担。
手术治疗是骨肌系统疾患的根本治疗措施,治疗过程中往往需依赖各种植入物,而骨科相关植入物又是医疗各系统中价格最高的,这就决定了骨科相关植入物将在医疗相关支出中占据较大比重。因此,骨肌系统植入物的自主研发及制造无论是在社会民生角度还是经济产业角度都是至关重要的。
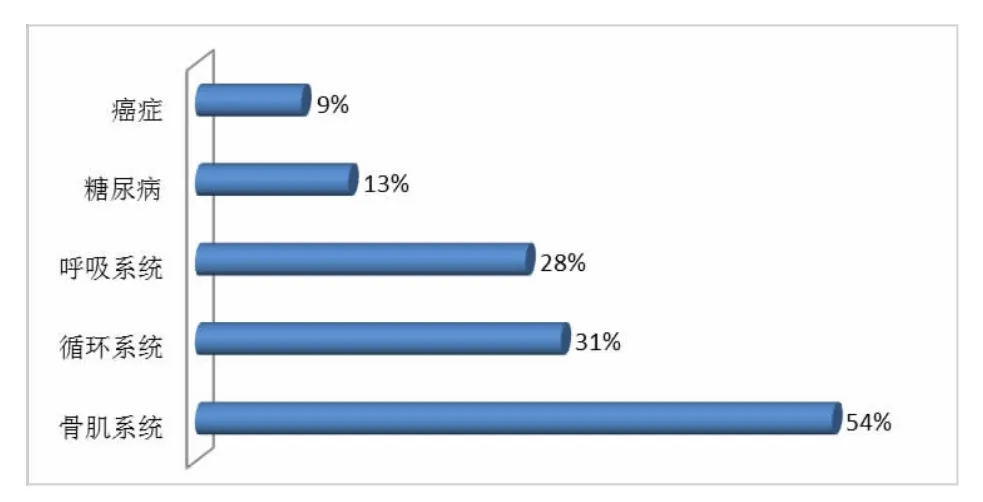
图1 美国2012年慢性病发病率统计
一、基于3D打印技术的骨科植入物国产化、个体化研发现状
(一)植入物是骨肌系统治疗的核心要素,其社会及经济影响巨大
骨肌系统常见疾患包括骨关节退行性变、脊柱创伤及退行性变、四肢创伤、骨缺损、骨质疏松及骨肿瘤等。从发病机理上看,大多数骨肌系统疾患和局部解剖及生物力学状态密切相关,这也决定了骨肌系统疾患相关植入物需要参考局部解剖形态来设计,进而改变其不利的生物力学状态。
作为骨肌系统疾患治疗的核心要素,骨肌系统植入物又可分为关节植入物、脊柱内固定系统、骨折内外固定系统及骨生物替代材料等。据美国F&S公司所提供的资料,全球骨科植入器械市场从2006年的129亿美元增加到2009年的173亿美元,年复合增长率达10.4%,预计到2015年可达277亿美元。我国的骨科植入物器械市场目前已经是全球整体市场的重要组成部分,并且很可能是其未来进一步增长的重要引擎。据美国F&S估计,我国骨科植入物市场在2015年将增长到166亿人民币,年复合增长率达18.1%。我国骨科植入物市场已从2005年的全球第八大市场成长为2010年的第三大市场,照此趋势,在2015年将超过日本成为第二大市场。中国巨大的市场潜力为全世界所共知,国外植入物公司早已进驻我国各大城市,国外植入物公司目前牢牢把持着国内骨科植入物的高端市场:2009年,外资企业合计占国内市场的56%,包括强生、美敦力、捷迈、辛迪思、史塞克等;其中,关节市场国外品牌占64%,脊柱类占61%,创伤类占43%。这不仅意味着大量资金流向国外,更为重要的是,关乎人民健康的关键行业在某种意义上为国外企业所把控,有碍我国的科技创新。
(二)骨科植入物国产化及个体化需求倒逼研发工作
从宏观角度看,患者目前已不满足通过骨科植入物来缓解疼痛及恢复基本的运动功能,而是要求最大限度地恢复其原有功能。以关节为例,若要实现关节功能最大程度的恢复,这就要求新一代人工关节与个体具有更好的解剖学及运动学的匹配。亚洲人的骨骼尺寸及各部分比例关系和欧美人存在一定差异,在行为运动方面也存在较大差异,包括深蹲、下跪、盘腿等动作。因此,结合国人自身的解剖结构及行为运动特征,进一步改进植入物设计,设计适合中国人的植入物是十分必要的。同样,在创伤、脊柱类及骨替代材料产品方面也存在本土化的迫切需求。
从技术层面看,个体化治疗是21世纪医学发展的重要方向。以人工关节为例,自其诞生的第一天起就被打上了第二次工业革命的特征性标记,同一款假体具备完全一致的解剖形态,仅存尺寸差异。这种设计的确能满足大规模生产,降低研发及生产成本,加速产品的更新换代。作为现代人工关节诞生标志的Charnley人工关节,就是统一设计的、一块式的产品,其单一设计、流水线型生产及其使用模式,的确有利于形成标准化的治疗方案,提高工作效率,且能满足多数患者的治疗需要,但是处于人群分布偏两端的患者却成为了这一医学模式的受害者。临床工作中,常见假体尺寸或有几何结构不匹配的情形,此时施术者往往会根据假体形态来改造患者解剖结构以保证手术的完成,这种“削足适履”的手段,显然有影响手术效果的风险;而且,常规人工关节不仅给关节外科医师带来更大的挑战,同时也增加围术期并发症的发生率,更长远地看,还可能造成人工关节使用年限缩短等。为更好地满足临床需求,假体设计者开始改造一块式的假体,给假体各部件的连接部增加了更多的调节因素。以人工髋关节为例,当代假体可以调整股骨头直径、颈长、偏心距、甚至股骨颈前倾角。这样的尝试当然有助于减小假体不匹配率,但仍不可能满足所有患者的需要,如显著解剖畸形、肿瘤及翻修的患者。[2]
典型的例子是骨盆恶性骨肿瘤的切除与重建。骨盆恶性骨肿瘤病变范围存在不确定性,为保障手术的彻底性,降低肿瘤复发率,手术医生寻求各种根治术或扩大根治术,更是增加了残存骨盆结构的复杂性,进而增加了重建难度。尽可能恢复患者的正常解剖结构是保障术后患肢功能的重要前提之一,医生针对病变范围进行量体裁衣,立足残留骨盆结构个体化设计半骨盆假体,实现假体与残留结构的最佳匹配,实现术后患肢功能的最优化。[3]首先,重度DDH或翻修患者,髋臼周围可存在较大骨缺损,无法提供有效覆盖,从近期及远期看,均不利于臼杯获得足够的支撑,进而影响臼杯固定,而个体化的结构性植骨或是定制型Cage有利于保证外上方支撑。[4]此外,DDH患者存在股骨髓腔过细、解剖轮廓异常、常规假体无法置入的情况,同样需要设计及植入定制型假体。另外,小儿麻痹或侏儒症患者由于发育不良、骨骼尺寸小,给手术植入物的选择带来困难。[5]可见,无论是从优化人工关节设计角度,还是满足特定患者需要的角度,个体化人工关节都值得关注。个体化人工关节在设计上更贴合患者个体的解剖学特征,理论上可带来更好的临床效益。
(三)个性化人工关节数字制造系统发展的受限因素
纵观人工关节发展史,我们不难发现,先进治疗理念的形成、假体设计与制作技术的不断进步是最为关键的影响因素。当然,这些进步首先是依赖于工程学的进展。人工关节从早期的手工设计,发展到现行的数字化设计,无不与工程技术息息相关。以个体化人工关节为例,20世纪中叶,研究者开始进行第一代定制型人工关节的设计和制作,当时是在二维平面的X线片上进行测量,然后依据放大率算出实际的骨关节尺寸,再在图纸上进行假体设计,最后再交给医疗器械厂家在机床上制作出假体。但是二维评估及设计,往往无法获得关键结构的空间细节,就使其治疗甚至不能超过常规人工关节。到了20世纪80年代,随着计算机技术的普遍应用,第二代个体化人工关节的假体设计制作也逐渐实现了数字化。首先是数据采集由二维平面的X线片转变为三维的CT,然后将CT三维数据直接导入计算机,利用CAD软件在计算机屏幕上进行假体设计,最后交给厂家,厂家通过带有CAM软件的数控机床进行假体加工制作。通过数字化设计制作,大大提高了假体的设计和制作质量,有望进一步改善疗效。
为实现骨科植入物研发的本土化,更好地满足国人的解剖及运动习惯,实现对特殊人群的完美匹配,早于1987年,原上海第二医科大学附属第九人民医院戴尅戎院士和上海交通大学机械学院王成焘教授就通过医工结合模式开展了国产化、个体化骨科植入物及相关临床置换技术的合作研发工作。作为我国个体化人工关节的奠基者,他们将CAD/CAM (Computer Aided Design,计算机辅助设计;Computer Aided Manufacturing,计算机辅助制造)集成制造技术引入个体化假体医学领域,初步建成一个可面向临床应用的工程平台,实现了工程系统的临床化,建成,直接面向临床的个性化人工关节数字制造系统。个体化或定制型人工关节是在常规人工关节基本设计理念的基础上,根据不同病人的解剖特点进行假体设计、制作和植入。显然,个体化假体与人体匹配程度高,理论上具有更好的长期疗效。二十五年来,在国家和地方多项科研和产业化项目支持下,其初步实现了产业化,先后获得上海市科技进步一等奖(2001)、国家科技进步奖二等奖(2004)等多项国家和省部级奖项。截至2014年,在上海第二医科大学附属第九人民医院已经完成了105例个性化人工关节置换,所建产业与技术服务中心为全国96家医院提供了6000余例个体化植入物器械与产品服务。不可否认,个体化植入物的总使用量并不大,因为临床工作还有“时限要求”这一关键因素,即在优化效果的同时还需兼顾效率及效益。但要实现产业化及常规化,除量体裁衣设计出最优化的植入物外,还需考虑如何将个体化治疗的技术优势转化为临床效益,克服费时、费钱及费力的弊端,灵活组合相关支撑技术部门,通过区域网络联盟快速、有效地实现以下技术的整合,如3D打印技术、反求技术、数控加工及网络制造等。
(四)3D打印技术是检验数字化设计、实现数字化制造的高速公路
增量制造(Additive Manufacturing,AM),俗称“3D打印技术”,是快速原型技术(Rapid Prototyping Technology,RPT)的一个重要分支,是近年来发展起来的直接根据CAD模型快速生产样件或零件的技术总称,它集成了CAD技术、数控技术、激光技术和材料技术等现代科技成果,是先进制造技术的重要组成部分。快速成型从零件的CAD几何模型出发,通过软件分层离散和数控成型系统,用激光束或其他方法将材料堆积而形成实体零件。由于它把复杂的三维制造转化为一系列二维制造的叠加,因而可以在不用模具和工具的条件下生成几乎任何复杂的零部件,这极大地提高了生产效率和制造柔性。

图2 金属3D打印技术工艺过程示意图
3D打印技术最早使用在模具、汽车、家电、建筑、轻工、航空航天等领域,近年来开始开拓其在医疗方面的应用。其中,3D打印技术最常用的医学领域之一就是骨科植入物。骨科植入物要求能与局部解剖相匹配,进而构建最佳的生物力学环境。近十年来,在骨科植入物研究领域中各种技术不断成熟,如数字化测量、建模、模型分割、数值虚拟、数控技术等都为3D打印技术的临床应用铺平了道路。伴随计算机软硬件设备的进一步提升,数字化设计、制造及加工在效率上已经能满足个体化设计、制造的要求。此外,3D打印技术还是目前最为节省材料、加工方式最灵活的一种制造技术。也正是由于具有这些特点,3D打印技术可促进企业的产品快速创新开发,以及单件小批量制造。
二、基于3D打印技术的骨科植入物研发亟待法治化保障
众所周知,科技创新是我国现代化建设所面临的“短板”之一,而科技创新又必须以法治保障为前提。科技创新的法治化保障作为科技领域落实全面推进依法治国基本方略的组成部分,是新时期医学技术发展与法治建设的共同内容和使命。“科技创新的法治化保障”,是指以完备的法规制度体系为基础,将法治理念和行为贯彻于科技创新管理全过程,以推动科技创新向科学化、规范化、制度化方向发展。科技创新法治化保障的实质,是依靠法规制度规范约束政府科技行政管理行为,激励创新活力,整合创新力量,通过保障创新主体的合法权益,实现全社会获益的根本目标。
(一)个体化生产拥有3D打印技术的优势但也受限于法律缺失、制约的瓶颈
在产业化的进程中,我们不难发现,除去工程学技术的进步外,法律法规的保驾护航同样关键。尽管骨科临床医师、科研工作者及相关企业在个体化骨科植入物领域已有多年探索,尽管目前相关的工程学技术已趋向成熟,早期加工过程繁琐、效率较低等因素已得到克服,但个体化植入物应用于临床的病例在可见的未来仍将是在小范围开展。其根本原因,是个体化骨科植入物、甚至是常规新型国产化骨科植入物的研发及生产,在目前的医疗器械的审批条例规定下还难以快速推进——当前关于医疗器械审批的法律法规是根据批量产品的生产特点进行设计的,而对于个体化及3D制造的产品还没有明确规定,这方面法规指导的缺失,导致医生、企业家、工程师及患者都无所适从。
3D打印技术与传统的医疗器械生产相比,它有能力实现医疗器械产品个体化快速生产。个体化生产所对应的是人的个体差异,即不同个体之间在解剖特征上相对稳定的不相似性。个体化生产医疗器械并不是医生的别出心裁,而是每一位患者所需要的“那一个”植入器材各不相同,患者的个体解剖特征或缺损部位的差异性决定了需要“按需生产、按需供货”。通俗地说,当活生生的“那一个”,与硬邦邦的“那一批”不相吻合的时候,法律的规范也应当为“那一个”提供帮助。3D打印技术已经为人体植入物的制造创造了条件,如果临床应用却还继续停留在“削足适履”的阶段,那么就是技术虽然已经发展但又被迫与时代脱节。正如戴尅戎院士所说:“目前,全世界每年有几百万患者需要进行人工关节置换。国内使用的关节植入物半数以上来自欧美国家,它们的设计完全按照西方人体解剖结构特征,和国人差别较大。当前国内外的每种假体的型号有限,全世界每年要为上百万不同年龄、不同性别、不同种族、不同体型的病人置换不同破坏程度的关节,所用的人工关节却只有5~10个规格,实在很难做到按照病人的骨骼特点‘量体裁衣’。所以过去我们只能对骨骼进行‘削足适履’来获得较好的匹配,但即便如此,仍有部分严重畸形的病人无法选择到合适的假体。”[6]
(二)促进改革创新方能突破3D打印技术医疗应用的瓶颈
1.现行法规未禁止3D打印技术在医疗领域的应用。
《医疗器械监督管理条例》(以下简作《条例》)于2000年1月4日由中华人民共和国国务院令第276号公布,2014年2月12日国务院第39次常务会议修订。医疗器械是指单独或者组合式用于人体的仪器、设备、器具、材料或者其他物品(包括所需要的软件),其用于人体体表及体内的作用不是用药理学、免疫学或者代谢的手段获得,但可能有这些手段参与并起一定的辅助作用。3D打印技术临床应用符合医疗器械使用“对损伤或者残疾的诊断、治疗、监护、缓解、补偿”的目的,所制造的医疗器械属于医疗器械应当是没有异议的。但是,《条例》制定时,国内外还没有3D打印技术在医学界应用的先例,在内容中不可能作出相关的规定。这种法律没有规定的新兴技术应用,一方面,应当尽可能利用既有的法律资源依法而为,并积极寻求新的立法或者补充规定得到支撑;另一方面,行政主管机关应当通过制度设计的创新,支持医疗机构及其人员能够在技术发展中乘势而上。
目前,医疗器械按《条例》要求分为三类,其中要求最高的医疗器械是植入人体的,简称“植入物”,归入第三类医疗器械,它用于支持、维持生命,属对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。这种按照在使用安全性、可靠性作为分类的标准思路是正确的,但是限于当时的科技发展水平,分类规则不可能涉及采用3D打印技术制造医疗器械。其第四条规定:“确定医疗器械分类,应依据医疗器械的结构特征、医疗器械使用形式和医疗器械使用状况三方面的情况进行综合判定。”从逻辑上分析,《条例》对医疗器械分类的依据只有结构特征、使用形式、使用状况三个方面,并没有把生产方式作为分类标准之一。既然法律没有对医疗器械的生产方式作出规定,那么运用3D打印技术制造医疗器械就不在禁止之列。根据“法无禁止皆自由”原则,《条例》并没有明文禁止以个体化方式生产医疗器械,这就在客观上给3D打印技术留下了生存的空间。既然医疗器械监督管理的整个体系中没有以医疗器械的生产方式不同作为分类的标准之一,而在其他分类标准中隐含的只是批量生产这一种生产方式,因而可以视为只要在遵守《条例》其他规定的前提下,就可以采用3D打印技术生产医疗器械。
特别令人兴奋的是,国务院在2015年8月9日颁布了《关于改革药品医疗器械审评审批制度的意见》(以下简作《意见》),明确提出:“改革医疗器械审批方式。鼓励医疗器械研发创新,将拥有产品核心技术发明专利、具有重大临床价值的创新医疗器械注册申请,列入特殊审评审批范围,予以优先办理。及时修订医疗器械标准,提高医疗器械国际标准的采标率,提升国产医疗器械产品质量。通过调整产品分类,将部分成熟的、安全可控的医疗器械注册审批职责由食品药品监管总局下放至省级食品药品监管部门。”如果说《意见》的亮点之一是放权的话,那么全面公开药品医疗器械注册的受理、技术审评、产品检验和现场检查条件与相关技术要求,公开受理和审批的相关信息等提高审评审批透明度的改革,则一定能够引导申请人有序研发和申请。我们并不是主张取消严格监管,而是期盼监管立足于造福人民,以公开透明的方式促进创新、规范竞争。从3D打印技术的临床应用看我国已经落后,原因之一是法治保障的不足。在我国,一是必须坚持发挥党在科技创新管理法治化建设中的领导核心作用,使党的科技创新思想和主张通过法定程序成为国家意志;二是必须发挥政府在科技创新管理法治化中的主导作用,通过政府依法行政的示范带动,进一步强化全社会在科技创新方面的法治意识;三是研究出台科技创新管理法治化实施纲要,面向未来,细化规则,加强我国科技创新管理法治化的整体部署和规范运行。
上海市人民代表大会常务委员会《关于促进改革创新的决定》(以下简作《决定》)已经自2013年6月20日起实施。该《决定》明文规定:“本市应当充分运用现行法律制度及国家政策资源,推进改革创新。本市各级人民政府及其部门应当主动作为,积极履行法律、法规赋予的职责,努力提高行政效能,推进改革创新;对于改革创新中法律、法规和国家政策未规定的事项,可以在职权范围内作出规定。法律、法规、规章及国家政策未规定的事项,鼓励公民、法人和其他组织积极开展改革创新。”据此,上海可以做的,一是用足现有法律资源,二是在制度创新中实施谨慎突破。为此,我们建议,市食品药品监督管理局应当采用“在职权范围内作出规定”的办法,支持和保护3D打印技术在医疗领域应用的探索。
2.3D打印技术的临床应用可从现有可植入材料起步。
截至目前,3D打印技术生产的外科植入体所起到的作用仍是修复、整形、修补、充填,而不具有原有器官的功能替代作用。就骨科植入物而言,大致可分为两类:一类为金属植入物,主要有钛合金及钴铬钼合金等,涵盖关节、脊柱及创伤的各个领域;另一类为骨生物替代材料,也就是组织工程支架。而目前3D打印技术制造的以上人体植入物有望在现有材料的基础上,量化地控制植入物的几何轮廓及拓扑结构,制造更符合个体特定需求的植入物。通俗地说,3D打印技术临床应用的捷径是选择现有可植入人体的材料,以“打印”的方式予以成型。3D打印技术目前只是初露头角,其临床应用应当尽可能利用现有的材料,以避免舍近求远。从这个意义上说,运用3D打印技术生产个体化的“人工关节”“脊柱固定物”“接骨板”“骨修复材料”等,都应当从现有的可植入人体材料起步。
根据《医疗器械注册产品标准编写规范》(国药监械[2002]407号)的规定,申报医疗器械产品必须写明“与人体接触的材料是否已在临床上应用过,其安全性、可靠性是否得到证明”,那么,其产品的所使用的原材料(粉末、黏合剂等)按照相适应的国家标准、行业标准进行过生物学试验,并且此产品在生产加工中没有使材料改变(未添加其他物质),就是一条捷径。采用现成的可以植入人体的材料作为3D打印的材料,可以大大降低技术创新的难度,以避免选用材料不合格遭致淘汰。当然,随着3D打印技术的进一步成熟,也必然会对粉末、黏合剂材料的选择提出新的要求,届时再组织攻关,其成功的可能性较大。
3.用3D打印技术打印的医疗器械不可能进行临床试验。
个体差异表现在个体解剖结构及运动学特征的方方面面,因而,对植入物的结构形态要求也存在差别。加之患者所受的创伤各不相同,精细化的医疗必然要求个体化的植入器材生产。3D打印技术可满足植入物个体化生产的需求,其优势在于与个体需求的高度吻合的个体化生产,但同时存在不可能进行目前批量生产产品常规开展的临床试验的窘境。按照现有审批制度必然没有临床试用的数据。以戴尅戎院士所遇到的“麻花腿”患者为例,其因病而形成的“麻花腿”是独一无二的,即便在他人身上取得的实验数据都不可能与“麻花腿”相匹配。由于3D打印的植入器材是面对具有差异性患者“按需生产”,临床试用不可能存在,传统的规格、型号概念已经不再适用。
4.监管3D打印之医疗器械的重点应当有所调整。
按照传统要求,新型医疗器械在投入市场前,应进行临床试用,临床试用评价是政府主管部门作为决定该医疗器械能否进入市场的重要客观依据之一。临床试用的目的在于评价该医疗器械在正常使用条件下,是否符合预期安全性设想和能够达到预期的医疗效果。鉴于3D打印技术生产的医疗器械不可能进行临床试用的现实,就不应当墨守成规,用不可能做的临床试验苛求研制者。根据市场监管必须与科技发展与时俱进的要求,政府主管机构对3D打印技术生产的医疗器械的监管重点应当作相应调整,如:其一,选用的打印材料是否符合安全性、生物相容性标准;其二,打印成型产品的有效性(与预期的相应功能重建、替代、补偿的实现程度);其三,打印成型产品植入人体后的可靠性(有效性在多长时间内能够稳定地发生作用)。
三、破解3D打印技术个体化生产医疗器械难题的思路
据负责上海市《关于促进改革创新的决定》立法工作的原上海市人民政府秘书长介绍,该《决定》所要解决的是上海改革发展中的突出问题:一是通过宣示性以及激励措施规定,解决要不要改革创新的问题;二是通过明示改革创新的法治路径,解决改革创新遇到制度障碍怎么办的问题;三是通过有关专门条款,解决改革创新动力和改革创新不成功怎么办的问题。[7]该《决定》的特色在于法治路径的相关内容更加明确,法治保障力度更大。据此,运用3D打印技术制造植入性医疗器械这个难题也应当在《决定》中寻求解决的路径。为此,笔者提出具体建议如下。譹訛
(一)报请国家食药监局批准在上海建立3D打印技术临床应用试点
根据现行的医疗器械管理法规,医疗器械产品注册实行市级、省级、国家级三级管理;运用3D打印技术研制植入式医疗器械应当报国家食品药品监督管理局审批。《条例》第七条规定:“第二类、第三类医疗器械新产品的临床试用,应当按照国务院药品监督管理部门的规定,经批准后进行。”其第十八条还规定:“开展医疗器械临床试验,应当按照医疗器械临床试验质量管理规范的要求,在有资质的临床试验机构进行,并向临床试验提出者所在地省、自治区、直辖市人民政府食品药品监督管理部门备案。接受临床试验备案的食品药品监督管理部门应当将备案情况通报临床试验机构所在地的同级食品药品监督管理部门和卫生计生主管部门。”上海市《关于促进改革创新的决定》规定:“本市各级人民政府及其部门应当为企事业单位、社会组织提供优质公共服务,尊重其自主权,不得干预其实施改革创新工作。对企事业单位、社会组织开展改革创新遇到的问题,应当及时研究,主动予以解决。超出本部门职权范围的,应当及时提请上级部门协调解决。”据此,应当在上海选择有资质且实力强、管理好的医院作为3D打印技术临床试用的试点单位。由于《条例》并没有区分批量化生产与个体化生产,所以,提请批准的是该医院具有运用3D打印技术个体化生产医疗器械(如骨科植入物)的资质,而不是具体的“植入某一位患者的那一个”产品。
根据上海的实际情况,可以报请国家食品药品监督管理总局批准将上海交通大学医学院附属第九人民医院或其他医院,作为3D打印技术临床应用试点单位先行先试,待取得成熟经验后再扩大试行的范围。
(二)签署《合作共识备忘录》以共同防范风险
鉴于植入性医疗器械的安全性、可靠性与人的生命权、健康权直接相关,研究者在创新探索的过程中必须持高度谨慎的态度,主管机关也应当谨慎平衡各方面的利益关系,尽最大可能减少创新的风险。我们在强调“没有规矩不成方圆”的同时,也要看到法律也总会有一定的滞后性。在“游戏与规则”的相互关系中,如果没有游戏,也就不需要制定规则;缺少规则的游戏也必然难以持续;在游戏的初期,规则难免粗疏;游戏规则只能在游戏进行的过程中不断完善。《条例》第十七条规定:“第一类医疗器械产品备案,不需要进行临床试验。申请第二类、第三类医疗器械产品注册,应当进行临床试验。但是,有下列情形之一的,可以免于进行临床试验:(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;(二)通过非临床评价能够证明该医疗器械安全、有效的;(三)通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的。免于进行临床试验的医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。”据此,可以采取的办法有两个:一是等待国务院食品药品监督管理部门制定的“免于进行临床试验的医疗器械目录”中包含3D打印技术制造的植入性医疗器械;二是在期待国务院食品药品监督管理部门将3D打印技术纳入“免于进行临床试验的医疗器械目录”的同时,根据“有法律,从法律;有规则,从规则;无规则,从共识(约定)”的原则,采用食品药品监督局(行政主管机关)、研制方(医院)、患者签订三方《合作共识备忘录》的方式,共同防范3D打印技术制造的植入性医疗器械可能出现的风险。笔者倾向于第二种办法。
《合作共识备忘录》本质上是三方共同签署的合作协议,是在不得不“省略”临床试用环节的状态下,以备忘录的形式表达患者自愿接受3D打印技术“度身定制”的医疗器械。与传统的《知情同意书》不同,“医”(院)“患”(者)“管”(理者)三方是合作关系,是基于维护生命权、健康权结成的“利益共同体”。所谓合作,即“医”“患”“管”三方不仅有“战胜病魔、早日康复”的共同微观目标,而且有“科技创新、造福人类”的共同宏观目标。作为研制者的医院,要承担竭尽全力降低植入器材可能带来风险的责任,并主动采取预防风险发生的措施;作为患者,在实现自身疾病治疗目标的同时,自愿承担可能出现的低概率风险;作为管理者在提醒医患双方共同防范风险的同时,要承担可预见范围内的监管责任。所谓共识,是指“医”“患”“管”三方已经就3D打印技术生产的医疗器械可能出现的风险具有一致的共识,对可能出现的意外视为科学技术发展过程中的正常失败概率。一旦意外出现,患者在放弃“产品责任”投诉权的同时,也将因为其为科技发展做出的牺牲得到一定的补偿。上海市《关于促进改革创新的决定》已经明文规定:“改革创新未能实现预期目标,但有关单位和个人依照国家和本市有关规定决策、实施,且勤勉尽责、未牟取私利的,不作负面评价,依法免除相关责任。”《合作共识备忘录》具体体现了“宽容失败”的理念,又兼顾了患者的利益,应当予以试行。
(三)开发特殊意外保险,推进科学技术创新
在人们力图与自然建立和谐关系的过程中,由于主观认识能力不足或客观上受到限制等原因,出现失败或意外的损害是难免的。笔者之一汤啸天曾在上个世纪就提出,医疗技术的发展客观上存在正常失败的概率,而正常的失败概率并不是医生在主观上更加努力一点就完全能避免的。但哪怕这概率是万分之一,一旦发生在某一患者身上,其就要百分之百地承受这不幸的结果。医生如果惧怕“万一”,可以采用保险系数更大的保守疗法,这从职业道德上来说也是允许的。特别是医疗技术发展的高风险往往与医疗纠纷交织在一起,中国医患关系高度紧张的当下,医生很可能因惧怕发生意外而不敢实践已经成熟或正在成熟过程中的医疗技术。于是,越是锐意进取、勇于探索的人越容易犯错误,甚至因为“敢为天下先”而付出沉重的代价。而从社会整体利益的角度看,探索精神难能可贵,探索中的失败在所难免,理应为科学的探索者构建一面“挡风的墙”,即特殊意外保险。以3D打印技术的临床应用为例,如果患者及其亲属同意施行,医院又为病人购买了特殊意外保险,那么一旦手术失败,只要查明并非责任或技术事故,则由保险公司负责理赔。这样做的益处至少有三:一是医院以替接受手术者买保险的形式承担了相关责任,避免了风险由术者或患者单独承担的不公平局面;二是医院以自己精湛的医术和良好的服务为信誉求得保险公司承保,出险率低是医院买到保险的前提,风险分散是医院得到的收益;三是患者接受手术既是延长自身生命或提高生命质量的需要,也在客观上为医护人员的科学探索提供了实践条件。一旦出险,患者可得到一定补偿,这不失为在经济上、心理上求得平衡的可行之策。[8]
总之,3D打印技术在医疗领域的应用,必须按照促进改革创新的理念,组织法学、临床医学以及相关学科的力量共同研究、协力推进。当前,个体化生产既是3D打印技术的优势,同时也是政策法律限制其应用的瓶颈所在。建议国家食品药品监管局批准建立3D打印技术临床应用试点,通过签署《合作共识备忘录》,开发特殊意外保险等方式共同防范风险。
(本研究在中国工程院院士,现任上海交通大学医学院附属第九人民医院上海市关节外科临床医学中心主任戴尅戎教授的指导下完成,谨致深切的谢意!)
注释
譹訛此三项建议系汤啸天在2013年8月16日上海市法学会卫生法学研究会召开的“3D打印技术医疗应用的法律问题”研讨座谈会上提出,此后在戴尅戎、王燎在有关著作以及接待国家食品药品监督管理总局来沪调研时也有谈及。
[1]骨与关节十年官网.美国健康统计中心2012年统计[EB/OL].(2013-01-20)http://www.boneandjointburden.org/factsbrief.
[2]王燎,戴尅戎.骨科个体化治疗与3D打印技术[J].医用生物力学,2014,29(3):193-9.
[3]Dai KR,Yan MN,Zhu ZA,etal.Computer-aided custom-made hemipelvic prosthesis used in extensive pelvic lesions [J].JArthroplasty.2007,22(7):981-986.
[4]Hartofilakidis G,Yiannakopoulos CK,Babis GC.The morphologic variations of low and high hip dislocation[M].Clin Orthop Relat Res.2008;466(4):820-4.Sanchez-Sotelo J,Berry DJ,Trousdale RT,Cabanela ME.Surgical treatment of developmental dysplasia of the hip in adults:II.Arthroplasty options[M].JAm Acad Orthop Surg.2002;10(5):334-44.Li H, Wang L,Dai etal.Autogenous Impaction Grafting in Total hip Arthroplasty with Developmental Dysplasia of the Hip[J]. Arthroplasty.2013;28(4):637-43.Li H,Wang L,Mao Y,etal. Revision of Complex Acetabular Defects Using Cages with the Aid ofRapid Prototyping[J].JArthroplasty.2013;29(10):1770-5.
[5]Flecher X,Pearce O,Parratte S,etal.Custom Cementless Stem Improves Hip Function in Young Patients at 15-year Followup[J].Clin Orthop Relat Res.2010,468(3):747-55.Osagie L,FiggieM,Bostrom M.Custom TotalHip Arthroplasty in Skeletal Dysplasia[J].I ntOrthop.2012,36(3):527-31.
[6]贺天宝.3D打印“人体”是福还是祸[N].新闻晚报,2013-03-31:A1.11.
[7]蒋卓庆.关于起草《关于促进改革创新的决定(草案)》的说明[EB/OL].(2015-07-09)http://gov.eastday.com/shrdgzw/ node5/node48/n204/userobject1ai51673.htm l
[8]汤啸天.医疗风险与相关责任保险[J].中国卫生,1999 (10):10-12.
(责任编辑:罗刚)
Research and Development Status and the Bottleneck Breakthrough Ideas of 3D Printing Technology and Orthopaedic Im p lants
Tang Xiaotian Wang Liao
Implants are the core elements of skeletalmuscle treatment system with enormous social and eco-nomic effects.The localized and individualized demand for orthopaedic implants forced its research and develop-mentwork.In the research field of orthopedic implants,the way for clinical application of 3D printing technology has been paved,and the research and development of orthopaedic implants based on 3D printing technology need legal guarantee.Individualized production is the advantage of 3D printing and the bottleneck of legal restrictions aswell,so reform and innovation are needed to break through its application bottleneck.And the following are the solutions to the problems in individualized production ofmedical equipments by 3D printing technology:1.Submit to the National Food and Drug Administration for approval of setting up 3D printing pilot clinical application in Shanghai;2.Suggest signing Consensus Memorandum of Cooperation to prevent common risks;3.Suggest devel-oping special accident insurance to promote science and technology innovation.
3D printing technology;orthopaedic implant;science and technology innovation;legal guaran-tee;bottleneck breakthrough
汤啸天,上海政法学院编审,主要研究方向为卫生法学。王燎,上海交通大学医学院附属第九人民医院骨科主治医师,主要研究方向为骨科数字化技术及个体化治疗。
