无血清培养基的优化对rhEPO-Fc融合蛋白体外活性的影响
2015-12-09王燕江莹厉颖周永春
王燕 江莹 厉颖 周永春
(上海凯茂生物医药有限公司 上海 201506)
无血清培养基的优化对rhEPO-Fc融合蛋白体外活性的影响
王燕*江莹厉颖周永春
(上海凯茂生物医药有限公司上海201506)
目的:研究基础培养基I/F/D中添加不同浓度的培养基组分对rhEPO-Fc融合蛋白体外活性的影响。方法:通过单因素实验结合Box-Behnken 效应面法,筛选适合rhEPO-Fc表达的较优培养基组分。结果:在基础培养基中添加1% F68、10%维生素、7.7 g/L腐胺、10.1 g/L乙醇胺和5.38 g/L胰岛素时,rhEPO-Fc融合蛋白的体外活性可达10 268 IU/ml,比初始的基础培养基I/F/D提高了108.4%。结论:优化后的培养基能提高rhEPO-Fc融合蛋白体外活性,降低生产成本,可为后期的中试生产提供重要参考。
无血清培养基腐胺乙醇胺胰岛素
促红细胞生成素(erythropoietin,EPO)是一种主要由肾脏分泌的调节红细胞生成的酸性糖蛋白激素[1]。它的主要作用在于与红系祖细胞的表面受体结合,促进红系祖细胞增生与分化,促进红母细胞成熟,增多红细胞数和血红蛋白含量,稳定红细胞膜,提高红细胞膜抗氧化功能。临床上主要用于心血管、脑神经、肾脏和视网膜神经保护及各种类型的贫血[2-3]。1985年EPO基因克隆和表达成功,使rhEPO大规模生产成为可能,但它在人体内血清循环半衰期仅为4~8 h,临床用药过程中需要频繁给药,不仅给患者带来痛苦,且易产生耐受性及各种不良反应。IgG型的免疫球蛋白是人类血液中最丰富的蛋白质,它们的半衰期可长达21 d,目前已有报道将人IgG的Fc区域与其它蛋白质融合可显著延长目的蛋白的半衰期,提高体内生物活性[4]。
为此,我公司将rhEPO和人IgG的Fc区域进行融合表达,使rhEPO-Fc融合蛋白保留了rhEPO生物活性又延长了半衰期,更适合于临床应用。在研发的过程中,最初使用普通的基础无血清培养基和商业化培养基CD CHO AGTTM(Gibco公司,CNY 900/L)分别来生产rhEPO-Fc融合蛋白,其体外活性分别为4 926 IU/ml和8 326 IU/ml。虽然商业化培养基培养时rhEPO-Fc融合蛋白的体外活性较高,但该培养基价格昂贵,在产业化生产时,会给整个生产成本带来极大的压力。本研究主要以IMDM、DMEM/F12(Gibco公司,CNY 100/L)培养基为基础,通过对F68、维生素、腐胺、乙醇胺、胰岛素等培养基组分的优化,提高CHO细胞表达的rhEPOFc的体外活性,以便降低生产成本,为实现rhEPO-Fc的大规模生产奠定基础。
1 材料与方法
1.1材料
1)细胞株表达rhEPO-Fc融合蛋白的CHO细胞株为本公司构建。该细胞株是在原始细胞CHO-DG44的基础上通过克隆、转染、氨甲喋呤加压筛选获得,并驯化成悬浮细胞。
2)I/F/D培养基在IMDM、DMEM/F12(1∶1)的基础上,通过添加必需氨基酸、非必需氨基酸、脂类、转铁蛋白等血清替代物而自主研发的无血清培养基,能够支持CHO细胞的正常生长。
1.2方法
1.2.1细胞培养扩增
从液氮罐中取出一管克隆细胞株,立即浸入37 ℃的水浴中,不断搅动,使之迅速融化。用75%酒精擦拭其外部,于超净工作台用无菌移液管将细胞悬液转移至装有30 ml I/F/D培养基(含300 μl双抗)的125 ml摇瓶中,置于Infors Minitron培养箱于37 ℃、5% CO2、120 r/min的条件下振荡培养3 d后细胞计数,以5.0×105的细胞密度接种至装有新鲜30 ml培养基的125 ml摇瓶,同上培养5 d,离心(4 ℃,200 g)10 min后取上清测定其rhEPO-Fc融合蛋白的体外活性。
1.2.2单因素细胞培养实验
在I/F/D基础培养基中分别添加不同浓度的F68、维生素、腐胺、乙醇胺或胰岛素,培养5 d后考察它们单独或组合对rhEPO-Fc的体外活性的影响。自维生素开始,分别在前一试验优化的基础上再添加所需试验的组分,以不添加所试验的组分为对照。
1.2.3响应面优化实验
根据此前单因素实验分析结果采用Box-Behnken实验设计对其进行响应面优化实验,以腐胺(X1)、乙醇胺(X2)、和胰岛素(X3)为自变量,rhEPO-Fc融合蛋白体外活性(Y)为响应值,设计3因素3水平共17个试验点的响应面分析实验,在中心值重复5次实验,以确定培养基中各营养物质的最适添加浓度(表1)。

表1 Box-Behnken实验设计因素与水平(g/L)
1.2.4rhEPO-Fc的体外活性测定
采用R&D公司人EPO ELISA试剂盒进行体外活性测定[5]。
2 结果
2.1F68对rhEPO-Fc体外活性的影响
F68作为一种非离子表面活性剂,加入培养基后,可以在细胞与气泡的接触面形成保护层,使细胞免受生物反应器和灌流培养中湍流引发的细胞剪切压力,从而对细胞起到保护作用[6~8]。当不添加F68时rhEPO-Fc的体外活性为4 926 IU/ml;当添加0.5%时它对细胞的保护作用增加,rhEPO-Fc的体外活性也随之升高到5 169 IU/ml;当添加1% F68时,rhEPO-Fc体外活性最高可达为5 427 IU/ml,比不添加F68的对照提高了10.2%;而后当F68浓度继续增加到2%时又会对细胞起到抑制作用,rhEPO-Fc的体外活性又随之降到5 017 IU/ml。因此在I/F/D基础培养基中添加最适的F68浓度为1%(图1)。
2.2维生素对rhEPO-Fc体外活性的影响
维生素是维持细胞生长的重要活性物质,通常作为辅酶或者辅基参与代谢的调控,提供核酸合成的重要底物以及促进营养物质代谢产生能量,参与DNA合成与修复,保持基因组的稳定性[9-10]。当添加1% F68而不添加维生素时,rhEPO-Fc的体外活性为5 406 IU/ml(对照);当添加5%维生素时,rhEPO-Fc的体外活性为5 698 IU/ml;当添加的维生素浓度达到10%时,rhEPO-Fc体外活性最高可达6 273 IU/ml,比对照提高了15.6%;而后当维生素浓度继续增加到20%时,rhEPO-Fc的体外活性为5 996 IU/ml,变化不明显。因此在I/F/D基础培养基中添加维生素的最适浓度为10%(图1)。

图1 添加不同组分对rhEPO-Fc体外活性的影响
2.3腐胺对rhEPO-Fc体外活性的影响
腐胺是一种聚胺类物质,它对细胞生长和分化极其重要,如DNA复制,转录及翻译等。其对细胞生长调控的影响可以通过细胞生长循环机制和细胞凋亡来显现出来[10-12]。当添加1% F68和10%维生素而不添加腐胺时rhEPO-Fc的体外活性为6 253 IU/ml(对照);在此基础上添加5 g/L腐胺,rhEPO-Fc的体外活性为6 815 IU/ml;当添加的腐胺浓度增加到7.5 g/L时,rhEPO-Fc体外活性最高可达7 102 IU/ml,比对照提高了13.2%;当腐胺浓度继续增加到10 g/L时,rhEPO-Fc的产量迅速下降到6 056 IU/ml。因此,添加7.5 g/L腐胺较适宜(图1)。
2.4乙醇胺对rhEPO-Fc体外活性的影响
乙醇胺是磷脂酰乙醇胺的前体分子,而磷脂酰乙醇胺在细胞增殖分列中起到重要作用,因此在培养基中添加乙醇胺能够促进细胞的合成与增值[10,13]。在上述三培养基组分提高体外活性(7 115 IU/ml,对照)的基础上,添加5 g/L乙醇胺时,rhEPO-Fc体外活性可进一步提高到7 639 IU/ml;当乙醇胺浓度增加到10 g/L时,rhEPO-Fc体外活性最高可达8 403 IU/ml,比对照提高了18.3%;而当乙醇胺浓度继续增加到20 g/L时,rhEPOFc的体外活性又显著下降到6 892 IU/ml。因此,添加10 g/L乙醇胺较为适宜(图1)。
2.5胰岛素对rhEPO-Fc体外活性的影响
胰岛素促进细胞分裂增殖,调控糖脂代谢与生物大分子合成,其中包括葡萄糖摄取,糖原合成及氨基酸转运等[14-16]。2.4项中的添加试验可使rhEPO-Fc的体外活性达到8 389 IU/ml(对照);当添加2.5 g/L胰岛素时,rhEPO-Fc的体外活性可进一步提高到9 217 IU/ml;当添加的胰岛素浓度达到5 g/L时,rhEPO-Fc体外活性最高可达10 286 IU/ml,比对照提高了22.4%;而后当胰岛素浓度继续增加到10 g/L,rhEPO-Fc的体外活性又明显下降到7 834 IU/ml。因此,添加5 g/L的胰岛素较适宜(图1)。
2.6响应面优化培养基配比
以上实验研究了单独或组合添加各培养基组分对rhEPO-Fc的体外活性的影响,但细胞培养过程中影响rhEPO-Fc的体外活性的因素很多,各组分最适浓度的组合并不一定能获得最佳结果,因此本实验借助Design expert 8.0.5软件对无血清培养基中的腐胺、乙醇胺和胰岛素的最适浓度进行考察,以寻求rhEPO-Fc的体外活性达到最大时的最佳无血清培养基配比。
2.6.1实验结果
采用Box-Behnken实验设计对腐胺、乙醇胺和胰岛素进行响应面实验,设计3因素3水平共17个试验点的响应面分析实验,在中心值重复5次实验,实验重复两次分别取平均值(表2)。
2.6.2多元二次回归方程的建立及显著性检验
利用软件Design expert 8.0.5对Box-Behnken实验结果进行二次多项回归拟合,获得rhEPO-Fc体外活性(Y)对以腐胺(X1)、乙醇胺(X2)、和胰岛素(X3)的多元二次回归方程:
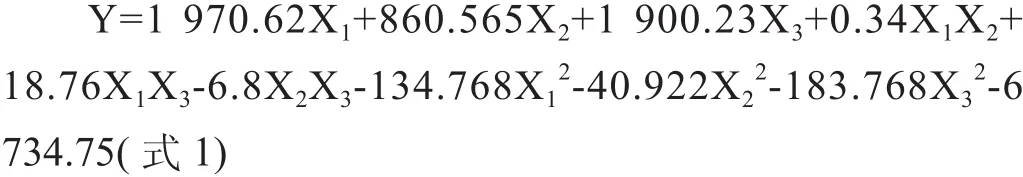
通过表3回归模型方差分析表可知模型复相关系数R2=0.998 0,说明预测值和实测值之间的相关性很好;Adj R2=0.995 3,说明只有0.47%的变异不能由该模型解释,因此认为可用来代替真实实验点对实验结果进行分析和预测,并且整体模型达到极显著水平(P<0.000 1),表明该二次方程模型显著。

表2 Box-Benhnken设计及试验结果

表3 方差分析表
2.6.3响应面分析及最优培养基条件的确定
借助软件Design Expert 8.0.5依据回归方程来绘制响应曲面图,考察所拟合的响应曲面的形状(图2)。

图2 腐胺、乙醇胺和胰岛素对rhEPO-Fc体外活性影响的响应面立体图
从响应面的最高点和等高线可以看出,在所选范围内存在极值。为求得最佳添加浓度,将所得的多元二次回归方程(式1)分别对各自变量求一阶偏导数,并令其为0,得到三元一次方程组,求解此方程组可以得出模型的极值点X1=7.7,X2=10.1,X3=5.38,即当腐胺、乙醇胺和胰岛素的浓度分别为7.7、10.1和5.38 g/L时,理论rhEPO-Fc体外活性达到最大,为10 300 IU/ml。
2.6.4模型验证
为了验证模型的准确性,在I/F/D基础培养基中添加1% F68、10%维生素、7.7 g/L腐胺、10.1 g/L乙醇胺和5.38 g/L胰岛素进行近似最佳实验条件的验证实验,通过三次平行实验rhEPO-Fc的实际平均体外活性为10 268 IU/ml,比最初使用普通的基础无血清培养基的体外活性提高了108.4%,结果表明响应面分析法得到的实验参数真实可靠,具有实用价值。
3 讨论
CHO细胞培养是一种获得高水平表达重组蛋白的方法,培养基是细胞赖以体外生长、增殖、分化的重要因素[17],可提供细胞生长繁殖所必需的全部营养物质[18],合适的培养基能够增加细胞繁殖速度,提高细胞密度。据报道,CHO细胞表达的融合蛋白在生物体内的生物学活性、免疫原性、体内代谢周期以及拮抗蛋白酶的水解等方面与其培养基成分密切相关[17],合适的培养基有利于融合蛋白的表达,提高其体外活性。无血清培养基因其组成清楚、批次间重复性好、制备过程简单、便于下游分离纯化及节省成本等优点,已在动物细胞规模化培养中得到成功应用[19]。因此对于经动物细胞培养生产重组蛋白的生产工艺而言,筛选优化一种无血清培养基尤为重要。
刘国庆等[20]报道在培养基中添加B族维生素能够有效促进CHO细胞的生长并延长培养时间。我们在实验中添加了10%的Gibco公司维生素溶液,体外活性提高了15.6%。维生素溶液含有各种类型的维生素,具有互补作用,比单一种类的维生素能较好地促进细胞的生长,增加rhEPO-Fc体外活性。在此基础上我们后续可以详细地研究各种类型的维生素对细胞生长的影响,以进一步提高rhEPO-Fc的体外活性。俞锦锋等[16]研究通过添加胰岛素和亚硒酸钠的混合物来提高重组蛋白的产量。我们通过实验发现添加两者的混合物的确对体外活性的提高有一定的作用,但亚硒酸钠不利于后续的纯化工艺,研究其替代物将是一个难点。通过响应面优化实验得到合适的培养基配比,在进行模型验证时发现实际值与理论值存在一定的误差,这可能是由于实验是分三批进行的,存在批次差异,后续实验中为避免这些误差可尽量将同一对照实验安排在同一批次进行,以减少实验误差。
近年来,国外的几个研究者[21-23]分别报道了CHO细胞培养过程中葡萄糖和谷氨酰胺的消耗量、不同非动物来源水解产物以及锌、铜对细胞生长和重组蛋白产量的影响,因此未来可进行添加这些物质的试验以及细胞培养条件如pH[24]、温度[25]等试验,进一步优化生产工艺参数,为放大生产奠定基础。
[1]刘国霞, 曾宪垠, 包伦, 等. 长效促红细胞生成素的放射性标记[J]. 核农学报, 2004, 18(1): 55-58.
[2]张颖轩. 促红细胞生成素的心血管保护作用[J]. 医学理论与实践, 2013, 26(19): 2550-2551.
[3]李淑敏. 促红细胞生成素的临床应用进展[J]. 职业与健康, 2013, 29(21): 2862-2864.
[4]祝强,黄智华,黄予良, 等. rhEPO-L-Fc融合蛋白的表达、生物活性和初步药动学分析[J]. 生物工程学报, 2008, 24(11): 1874-1879.
[5]杨建军, 张昕泂, 周洁, 等. rhEPO-Fc融合蛋白的表达、纯化及质量研究[J]. 中国生物工程杂志, 2007, 27(6): 6-9.
[6]Gigout A, Buschmann MD, Jolicoeur M. The fate of pluronic F68 in chondrocytes and CHO cells[J]. Biotechnol Bioeng, 2008, 100(5): 975-987.
[7]张慧峰. 表达TNFR-Fc的CHO-GS细胞无血清培养基优化及流加工艺设计[D]. 哈尔滨: 东北农业大学, 2012.
[8]刘兴茂. CHO工程细胞无血清流加培养代谢动力学及转录谱特征研究[D]. 北京: 军事医学科学院生物工程研究所, 2009.
[9]Yang ZQ, Xiong HR. Culture conditions and types of growth media for mammalian cells[EB/OL]. [2015-08-06]. http://cdn. intechopen.com/pdfs-wm/40247.pdf.
[10]刘美. GS-CHO细胞培养工艺优化[D]. 哈尔滨: 东北农业大学, 2012.
[11]Conen P. Development of cost effective media formulation for rCHO cell lines by eliminating or reducing serum[D]. Parkville: University of Applied Science, 2006.
[12]Kim do Y, Lee JC, Chang HN, et al. Effects of supplementation of various medium components on Chinese hamster ovary cell cultures producing recombinant antibody[J]. Cytotechnology, 2005, 47: 37-49.
[13]Ajioka I, Akaike T, Watanabe Y. Ethanolamine is a comitogenic factor for proliferation of primary hepatocytes[J]. J Cell Biochem, 2002, 84: 249-263.
[14]Liu CH, Chang TY. Rational development of serum-free medium for Chinese hamster ovary cells[J]. Process Biochem, 2006, 41(11): 2314-2319.
[15]Burgener A, Butler M. Medium Development[M]//Ozturk SS, Hu WS. Cell Culture Technology for Pharmaceutical and Cell-Based Therapies. New York : CRC Press, Taylor & Francis Group, 2006: 41-79.
[16]俞锦锋. 基于Tubespin生物反应器的CHO细胞无血清培养基的高通量筛选与优化[D]. 江西: 南昌大学, 2011.
[17]邹寿长, 李干祥, 杨葆生, 等. 大规模动物细胞培养技术研究进展[J]. 生命科学研究, 2001, 5(2): 102-108.
[18]何敬琦, 张思雅, 李明, 等. 效应面法优化CHO细胞培养基中几种主要成分的含量[J]. 现代生物医学进展, 2014, 9(14): 1627-1632.
[19]王晓南, 王丽环, 高鹏. 动物细胞无血清培养基的优势、特点与实验研究[J]. 亚太传统医药, 2009, 5(2): 21-23.
[20]刘国庆, 陈飞, 赵亮,等. 表达单克隆抗体的CHO细胞无蛋白培养基的优化[J]. 高校化学工程学报, 2013, 27(1): 96-101.
[21]Hu SW, Deng L, Wang HM, et al. Bioprocess development for the production of mouse-human chimeric anti-epidermal growth factor receptor vIII antibody C12 by suspension culture of recombinant Chinese hamster ovary cells[J]. Cytotechnology, 2011, 63(3): 247-258.
[22]Kochanowski N, Siriez G, Roosens S, et al. Medium and feed optimization for fed-batch production of a monoclonal antibody in CHO cells [J/OL]. BMC Proc, 2011, 5(Suppl 8): 75. doi: 10.1186/1753-6561-5-S8-P75.
[23]Hernandez JC, Piera CM. Serum-free cell culture medium for mammalian cells: US, 0064644 [P] . 2008-03-13.
[24]Hagrot E. Development of a culture system for modeling of pH effects in CHO cells[D]. Stockholm: KTH School of Biotechnology, 2011.
[25]Clark KJ, Chaplin FW, Harcum SW. Temperature effects on product-quality-related enzymes in batch CHO cell cultures producing recombinant TPA[J]. Biotechnol Prog, 2004, 20(6), 1888-1892.
Effect of the optimization of serum-free medium on the in vitro activity of rhEPO-Fc fusion protein
WANG Yan*, JIANG Ying, LI Ying, ZHOU Yongchun
(Shanghai Chemo Wanbang Biopharma, Shanghai 201506, China)
Objective: To study the effects of the adding different concentrations of various components in the basal culture medium I/F/D on the in vitro activity of rhEPO-Fc. Methods: The optimal components suitable for the expression of rhEPO-Fc were screened by the single factor experimental results combined with Box-Behnken response surface method. Results: When 1% F68,10% vitamin, 7.7 g/L putrescine, 10.1 g/L ethanolamine and 5.38 g/L insulin were added in the basal culture medium, the in vitro activity of rhEPO-Fc was increased by 108.4% up to 10 268 IU/ml compared with the results in the initial basal serum free medium. Conclusion: The in vitro activity of rhEPO-Fc can be increased when cells were incubated in the optimized culture medium, the costs for the production of rhEPO-Fc can be obviously reduced. The results of this study can provide a significant reference for pilot production of rhEPO-Fc.
serum-free medium; putrescine; ethanolamine; insulin
Q813.11
A
1006-1533(2015)23-0074-06
王燕(1986-),女,工学硕士,主要从事质粒构建,克隆及细胞培养等方面的研究。E-mail: yanking86@126.com
2015-08-06)
