多黏菌素类抗生素在多耐药革兰阴性菌感染治疗中的临床应用
2015-12-09孟现民董平张永信
孟现民 董平 张永信
(1. 上海市公共卫生临床中心药剂科 上海 201508;2. 复旦大学附属华山医院感染科 上海 200040)
多黏菌素类抗生素在多耐药革兰阴性菌感染治疗中的临床应用
孟现民1*董平1张永信2**
(1. 上海市公共卫生临床中心药剂科上海201508;2. 复旦大学附属华山医院感染科上海200040)
国内、外近年来的细菌耐药性监测结果显示,耐药菌中以肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌为代表的革兰阴性菌株占很大比例且耐药程度严重,由这些耐药菌所致感染的治疗已成为临床难题。多黏菌素类抗生素对耐药革兰阴性菌有良好的抗菌活性,近年来国内、外的处方量明显上升。但因有关多黏菌素类抗生素的药代动力学和药效学系统评价以及临床应用经验的缺乏,其临床应用尚欠规范。本文介绍国内、外耐药革兰阴性菌的流行现状以及多黏菌素类抗生素单用或再联合其他抗菌药物治疗此类感染的研究结果,以期能为更好地发挥多黏菌素类抗生素的临床效用提供一些参考。
多黏菌素类抗生素多耐药革兰阴性菌治疗
抗菌药物的广泛应用在给人们带来良好抗菌疗效的同时,细菌耐药问题也日益突出,特别是多耐药和泛耐药菌株的出现给临床治疗感染疾病和药物研发均提出了严峻挑战。而在由耐药菌株引起的感染中,由革兰阴性菌,尤其是肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌引起的感染正逐渐增多[1],患者的病死率高,严重威胁着人们的健康,成为亟需解决的重要临床问题。鉴于缺乏其他有效的抗菌药物且新的抗菌药物开发上市速度明显放缓,多黏菌素类抗生素已成为目前治疗耐碳青霉烯类抗生素的铜绿假单胞菌、不动杆菌和产碳青霉烯酶的肺炎克雷伯菌所致严重感染的不多的有效选择之一。尤其是近年来,随着产OXA-23型碳青霉烯水解酶的不动杆菌、产碳青霉烯酶和(或)产金属β-内酰胺酶的肠杆菌科菌株分离率的提高,多黏菌素类抗生素的经验用药逐渐增加[2-4]。但因缺乏系统的疗效和安全性评价资料,多黏菌素类抗生素的临床应用目前仍存在很多不规范之处。为更好地发挥多黏菌素类抗生素的临床效用,本文介绍国内、外革兰阴性菌的耐药现状以及多黏菌素类抗生素单用或再联合其他抗菌药物治疗这些耐药菌感染的研究结果,以供临床相关医师参考。
1 肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌的耐药现状
近年来,在引起院内感染的病原菌中,革兰阴性菌所占比例一直非常高、约占70%左右,且耐药程度严重。尤其是由耐药肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌等革兰阴性菌引起的院内感染往往严重且难以治疗,加之又常在重症监护病房、血液科病房等暴发流行,危险性极高,临床上应予于足够的重视。
2013年中国细菌耐药性监测网的监测结果显示,在收集到的84 572株细菌分离株中,革兰阴性菌株有61 709株,占73.0%。其中,克雷伯菌属、包括肺炎克雷伯菌和产酸克雷伯菌株共12 121株,占14.3%,仅次于大肠埃希菌株(16 794株,占19.9%)而排名第2。不发酵糖的革兰阴性杆菌株占总分离株的26.7%,其中排名前2位的依次是不动杆菌属和铜绿假单胞菌株(分别为10 120株、占12.0%和8 257株、占9.8%)。耐药性方面,克雷伯菌属的产广谱β-内酰胺酶(extendedspectrum β-lactamases, ESBLs)菌株检出率为31.8%,其对青霉素类、头孢菌素类、氨基糖苷类抗生素、喹诺酮类抗菌药物和甲氧苄啶-磺胺甲噁唑的耐药率均显著高于非产ESBLs菌株,对阿米卡星、哌拉西林-他唑巴坦、头孢哌酮-舒巴坦、头孢西丁、亚胺培南、美洛培南和厄他培南的耐药率≤20%,对其他测试抗菌药物的耐药率均>20%。在10 120株不动杆菌属菌株中,鲍曼不动杆菌株占89.2%,其对亚胺培南和美罗培南的耐药率分别为62.8%和59.4%,对头孢哌酮-舒巴坦、米诺环素和左氧氟沙星的耐药率分别为36.4%、41.8%和43.4%,对其他测试抗菌药物的耐药率多>50.0%,但对硫酸多黏菌素B的敏感率>99.0%。铜绿假单胞菌株对亚胺培南和美罗培南的耐药率分别为27.1%和25.1%,对硫酸多黏菌素B和阿米卡星的耐药率分别为0.7%和11.0%,对青霉素类和头孢菌素类抗生素复方制剂以及环丙沙星和头孢吡肟的耐药率<20.0%。与前几年的监测数据类似,检测出的泛耐药菌株主要存在于鲍曼不动杆菌、肺炎克雷伯菌和铜绿假单胞菌株中,检出率分别为14.6%、2.3%和2.0%。这些泛耐药菌株除对硫酸多黏菌素B和替加环素敏感外,对其他测试抗菌药物全部耐药[1]。
Sader等[5]检测了2009-2012年美国和欧洲及地中海地区(Europe and the Mediterranean region, EMR)肺炎住院患者中革兰阴性菌的出现频率及其对抗菌药物的敏感情况。他们共从53家医疗机构中收集到12 851株菌株,自美国和EMR收集的菌株数分别为6 873和5 978株,其中革兰阴性菌所占比例分别为61.5%和76.1%。结果发现,在美国和EMR这两个地区中,铜绿假单胞菌株均是肺炎住院患者中出现频率最高的革兰阴性菌株,出现率都为20.9%,且其对多数测试抗菌药物的敏感性降低,其中对头孢他啶的敏感率分别为79.6%和68.7%、对美罗培南的敏感率分别为76.3%和65.8%、对哌拉西林-他唑巴坦的敏感率分别为72.9%和63.9%。在自美国和EMR收集的菌株中,肺炎克雷伯菌株的检出率分别为9.7%和11.6%,其中产ESBLs菌株所占比例分别高达19.5%和35.1%,它们对美罗培南的敏感率分别为62.3%和78.7%、对阿米卡星的敏感率分别为60.8%和85.2%;不动杆菌属和嗜麦芽窄食单胞菌株的合计检出率分别为8.0%和10.7%。上述数据表明,在美国和EMR医疗机构中引起肺炎的病原菌的耐药性越来越强,对这些病原菌具有显著抗菌活性的药物越来越少。
2 多黏菌素类抗生素的临床应用
多黏菌素类抗生素属多肽类抗生素,可单用或再联合其他抗菌药物治疗革兰阴性菌、尤其是耐药菌株引起的严重感染和难治感染[6]。在临床上,胃肠外给药多黏菌素类抗生素的最常用制剂品种是硫酸多黏菌素B和多黏菌素E甲磺酸钠。目前,多黏菌素类抗生素经静脉给药多用于治疗多耐药革兰阴性菌引起且使用其他抗菌药物治疗疗效不佳的感染,同时应经正确的体外药敏试验。不过,也有学者认为,为降低多耐药菌株所致感染患者的病死率并控制这些耐药菌株的传播,在耐碳青霉烯类抗生素的鲍曼不动杆菌株比例较高的医院,早期和经验使用多黏菌素类抗生素可显著提高患者的生存率。当然,考虑到多黏菌素类抗生素的毒性以及可能引起细菌耐药,在获得细菌培养结果后应及时采取“降阶梯治疗”策略,以避免过度使用多黏菌素类抗生素[7-8]。
2.1硫酸多黏菌素B
以往学者们多认为硫酸多黏菌素B的毒性高于多黏菌素E甲磺酸钠,所以国内临床医师在选用多黏菌素类抗生素时常倾向于选用多黏菌素E甲磺酸钠。不过,随着研究的深入,现发现硫酸多黏菌素B的安全性也在可接受范围内,故其临床应用已趋增多。但有关硫酸多黏菌素B治疗多耐药革兰阴性菌感染疗效的临床研究以回顾性评估为主,缺乏设计良好的前瞻性临床研究。
Dubrovskaya等[9]回顾性研究了硫酸多黏菌素B单药治疗32例耐碳青霉烯类抗生素的肺炎克雷伯菌所致感染患者的疗效,结果显示临床治愈率达73%、治疗结束时和30 d内的病死率分别为10%和28%。进一步分析发现,基础肾功能不良是治疗失败的危险因素。另外,见有3例患者在治疗过程中发生了对硫酸多黏菌素B的耐药,这也是临床应予关注的问题。
2008年Kwa等[10]在一篇综述中总结了硫酸多黏菌素B治疗多耐药革兰阴性菌所致医院获得性感染患者的相关临床研究结果(表1):有效率为47.3% ~ 100%,病死率为20% ~ 51.4%,不良反应发生率为0% ~ 21%。这些数据表明,硫酸多黏菌素B有着良好的临床效用。
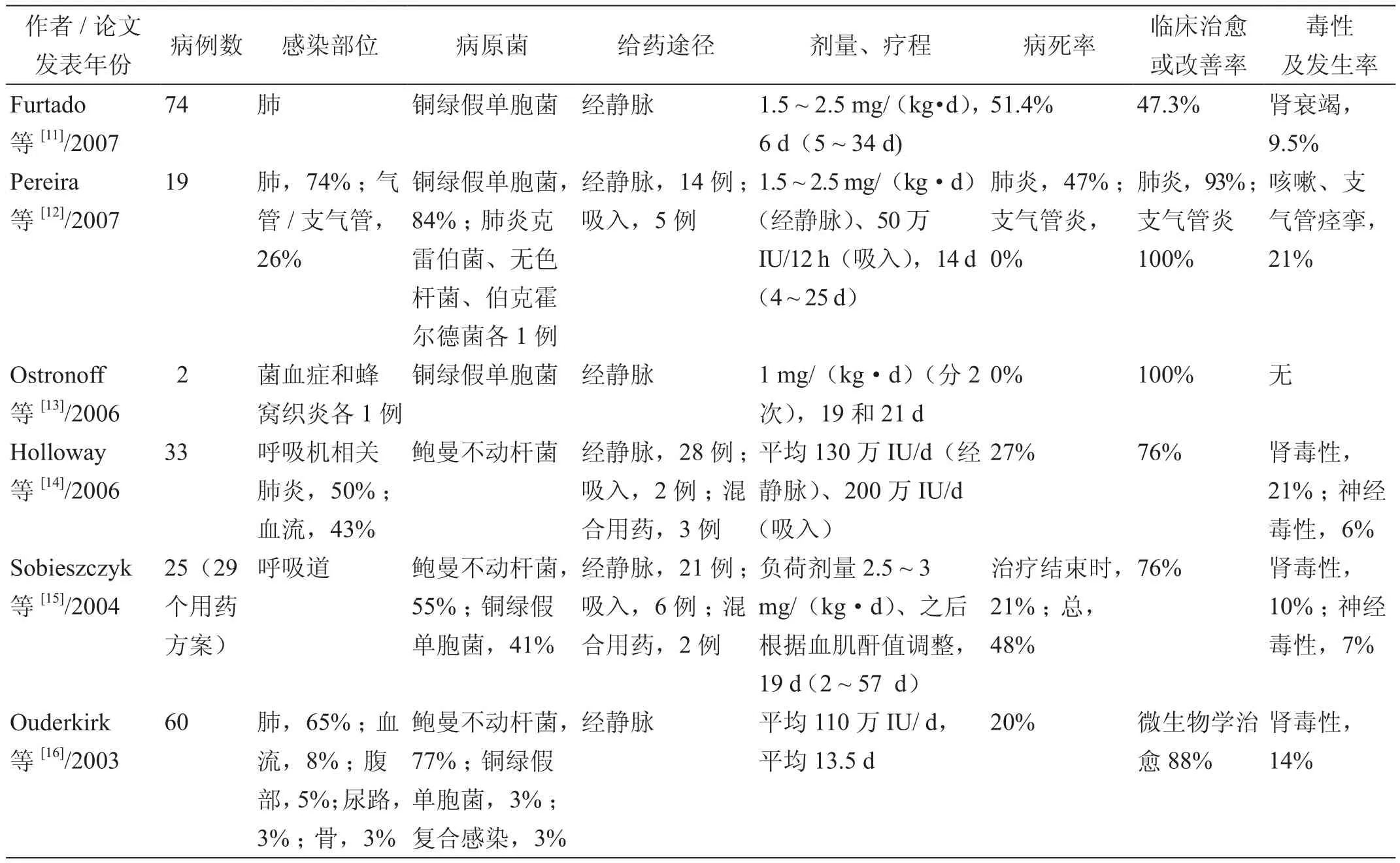
表1 硫酸多黏菌素B治疗多耐药革兰阴性菌所致医院获得性感染的临床研究结果汇总
上述有关硫酸多黏菌素B的临床研究均证实,其用于治疗耐药革兰阴性菌感染有效且安全。不过,也有其他研究得出了不同的结论。Kvitko等[17]回顾性评估了硫酸多黏菌素B与其他抗菌药物治疗铜绿假单胞菌引起的菌血症的疗效,结果发现全部133例患者的总住院病死率是41.4%,其中接受硫酸多黏菌素B治疗患者的总住院病死率为66.7%,显著高于使用其他抗菌药物治疗患者的总住院病死率(28.4%)。多变量模型分析发现,对患者总住院病死率,硫酸多黏菌素B是一个独立的危险因素。因此,该研究作者认为,经静脉给予硫酸多黏菌素B治疗铜绿假单胞菌所致菌血症的疗效并不优于其他抗菌药物。
2.2多黏菌素E甲磺酸钠
多黏菌素E甲磺酸钠治疗多耐药革兰阴性菌感染、特别是铜绿假单胞菌和鲍曼不动杆菌引起的严重感染有较好的疗效。但与硫酸多黏菌素B一样,其应用也存在一些问题,如日剂量的选择、疗程及肾功能不全患者的用药安全性等,亟待进行更多的研究予于明确。
Huang等[18]进行了一项旨在评估多黏菌素E甲磺酸钠治疗多耐药革兰阴性杆菌感染疗效和不良反应的研究。该研究包含2006-2008年中国某医院收治的15例经初始经验治疗无效的多耐药或泛耐药菌株感染患者,其中自13例患者中分离出鲍曼不动杆菌、4例患者中分离出铜绿假单胞菌、2例患者中分离出肺炎克雷伯菌。全部患者均接受多黏菌素E甲磺酸钠的治疗,平均剂量为(128±25)万IU/d、平均疗程为(22.3±6.2)d,结果显示临床有效率为73.3%、微生物清除率为60%、病死率为20%。可能存在1例肾毒性例,但未出现神经毒性例。该研究表明,对由多耐药革兰阴性菌引起的感染,经静脉给予多黏菌素E甲磺酸钠是安全、有效的治疗选择。
Kallel等[19]进行了一项病例对照研究,以评估多黏菌素E甲磺酸钠与亚胺培南治疗呼吸机相关肺炎的疗效和安全性。治疗组60例患者的病原菌为泛耐药鲍曼不动杆菌或铜绿假单胞菌;对照组60例患者的病原菌为对亚胺培南敏感的鲍曼不动杆菌或铜绿假单胞菌。两组患者的肾功能均正常。对治疗组患者给予经静脉滴注多黏菌素E甲磺酸钠600万IU/d(分3次给药)治疗,疗程(9.5±3.8)d(5 ~ 22 d);对照组患者接受的是经静脉滴注亚胺培南-西司他丁2 g/d(分4次给药)治疗,疗程(8.9±2.8)d(5 ~ 20 d)。结果显示,治疗组和对照组的有效率分别为75.0%和71.7%,差异无统计学意义。此外,所有患者均未出现肾功能障碍。该研究表明,多黏菌素E甲磺酸钠治疗多耐药鲍曼不动杆菌或铜绿假单胞菌引起的呼吸机相关肺炎有效且安全。
Falagas等[20]回顾性分析了多黏菌素E甲磺酸钠治疗258例多耐药革兰阴性菌感染的疗效。患者中包含鲍曼不动杆菌感染患者170例(65.9%)、铜绿假单胞菌感染患者68例(26.4%)、肺炎克雷伯菌感染患者18例(7.0%)、嗜麦芽窄食单胞菌和阴沟肠杆菌感染患者各1例(0.8%),他们均接受多黏菌素E甲磺酸钠治疗≥72 h。结果显示,微生物治愈率为79.1%,肾毒性发生率为10%,住院生存率为65.1%。多黏菌素E甲磺酸钠治疗的疗效未因病原菌不同而不同,也未发现独立的肾毒性预测因子。该研究表明,使用多黏菌素E甲磺酸钠治疗多耐药革兰阴性菌感染可获得满意疗效,肾毒性在可接受的范围内。
表2汇总了另外4项经静脉给予多黏菌素E甲磺酸钠治疗多耐药革兰阴性杆菌感染患者的临床研究结果。由表2可见,使用多黏菌素E甲磺酸钠治疗铜绿假单胞菌、鲍曼不动杆菌或肺炎克雷伯菌等多耐药革兰阴性菌所致感染的总有效率为66.7% ~ 76.8%、肾毒性发生率为8% ~ 18.6%。即:多黏菌素E甲磺酸钠治疗多耐药革兰阴性菌感染安全、有效,且其高剂量用药亦不会显著增加患者出现肾损害的风险。
3 多黏菌素类抗生素联合其他抗菌药物的临床应用
上述多项研究表明,多黏菌素类抗生素单药治疗多耐药革兰阴性菌所致感染安全、有效。但在应对泛耐药菌株引起的严重感染时,往往还需要再联用其他抗菌药物治疗才能获得满意的疗效。为此,不少学者进行了相关体内、外研究,以寻找更好的联合用药方案用于治疗高度耐药菌株所致感染。
Elemam等[25]通过体外实验证实,利福平、强力霉素或替加环素与硫酸多黏菌素B联用具有协同作用,可用于治疗高度耐药的产碳青霉烯酶的肺炎克雷伯菌感染。Zhang等[26]的体外研究表明,磷霉素与米诺环素或硫酸多黏菌素B联用具有协同作用,可降低对泛耐药鲍曼不动杆菌株的最低抑菌浓度(minimum inhibitory concentration, MIC)。此外,多项体内实验也证实,多黏菌素E制剂与头孢他啶、利福平或阿米卡星联用对多耐药铜绿假单胞菌株具有协同抗菌作用,可用于多耐药铜绿假单胞菌株所致肺部、会阴部和臀肌等部位感染的治疗[27-28]。
Lee等[29]进行了一项评估耐碳青霉烯类抗生素的肺炎克雷伯菌对硫酸多黏菌素B敏感性的研究。该研究包含某医院2004-2006年间收治的16例已接受硫酸多黏菌素B治疗≥3 d的肺炎克雷伯菌感染患者,其中对12例患者继续给予硫酸多黏菌素B单药治疗(平均时间为12.6 d),对余下4例患者则给予硫酸多黏菌素B联合替加环素治疗(平均时间分别为9.3和9 d,其中平均联合用药时间为6.25 d)。结果经分析硫酸多黏菌素B对患者病原菌的MIC发现,单药治疗组中有3例患者的MIC显著升高(但平均住院时间未显著延长),而联合用药治疗组中全部4例患者的MIC均无显著变化,说明硫酸多黏菌素B联合替加环素治疗可能可以防止肺炎克雷伯菌产生耐药。Conway等[30]进行的临床研究显示,53例存在慢性肺部铜绿假单胞菌感染的囊性肺纤维症患者经接受多黏菌素E制剂联合抗铜绿假单胞菌抗生素(如阿洛西林、哌拉西林、氨曲南、头孢他啶、亚胺培南或环丙沙星)治疗的疗效优于单用多黏菌素E制剂。Fitzpatrick等[31]则报告,使用硫酸多黏菌素B联合氨苄西林-舒巴坦成功治愈了1例泛耐药鲍曼不动杆菌株所致腹膜透析相关腹膜炎患者。

表2 多黏菌素E甲磺酸钠治疗革兰阴性菌感染的一些临床研究结果汇总
4 结语
近年来国内、外的细菌耐药性监测结果表明,多耐药鲍曼不动杆菌、铜绿假单胞菌和肺炎克雷伯菌等革兰阴性菌在所有致病菌中所占比例很高且耐药性突出,由这些耐药菌株引起的感染的治疗常常非常困难。上述多项研究表明,曾被限制使用的多黏菌素类抗生素治疗耐药革兰阴性杆菌所致各种感染有效,且毒性亦在可接受范围内。因此,在细菌耐药性日益增强、有效抗耐药菌药物较少的背景下,多黏菌素类抗生素仍是应对耐药革兰阴性杆菌所致各种感染的重要治疗选择。不过,由于多黏菌素类抗生素缺乏系统的药代动力学和药效学数据,加之已有的临床研究基本上以小规模的回顾性研究为主,所以未来应设计并进行更多的前瞻性、随机、对照临床研究,明确此类抗生素的最佳给药方案、疗效和安全性,以期能够充分发挥其临床效用并有效减缓耐药菌株的产生。
[1]胡付品, 朱德妹, 汪复, 等. 2013年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2014, 14(5): 365-374.
[2]Hirsch EB, Tam VH. Detection and treatment options for Klebsiella pneumoniae carbapenemases (KPCs): an emerging cause of multidrug-resistant infection [J]. J Antimicrob Chemother, 2010, 65(6): 1119-1125.
[3]Higgins PG, Dammhayn C, Hackel M, et al. Global spread of carbapenem-resistant Acinetobacter baumannii [J]. J Antimicrob Chemother, 2010, 65(2): 233-238.
[4]Miriagou V, Cornaglia G, Edelstein M, et al. Acquired carbapenemases in Gram-negative bacterial pathogens: detection and surveillance issues [J]. Clin Microbiol Infect, 2010, 16(2): 112-122.
[5]Sader HS, Farrell DJ, Flamm RK, et al. Antimicrobial susceptibility of Gram-negative organisms isolated from patients hospitalised with pneumonia in US and European hospitals: results from the SENTRY Antimicrobial Surveillance Program, 2009-2012 [J]. Int J AntimicrobAgents, 2014, 43(4): 328-334.
[6]张永信. 多肽类抗生素的临床地位及主要品种[J]. 上海医药, 2004, 25(5): 198-199.
[7]Tuon FF, Rymsza AM, Penteado-Filho SR, et al. Should polymyxin be used empirically to treat infections in patients under high risk for carbapenem-resistant Acinetobacter? [J]. J Infect, 2011, 62(3): 246-249.
[8]Joung MK, Kwon KT, Kang CI, et al. Impact of inappropriate antimicrobial therapy on outcome in patients with hospitalacquired pneumonia caused by Acinetobacter baumannii [J]. J Infect, 2010, 61(3): 212-218.
[9]Dubrovskaya Y, Chen TY, Scipione MR, et al. Risk factors for treatment failure of polymyxin B monotherapy for carbapenem-resistant Klebsiella pneumoniae infections [J]. Antimicrob Agents Chemother, 2013, 57(11): 5394-5397.
[10]Kwa AL, Tam VH, Falagas ME. Polymyxins: a review of the current status including recent developments [J]. Ann Acad Med Singapore, 2008, 7(10): 870-883.
[11]Furtado GHC, d’Azevedo PA, Santos AF, et al. Intravenous polymyxin B for the treatment of nosocomial pneumonia caused by multidrug-resistant Pseudomonas aeruginos [J]. Int J Antimicrob Agents, 2007, 30(4): 315-319.
[12]Pereira GH, Muller PR, Levin AS. Salvage treatment of pneumonia and initial treatment of tracheobronchitis caused by multidrug-resistant Gram-negative bacilli with inhaled polymyxin B [J]. Diagn Microbiol Infect Dis, 2007, 58(2): 235-240.
[13]Ostronoff M, Ostronoff F, Sucupira A, et al. Multidrugresistant Pseudomonas aeruginosa infection in neutropenic patients successfully treated with a combination of polymyxin B and rifampin [J]. Int J Infect Dis, 2006, 10(4): 339-340.
[14]Holloway KP, Rouphael NG, Wells JB, et al. Polymyxin B and doxycycline use in patients with multidrug-resistant Acinetobacter baumannii infections in the intensive care unit [J]. Ann Pharmacother, 2006, 40(11): 1939-1945.
[15]Sobieszczyk ME, Furuya EY, Hay CM, et al. Combination therapy with polymyxin B for the treatment of multidrugresistant gram-negative respiratory tract infections [J]. J Antimicrob Chemother, 2004, 54(2): 566-569.
[16]Ouderkirk JP, Nord JA, Turett GS, et al. Polymyxin B nephrotoxicity and efficacy against nosocomial infections caused by multiresistant gram-negative bacteria [J]. Antimicrob Agents Chemother, 2003, 47(8): 2659-2662.
[17]Kvitko CH, Rigatto MH, Moro AL, et al. Polymyxin B versus other antimicrobials for the treatment of Pseudomonas aeruginosa bacteraemia [J]. J Antimicrob Chemother, 2011, 66(1): 175-179.
[18]Huang J, Tang YQ, Sun JY. Intravenous colistin sulfate: a rarely used form of polymyxin E for the treatment of severe multidrug-resistant Gram-negative bacterial infections [J]. Scand J Infect Dis, 2010, 42(4): 260-265.
[19]Kallel H, Hergafi L, Bahloul M, et al. Safety and efficacy of colistin compared with imipenem in the treatment of ventilator-associated pneumonia: a matched case-control study [J]. Intensive Care Med, 2007, 33(7): 1162-1167.
[20]Falagas ME, Rafailidis PI, Ioannidou E, et al. Colistin therapy for microbiologically documented multidrug-resistant Gramnegative bacterial infections: a retrospective cohort study of 258 patients [J]. Int J Antimicrob Agents, 2010, 35(2): 194-199.
[21]Dewan A, Shoukat M. Evaluation of risk of nephrotoxicity with high dose, extended-interval colistin administration [J]. Indian J Crit Care Med, 2014, 18(7): 427-430.
[22]Falagas ME, Rizos M, Bliziotis IA, et al. Toxicity after prolonged (more than four weeks) administration of intravenous colistin [J/OL]. BMC Infect Dis, 2005, 5: 1 [2014-11-16]. http://www.ncbi.nlm.nih.gov/pmc/articles/ PMC547910/pdf/1471-2334-5-1.pdf.
[23]Michalopoulos A, Tsiodras S, Rellos K, et al. Colistin treatment in patients with ICU-acquired infections caused by multiresistant gram-negative bacteria: the renaissance of an old antibiotic [J]. Clin Microbiol Infect, 2005, 11(2): 115-121. [24]Kasiakou SK, Michalopoulos A, Soteriades ES, et al. Combination therapy with intravenous colistin for management of infections due to multidrug-resistant Gramnegative bacteria in patients without cystic fibrosis [J]. Antimicrob Agents Chemother, 2005, 49(8): 3136-3146.
[25]Elemam A, Rahimian J, Doymaz M. In vitro evaluation of antibiotic synergy for polymyxin B-resistant carbapenemaseproducing Klebsiella pneumoniae [J]. J Clin Microbiol, 2010, 48(10): 3558-3562.
[26]Zhang Y, Chen F, Sun E, et al. In vitro antibacterial activity of combinations of fosfomycin, minocycline and polymyxin B on pan-drug-resistant Acinetobacter baumannii [J]. Exp Ther Med, 2013, 5(6): 1737-1739.
[27]Gunderson BW, Ibrahim KH, Hovde LB, et al. Synergistic activity of colistin and ceftazidime against multiantibioticresistant Pseudomonas aeruginosa in an in pharmacodynamics model [J]. Antimicrob Agents Chemother, 2003, 47(3): 905-909.
[28]Tascini C, Gemignani G, Ferranti S, et al. Microbiological activity and clinical efficacy of a colistin and rifampin combination in multidrug-resistant Pseudomonas aeruginosainfections [J]. J Chemother, 2004, 16(3): 282-287.
[29]Lee J, Patel G, Huprikar S, et al. Decreased susceptibility to polymyxin B during treatment for carbapenem-resistant Klebsiella pneumoniae infection [J]. J Clin Microbiol, 2009, 47(5): 1611-1612.
[30]Conway SP, Pond MN, Watson A, et al. Intravenous colistin sulphomethate in acute respiratory exacerbations in adult patients with cystic fibrosis [J]. Thorax, 1997, 52(11): 987-993.
[31]Fitzpatrick MA, Esterly JS, Postelnick MJ, et al. Successful treatment of extensively drug-resistant Acinetobacter baumannii peritoneal dialysis peritonitis with intraperitoneal polymyxin B and ampicillin-sulbactam [J]. Ann Pharmacother, 2012, 46(7-8): e17.
Clinical application of polymyxins in the treatment of bacterial infections caused by multiple drug-resistant Gram-negative bacteria
MENG Xianmin1*, DONG Ping1, ZHANG Yongxin2**
(1. Department of Pharmacy, Shanghai Public Health Clinical Center, Shanghai 201508, China; 2. Department of Infectious Diseases, Huashan Hospital, Fudan University, Shanghai 200040, China)
The results of the monitoring of bacterial drug resistance in recent years at home and abroad indicate that the Gram-negative bacteria still account for large proportion in all drug-resistant bacteria, and the drug resistance of these bacteria is serious, which include Klebsiella pneumoniae, Pseudomonas aeruginosa and Acinetobacter baumannii. Treatment of bacterial infection caused by multi-drug resistant Gram-negative bacteria became a tough work for doctors all over the world. In recent years, the number of polymyxins prescriptions has remarkably increased due to its good antibacterial effect for multidrug resistant Gram-negative bacteria. The use of polymyxins will remain to be further standardized because of the lack of the pharmacokinetic and pharmacodynamic data, as well as clinical experience. This article describes the epidemic status of those drug-resistant Gram-negative bacteria at home and abroad and the results of polymyxins alone or in combination with other antimicrobial agents in the treatment of such infections so as to provide a reference for the better use of polymyxins in clinic.
polymyxins; multi-drug resistant Gram-negative bacteria; treatment
R978.16
A
1006-1533(2015)23-0008-06
孟现民,主管药师。研究方向:临床药学。E-mail: scmxm@126.com
**通讯作者:张永信,教授。研究方向:抗菌药物的临床应用。E-mail: zhangyongxin1943@126.com
(2014-12-12)
