沈阳市2013年副溶血弧菌临床分离株的血清分型研究
2015-12-09李继耀张国斌
刘 娜 董 雪 李继耀 张国斌 高 丹 李 欣
沈阳市疾病预防控制中心,辽宁沈阳 110031
副溶血弧菌(Vibrio parahaemolyticus,VP)属于弧菌科弧菌属的细菌,其作为嗜盐细菌属于革兰阴性菌的一种,并且与哈氏弧菌、霍乱弧菌和创伤弧菌属于同一种属。VP 在海产品(如海底泥沙、海水、浮游生物和鱼贝类等)和腌制食品中广泛存在。腹泻、头痛、呕吐、恶心、腹部痉挛和低热等急性胃肠炎的症状[1]皆可由于直接或间接食用被VP 污染的食品而引起。即使人体自身免疫系统可以对大部分因VP 引起的胃肠炎起到抑制作用,但仍然可以对肝病患者和免疫紊乱的群体造成生命威胁。副溶血弧菌不但能够引起胃肠炎,还能导致伤口感染以及败血症[2]。
在世界上的所有沿海国家中发生的食源性中毒事件中由副溶血弧菌引起的占到一半以上,包括美国、日本、东南亚等沿海国家均有报道。副溶血弧菌是导致中国沿海地区居民夏、秋季食物中毒和急性腹泻的主要原因。副溶血弧菌是以血清型为主要分类基础的,并由菌体的抗原(O)和荚膜(K)的抗原特性所决定。副溶血弧菌的血清分型是利用O 抗原和K 抗原的组合(包括11种不同的O 抗原和65 种不同的K 抗原)来进行分类的,针对沈阳地区副溶血弧菌血清分型资料不全面的现状,该研究对沈阳市2013年5—9月食源性疾病病例监测哨点医院副溶血弧菌临床菌株进行血清学分型,为该地区预防副溶血弧菌感染和流行病学调查提供全面的科学依据,现报道如下。
1 材料与方法
1.1 菌株来源
副溶血弧菌临床菌株分离自食源性疾病病例监测哨点医院临床病例,2013年5月—9月共采集250 份样本,分离得到67株副溶血弧菌,采集分离时间为7—10月份。
1.2 菌株的分离培养
菌株的分离培养使用TCBS 培养基、营养琼脂、三糖铁琼脂,其中营养琼脂和三糖铁琼脂分别加入3% NaCl。将采集的粪便标本接种于37℃TCBS 琼脂中,培养18~24 h,将TCBS 琼脂上(不分解蔗糖)的透明菌落,接种于37℃三糖铁琼脂,同样培养18~24 h,K/A,不产硫化氢者做O-F 试验、氧化酶试验和耐盐生长试验。发酵型、氧化酶阳性,0%NaCl 和10%NaCl 不生长、3%NaCl 和7% NaCl 生长者为副溶血弧菌疑似菌落,做系统生化鉴定。
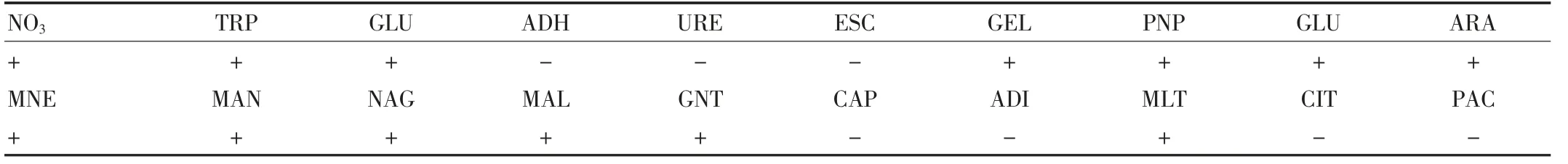
表1 2013年食源性疾病监测病例副溶血弧菌分离株API20NE 鉴定结果
1.3 生化反应和血清分型
生化反应用法国bioMerieux 生产的API20NE 生化试剂条进行鉴定,按说明书操作。
血清分型用溶血性弧菌的血清分型诊断血清(Denka Seiken,Japan),该血清含O1~O11 共11 个O 抗原诊断血清,65 个K 抗原诊断血清。方法为取一定量细菌于3﹪NaCl 盐水中,121℃灭菌30 min,离心(4 000 r/min,10 min),弃上清,用生理盐水洗涤3 次。取菌体,进行O 抗原血清凝集试验。K 抗原鉴定:直接取浓菌悬液与多价抗K 血清按适当比例混合,出现凝集反应时再用单个抗血清进行检测。用生理盐水作为对照。
2 结果
2.1 分离副溶血性孤菌菌株的生物学性状
分离的副溶血性弧菌67 株,均在TCBS 平板上呈绿色、中,心较深、湿润、形态稍凸起。氧化酶阳性。在3%Nacl 双糖铁上-/+,H2S-,动力+,耐盐性试验:0%、10%Nacl 胨水中不生长,3%、7%Nacl 胨水中生长良好,挑取纯培养物用API20NE 生化试剂条鉴定,结果见表1。
2.2 血清分群情况
分离的67 株副溶血性弧菌可分为5 个O 血清群,其中O3群占58.21%(39/67)、O4 群占35.82%(24/67)、O1 群占2.99%(2/67)、O2 群占1.49%(1/67)、O10 群占1.49﹪(1/67),如图1所示。

图1 2013年食源性疾病监测病例副溶血弧菌分离株血清分群
分离的67 株副溶血弧菌有77.61%(52/67)可以同时被O:K抗血清凝集,主要的血清型是O3:K6,占32.84%(22/67),其次是O4:K68 和O4:K8,分别占13.43%(9/67)和8.96%(6/67),约22.39%(15/67)的菌株可与O 抗血清凝集但不能与K 抗血清凝集,分别为O3:KUT 占11.94%(8/67)和O4:KUT 占10.45%(7/67),见表2。

表2 2013年食源性疾病监测病例副溶血弧菌分离株血清分型结果
3 讨论
副溶血弧菌拥有极为复杂的抗原构造,是沿海地区引起食物中毒和急性腹泻的主要致病菌,探究副溶血弧菌临床血清分型的分布情况,对该病的预防控制具有重要的意义。研究显示,2013年食源性疾病监测临床病例副溶血弧菌分离株67 株,共分为16 种不同的血清型,其中菌株数>5 的血清型有3 种,分别为O3:K6、O4:K68 和O4:K8,由此也说明这几种血清型为沈阳地区副溶血弧菌比较常见的血清型。其中最主流的血清型为O3:K6,所占比例为32.84﹪,这与国内外的相关报道是一致的[3-6]。其次为O4:K68,所占比例为13.43﹪,这与报道中除O3:K6 外O4:K8为较为常见的血清型稍有不同[7-8],国外有报道认为,O4:K68 血清型可能是由O3:K6 通过其O 抗原和K 抗原的突变遗传进化而来[9]。日本曾近连续12年调查食源性副溶血弧菌的血清型,发现每年最主流的血清型别都有很大的不同[10]。2005年沈阳地区引起食物中毒的副溶血弧菌血清型主要以O3 群和O1 群为主[11],通过对2013年沈阳市食源性疾病监测临床分离株血清型的鉴定,目前沈阳市副溶血弧菌血清型主要以O3 和O4 为主,同时在分离株中发现3 株新血清型,4 株K 混合多价凝集但单价不能定型,说明副溶血弧菌血清型具有多样性。该研究缺少毒力基因方面的检测,结合血清分型共同分析,以了解分离株的毒力基因特征,以及与血清型的内在联系,有待今后进一步考察。
[1]董雪,王秋雨,金莉莉,等.副溶血性弧菌分子分型和检测研究进展[J].中国卫生检验杂志,2008,18(2):379-381.
[2]马立芝,郭李平,邱业峰.副溶血弧菌的致病机制[J].生物技术通讯,2013,24(6):871-875.
[3]何冬梅,朱海明,马聪,等.广东省食源性副溶血弧菌表型特征与分型比较研究[J].中华流行病学杂志,2011,32(12):1259-1263.
[4]王艺,扈庆华,牟瑾,等.深圳市2007-2008年腹泻病副溶血弧菌监测及分子特性分析[J].中华流行病学杂志,2010,3l(1):51-55.
[5]曲梅,张新,刘桂荣,等.北京市副溶血弧菌病原学和分子流行病学特征分析[J].中华流行病学杂志,2011,32(12):1255-1258.
[6]李婧,王中强,苏文莉,等.沈阳地区副溶血弧菌脉冲场凝胶电泳分析[J].中国公共卫生,2012,28(5):696-698.
[7]张蔚,潘劲草,孟冬梅,等.杭州地区2000-2002年副溶血弧菌的分子分型研究[J].中华流行病学杂志,2006,27(4):343-346.
[8]石晓路,王艺,扈庆华,等.深圳地区2002-2008年副溶血弧菌分子特征研究[J].中华流行病学杂志,2013,34(6):609-613.
[9]Okura M1,Osawa R,Tokunaga A.Genetic analyses of the putative O and K antigen gene clusters of pandemic Vibrio parahaemolyticus[J].Microbiol Immunol,2008,52(5):251-264.
[10]Obata H,Kai A,Morozumi S.The trends of Vibrio parahaemolyticus foodborne outbreaks in Tokyo:1989-2000[J].Kansenshogaku Zasshi,2001,75(6):485-489.
[11]金莉莉,董雪,王秋雨,等.副溶血性弧菌重复序列-PCR 分型研究[J].微生物学通报,2008,35(3):389-394.
