铅镉重金属与生殖内质网应激研究进展
2015-12-08刘康生顾平清钟天鹰综述陈文军审校
刘康生,顾平清,钟天鹰综述,陈文军审校
近年来发现内质网应激(ndoplasmic reticulum stress,ERS)是区别于线粒体途径且能独立导致细胞凋亡的一条新的通路。缺氧、缺血再灌注损伤、病毒感染等均可引发ERS。内质网有很强的保持内环境稳态的能力,ERS一旦发生就会立即激活自我调整的信号反应机制,以期恢复稳态。ERS被普遍认为是细胞早期适应性反应。当ERS时间过久时,细胞代偿机制由凋亡机制取代,细胞进入凋亡[1]。重金属(铅)能导致多器官、系统、组织及细胞产生病理变化,铅损伤除了对神经行为[2]和免疫系统发生影响之外[3],生殖系统也是铅作用的靶器官之一,近几年伴随不孕不育人数的激增,与环境中重金属影响如铅暴露不无关系[4]。
目前研究发现,ERS与一些疾病的发生和发展密切相关,心血管疾病、肿瘤等疾病的发生,均与ERS诱导的凋亡有关[5-6]。因此,关于ERS与凋亡的关系研究备受关注,但与人类和动物生殖系统的研究还相对较少,本文就近几年来的进展综述如下。
1 内质网相关未折叠蛋白反应信号通路组成和调控机理
目前研究认为,未折叠蛋白反应(UPR)通过上调分子伴侣蛋白、激活细胞内质网相关降解通路和抑制蛋白翻译来缓解ERS。若ERS过于剧烈,UPR将直接引发程序性死亡。UPR信号通路主要由一个分子伴侣蛋白葡萄糖调节蛋白GRP78/Bip和三个感受蛋白肌醇酶I(IRE1)、蛋白激酶样内质网激酶(protein kinase R-like ER kinase,PERK)、转录激活因子6(ATF6)介导的信号通路组成(图1)[7]。
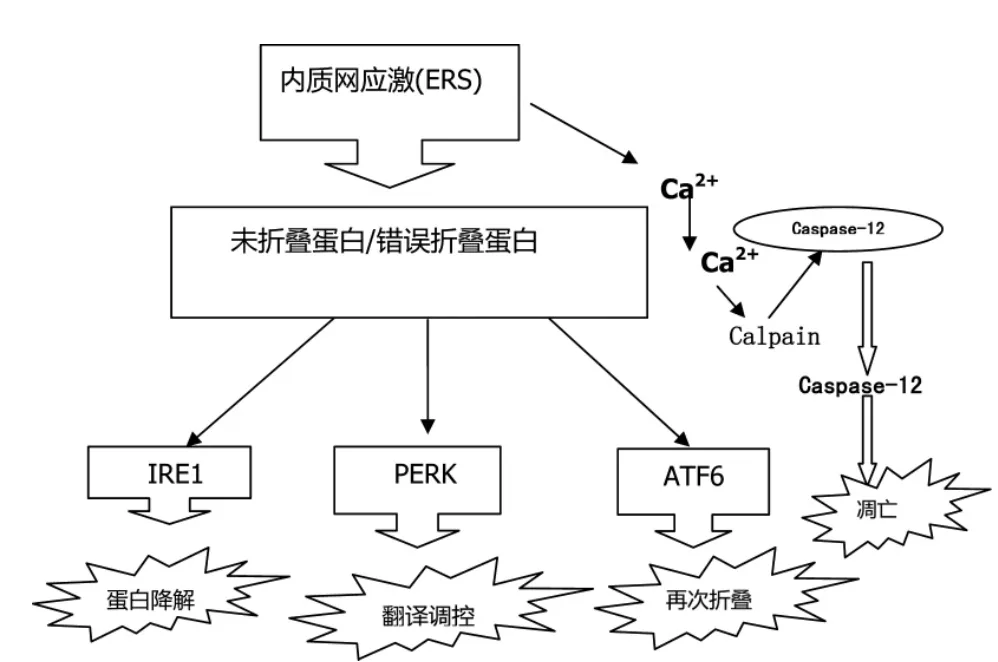
图1 内质网UPR信号通路流程图
其中IRE1普遍存在于酵母和哺乳动物细胞中,具有丝/苏氨酸蛋白激酶活性,而PERK和ATF6则只存在于哺乳动物细胞。在哺乳动物细胞中,IRE1a信号通路在UPR引起细胞保护性机制与细胞凋亡之间的转换中发挥重要的作用,其介导的X-盒结合蛋白1(XBP-1)剪接诱导的UPR能够促进细胞的生存,但激活的IRE1a、胞浆的酶结构域招募接头分子,与凋亡信号调节激酶1(ASK1)共同形成IRE1-TRAF2-ASK1复合物,从而激活氨基末端激酶(C-jun N-terminal kinase,JNK)[8-9]。近来研究表明,JNK可以阻止或促进细胞死亡,这取决于强度激活的时间。持续活化PERK通路可诱导C/EBP同源蛋白(CHOP)的积聚,促使细胞死亡。在一些细胞中,CHOP直接诱导Bcl蛋白家族凋亡成员BIM的转录。PERK-CHOP-BIM信号轴可以使连接内质网中蛋白质的错误折叠的凋亡机制激活。在UPR中,ATF6不同于IRE1和PERK的调控途径,ATF6是ATF/CREB(cAMP response-element-binding)转录因子家族成员,是通过外壳蛋白复合物Ⅱ(COPⅡ)从内质网转运到高尔基体内。ATF6与内质网腔内蛋白(BIP)结合停留在内质网内。在ERS状态下,ATF6会减少,但具体进展还需进一步研究。ATF6信号通路调控涉及一个被称为调节膜内蛋白水解(RIP)的机制(蛋白质到高尔基体内的水解过程)。在经历转运后,其活化的N端转运到细胞核内并诱导内质网分子伴侣、X盒结合蛋白1(XBP1CHOP)等的转录表达[10]。
Caspase-12是半胱天冬酶家族中唯一仅在ERS通路中活化定位于内质网的分子,普遍认为Caspase-12是 ERS的特异性凋亡分子[11]。在没发生ERS时,Caspase-12以无活性酶原状态分布于内质网膜上。当发生ERS时,IRE1α激活肿瘤坏死因子受体相关因子TRAF2并将Caspase-12剪切活化,进而激活Caspase家族的其他信号蛋白,引起经典Caspase途径介导的细胞凋亡[12]。由于人体细胞缺乏Caspase-12基因(基因突变),其介导细胞凋亡作用被为同源物的Caspase-4替代,并对ERS反应是特异性的[13-14]。通常情况下,GRP78与 Caspase-12以复合体存在于内质网膜上,一定程度上抑制了细胞凋亡,但当ERS发生时,GRP78的解离使Caspase-12活化进而引发细胞凋亡的激活,形成相应的特异性蛋白。Wu等[15]在食管癌细胞 EC109中首次证实,腺甘可通过CHOP和Caspase-4通路诱导癌细胞凋亡。
2 ERS与生殖相关通路研究
Xu等[16]在小鼠孕第8天腹腔注射200个RH速殖子,感染小鼠在孕14天后开始出现感染症状,但是多数在孕16 d仍然存活。通过荧光定量PCR和蛋白免疫印迹分析,发现了感染组中,ERS标记物,如 GRP78,CHOP 和 Caspase-12,JNK/ASK1 信号上调或激活,而以NAC预处理可抑制上述基因的表达或信号通路的激活。2011年乌兰等[17]探讨了胎盘组织中 ERS相关蛋白——钙联蛋白(calnexin,CNX)mRNA及蛋白表达与子痫前期发病的关系,发现轻重度子痫前期患者组CNX mRNA表达水平高于正常足月妊娠组[分别为(1.32±0.06)、(3.42±0.11)与(0.54±0.04)],并且 CNX蛋白表达水平也高于正常足月妊娠组[分别为(1.57±0.23)、(2.11±0.53)与(0.57±0.11)],提示了 ERS可能是子痫前期发病机制之一。有文献[18]探讨了ERS介导的细胞凋亡在子宫内膜异位症(EM)发病中的作用,结果发现EM患者异位和在位子宫内膜细胞凋亡率均显著低于正常子宫内膜,且异位子宫内膜细胞凋亡率显著低于在位子宫内膜;EM患者异位和在位子宫内膜 GRP78和 GRP94,Caspase-3,12 mRNA及蛋白表达水平均显著低于正常子宫内膜,异位子宫内膜 GRP78和GRP94,Caspase-12,3 mRNA及蛋白表达水平亦显著低于在位子宫内膜,认为EM患者子宫内膜细胞凋亡减少,ERS介导的细胞凋亡途径下调可能是EM发病的机制之一。
子痫前期中,miRNA-101可通过调控内质网蛋白ERp44的表达来调控胎盘滋养细胞的凋亡过程[19]。在HTR-8/SVneo(滋养细胞)中过表达miRNA-101后,ERp44的表达显著下调,封闭 miRNA-101后,细胞凋亡数量增加。各种生理和病理学条件导致内质网腔中未折叠或错误折叠蛋白质的积累,会引发ERS。通过RNA深度测序,发现ERS胁迫下,HeLa细胞中hsa-miR-423-5p的表达上调,而hsa-miR-452-5p的表达下调,以Western blotting实验证实CDKN1A是hsa-miR-423-5p的靶基因,推测microRNA通过调控它们的靶基因,在ERS的适应性反应中协同作用[20]。
3 铅与生殖ERS的相关研究
3.1 睾丸间质细胞 睾酮激素的主要来源于睾丸间质细胞,睾酮水平取决于细胞本身的反应。有研究[21]显示ERS特异诱导剂胡萝卜素和衣霉素显著诱导了小鼠睾丸间质细胞的凋亡,且呈浓度和时间依赖性。GRP78 mRNA的表达水平在培养24 h显著上升,48 h呈下降趋势。CHOP和Caspase-12 mRNA的表达水平随凋亡率的增加显著上升。ERS通过CHOP Caspase-12信号通路参与小鼠睾丸间质细胞的凋亡过程[22]。铅镉也可以在不同细胞类型中诱发ERS,可以上调小鼠睾丸细胞GRP78等ERS相关蛋白,并上调CHOP的表达并激活Caspase-12,从而导致系膜细胞凋亡。
3.2 胚胎细胞。细胞凋亡是铅致胎盘损伤的重要机制之一。Smad4及S100B蛋白在孕期不同阶段于铅暴露下大鼠胎盘中的表达与孕末期血铅水平密切相关,在铅致胎盘细胞凋亡的发生发展中具有重要作用[23]。王云英等[24]认为血铅水平与胎盘组织中NF-KB表达和细胞凋亡指数显著相关(相关系数分别为0.663和0.641),铅暴露引起NF-KB表达异常可能是胎盘细胞失衡和胚胎发育异常的重要机理之一。斑马鱼由于具有成熟周期短,繁殖率高、传代周期短、产卵时间长、胚胎透明以及鱼种发育遗传背景清晰等优点,非常适用于铅的生殖毒性等远期效应的观察,2014年殷健[25]研究重金属铅对斑马鱼成鱼和胚胎的影响,发现铅会引起斑马鱼胚胎心率减慢,体长减小,铅对斑马鱼成鱼和胚胎氧化应激、细胞凋亡的发生、毒性作用机制均与丝裂原活化蛋白激酶(MAPKs)信号转导通路相关。
3.3 卵巢 铅蓄积于卵巢可使皮质区变薄,成熟卵泡、生长卵泡减少,卵泡内上皮细胞核固缩、线粒体肿胀、崩解等。铅可抑制卵母细胞第一极体的释放,影响卵母细胞的存活率并可降低体外受精率和卵母细胞数量;亦破坏卵母细胞减数分裂进行,降低卵母细胞的受精能力,影响小鼠的正常生殖功能[26]。尹娇娇[27]研究表明,ERS参与了山羊颗粒细胞凋亡进程,表皮生长因子(EGF)通过下调 ATF4、ATF6、CHOP mRNA水平的表达,对ERS诱导的山羊颗粒细胞凋亡具有显著的抑制作用。
3.4 衣霉素(TM)诱导卵巢和胚胎ERS实验 衣霉素可通过影响蛋白质的糖基化,使内质网中未成熟蛋白堆积而诱发ERS。丁晓等[28]以TM诱导卵巢ERS,以卵巢玻璃化冻存流程中前培养1 h作为参考,对ERS伴侣蛋白GRP78表达水平进行检测,显示各浓度 TM诱导的卵巢GRP78表达均高于对照组,以TM达5 μg/mL时响影最为显著,随后随着浓度增加表达逐渐稳定并略有下降;而对作用3 h后CHOP表达检测显示,随着 TM浓度的增加,CHOP缓慢上升并与10、20和30 μg/mL组持续高浓度表达,说明在保护因子无法缓解ERS时,CHOP上升介导细胞走向凋亡。李昕昕等[29]利用TM处理胚胎激发ERS,应用显微注射mRNA方法实现基因过表达,通过注射特异的反义寡核苷酸实现基因封闭,发现XBP1剪切随IRE1a过表达及封闭而增加或减少,以TM处理导致胚胎发育畸形,XBP1剪切增加,而封闭XBP1可部分挽救发育畸形;封闭IRE1a亦可明显挽救发育畸形,XBP1剪切恢复,但具体作用机制需进一步研究。
3.5 其他 有研究[30]表明,铅暴露组ERS使凋亡Caspase-12 mRNA蛋白表达增加,凋亡指数(AI)在实验组明显上升。铅暴露组中胎盘滋养层细胞发生纤维蛋白沉积,线粒体肿胀,数量减少,内质网肿胀,空泡形成,同时使胎盘细胞发生凋亡,增加Caspase-12 mRNA表达,促进了ERS。
4 镉与生殖ERS的相关研究
4.1 睾丸间质细胞、胚胎细胞 Lian等[31]的文献研究表明,胎盘发育损伤和胎儿生长发育迟缓与胎盘ERS有关。有研究[25]阐述重金属镉对斑马鱼成鱼和胚胎的96 h半数致死浓度(96 h-LC50)分别为24.341 mg/L和46.67 mg/L,而胚胎孵育抑制作用的96 h半数致畸浓度(96 h-EC50)为42.499 mg/L。重金属镉引起斑马鱼胚胎心率减慢,体长减小;镉对斑马鱼成鱼和胚胎均具有明显的毒性作用,能够诱导氧化应激、细胞凋亡及免疫毒性的发生,其毒性作用机制与 MAPKs信号转导通路相关[32]。Wang等[33]发现,孕期母体镉暴露明显升高窝胎鼠指(趾)部和尾部畸形率,显著降低胎鼠身长、活胎重和胎盘重,胎盘迷路层的平均血窦区域明显减少。以镉处理的小鼠胎盘迷路层增殖细胞核抗原(PCNA)阳性增殖细胞数较对照组明显减少,TUNEL(TdT介导dUTP缺口末端标记)阳性细胞数亦较对照组显著増多,孕期母体以镉处理 8 h后,小鼠胎盘组织GRP78和ATF4 mRNA水平明显升高,且胎盘组织GRP78、peIF2α和CHOP蛋白表达显著上调,提示孕期镉暴露会显著诱导小鼠胎盘ERS。
4.2 卵巢 有文献[34]探讨了镉对卵巢细胞凋亡的诱导作用,病理检测可见随镉剂量的增加,卵泡闭锁率逐渐升高,与对照组相比差异明显;96 h对照组凋亡率上升为10.20%,而高、中、低各组分别为21.41% 、15.88%、12.47%,表明各组均有不同程度凋亡。镉对小鼠卵巢颗粒细胞的凋亡具有促进作用并有剂量的效应关系,镉对卵巢卵泡的发育有促进闭锁的作用,增加了闭锁卵泡构成比;同时镉能使小鼠卵巢颗粒细胞中的丙二醛(MDA)增加和超氧化物歧化酶(SOD)活性的降低,镉增强卵巢颗粒细胞p53蛋白的表达,p53基因参与了小鼠卵巢颗粒细胞凋亡的调控。
5 讨论和展望
本文对ERS与生殖疾病及铅镉重金属与生殖ERS的相关进行描述。一方面,铅镉诱导ERS有其共同特点,在剂量与效应关系或者时间与效应关系都呈先上升后下降的方向;另一方面,ERS引起的程序性死亡机制是通过CHOP和Caspase-12等介导的。目前对于ERS受铅镉影响机制研究以体外动物研究为主,选择铅镉的靶器官或靶细胞进行相关的体内研究很少,值得进一步深入探讨。
[1] Glembotski CC.Endoplasmic reticulm stress in the heart[J].Circ Res,2007,101(10):975-984.
[2] 匡晓宁,雷 洁,古桂雄.铅对新生大鼠生长发育的影响[J].东南国防医药,2007,9(4):283-285.
[3] 刘康生,黄 蓉,薛满红,等.学龄前儿童血铅水平与免疫指标的相关性[J].东南国防医药,2013,15(6):626-627.
[4] Meeker JD,Rossano MG,Protas B,et al.Cadmium,lead,and other metals in relation to semen quality:human evidence for molybdenum as a male reproductive toxicant[J].Environ Health Perspect,2008,116(11):1473-1479.
[5] Kassan M,Galan M,Partyka M,et al.Endoplasmic reticulum stress isinvolved in cardiac damage and vascular endothelial dysfunction in hypertensive mice[J].Arteroscler Thromb Vasc Biol,2012,32(7):1652-1661.
[6] Liu D,Zhang M,Yin H.Signaling path ways involved in endoplasmic reticulum stress induced neuronal apoptosis[J].Int J Neurosci,2013,123(3):155-162.
[7] Ron D,Walter P.Signal integration in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.
[8] Malhotra JD,Kaufman RJ.The endoplasmic reticulum and the unfolded protein response[J].Semin Cell Dev Bio,2007,18(6):716-731.
[9] Luo D,He Y,Zhang H,et al.AIP1 is critical in transducing IRE1-mediated endoplasmic reticulum stress response[J].J Biol Chem,2008,283(18):11905-11912.
[10] Ye J,Rawson RB,Komuro R,et al.ER stress induces cleavage of membrane-bound ATF6 by the same proteases that process SREBPs[J].Mol Cell,2000,6(6):1355-1364.
[11] Chen YH,Wu XD,Yao ST,et al.Calcineurin is involved in car-dioprotection induced by ischemic postconditioning through attenuatingendoplasmic reticulum stress[J].Chin Med J(Engl),2011,124(20):3334-3340.
[12] Kim EM,Shin EJ,Choi JH,et al.Matrix metalloproteinase-3 is increased and participates in neuronal apoptotic signalingdownstream of caspase-12 during endoplasmic reticulum stress[J].J Biol Chem,2010,285(22):16444-16452.
[13] Liu D,Zhang M,Yin H.Signaling path ways involved in endoplasmic reticulum stress induced neuronal apoptosis[J].Int J Neurosci,2013,123(3):155-162.
[14] Rao RV,Peel A,Logvinova A,et al.Coupling endoplasmic reticulum stress to the cell death program:roleof the ER chaperone GRP78[J].FEBS Lett,2002,5(14):122-128.
[15] Wu L,Wei B,Guo Y,et al.Apoptosis induced by adenosine involves endoplasmic reticulum stress in EC109 cells[J].Int J Mol Med,2012,10(38):921-928.
[16] Xu X,Liu T,Zhang A.Reactive oxygen species-triggered trophoblast apoptosis is initiated by ER stress via activation of caspase-12,CHOP and the JNK pathway in toxoplasma gondii infection in mice[J].Infect Immun,2012,80(6):2121-2132.
[17]乌 兰,石中华,王小青.胎盘内质网应激相关蛋白Calnexin与子痫前期发病的关系[J].江苏医药,2011,37(16):1895-1896.
[18]欧阳煜宏,李晨阳,姚 瑾,等.内质网应激介导的细胞凋亡在子宫内膜异位症发病中的作用研究[J].中国实用妇科与产科杂志,2012,28(3):218-221.
[19]常玉华,李 坤.子痫前期患者胎盘中miRNA-101和内质网蛋白ERp44的表达和意义[J].中国生化药物杂志,2014,34(6):38-43.
[20] Dai LM,Huang C,Chen L.Altered expression of microRNAs in the response to ER stress[J].Sci Bull,2015,60(2):202-209.
[21]张 卓.内质网应激诱导小鼠睾丸间质细胞凋亡的作用研究[D].杨陵:西北农林科技大学,2014.
[22] Ji YL,Wang H,Meng C,et al.Melatonin alleviates cadmium-induced cellular stress and germ cell apoptosis in testes[J].J Pineal Res,2011,52(1):71-79.
[23]曲宝明.细胞凋亡、Smad4及S100B蛋白在孕期铅暴露大鼠胎盘中的表达及意义[J].中国预防医学杂志,2012,13(5):347-349.
[24]王云英,胡海燕,徐风森.孕期铅水平对胎盘组织NF-KB表达和细胞凋亡的影响[J].中国优生与遗传杂志,2013,21(2):32-33.
[25]殷 健.重金属对斑马鱼的毒性效应及作用机制研究[D].北京:北京协和医科大学,2014.
[26]曹 卉.铅对小鼠卵泡颗粒细胞凋亡的影响[J].上海畜牧兽医通讯,2010(6):23-24.
[27]尹娇娇.EGF通过内质网应激通路调控山羊卵泡颗粒细胞凋亡的作用研究[D].西安:西北农林科技大学,2014.
[28]丁 晓,颜 贝,陈 杰,等.小鼠卵巢内质网应激模型的建立及诱导凋亡的研究[J].宁夏医科大学学报,2013,35(7):743-746.
[29]李昕昕,冯娇娇.影响非洲爪蟾胚胎发育[J].南京医科大学学报:自然科学版,2011,31(10):1399-1402.
[30] Wang YY,Hu HY,Li H,et al.Effect of Lead exposure on placental cellular apoptosis and endoplasmic reticulum stress in rats[J].Chin Med J(Engl),2014,127(9):1744-1747.
[31] Lian IA,Loset M,Mundal SB,et al.Increased endoplasmic reticulum stress in decidual tissue from pregnancies complicated by fetal growth restriction with and without pre-eclampsia[J].Placenta,2011,32(11):823-829.
[32] Wang L,Gallagher EP.Role of Nrf2 antioxidant defense in mitigating cadmium-induced oxidative stress in the olfactory system of zebrafish[J].Toxicol Appl pharmacol,2013,266(2):177-186.
[33] Wang Z,Wang H,Xu ZM.Cadmium-induced teratogenicity:association with ROS-mediated endoplasmic reticulum stress in placenta[J].Toxicol Appl Pharmacol,2012,259(2):236-247.
[34]周新华.镉对小鼠卵巢颗粒细胞凋亡作用及相关影响因素的研究[D].长沙:湖南农业大学,2006.
