龙茭2号不同发育阶段茎部活性氧的检测分析
2015-12-07康璐瑶崔海峰邢阿宝李帅叶子弘
康璐瑶,崔海峰,邢阿宝,李帅,叶子弘
(中国计量学院生命科学学院/浙江省生物计量与检验检疫技术重点实验室,杭州,310018)
茭白(Zizania latifoliaTurcz)又名茭瓜、茭笋、菰手、雕胡,属于禾本科多年生水生宿根性草本植物,无性繁殖,原产于中国和东南亚[1],是我国第二大水生蔬菜,具有重要的经济价值。茭白孕茭与茭白黑粉菌侵染茭白植株密切相关,茭白黑粉菌侵染茭白成功后,茭白的开花受到抑制,就会刺激茭白茎部膨大,形成可食用的膨大茎[2]。茭白黑粉菌是一种寄生真菌,其侵染茭白使茭白茎部膨大形成可食用肉质茎的过程,实际上就是一个感病的过程。研究发现植物受到病原物侵染,会诱导活性氧暴发,而大量活性氧的积累会造成细胞组分的严重损伤[3]。因此,植物在长期的进化过程中形成了一系列的免疫防御反应,存在多种活性氧清除机制,其中酶促保护机制,如超氧化物歧化酶 (SOD)、过氧化物酶(POD)在活性氧的清除中具有重要作用[4,5]。
本试验对茭白与黑粉菌互作中龙茭2号植株自身的活性氧激活及相关保护酶的变化进行分析,通过对茭白不同部位中2种保护酶的活性变化分析,探讨了茭白孕茭过程中茭白黑粉菌侵染引发的应激防御反应,为阐明茭白与黑粉菌互作机制提供理论依据。
1 材料与方法
1.1 试验材料
供试品种为双季茭白龙茭2号,选取3个不同时期(5、10、15 cm)的膨大茎部。试验所需材料在桐乡董家茭白基地采集。
1.2 试验方法
采用NBT组织染色法染色观察,选取不同发育阶段生长良好的龙茭2号茭白,设定肉质茎长度依次为5、10、15 cm,用刀片分别切取其尖端、中部和基部并制成切片,尽量使切片厚薄均匀。将制作好的样品放入盛有750 μmol/L NBT溶液的平皿中,使NBT溶液没过样品,室温染色6 h后,超纯水洗涤3次后于电子显微镜下观察染色情况。
参照宋凤鸣等[6]的方法测定SOD活性,参照秦国政等[7]的方法测定POD活性。
2 结果与分析
2.1 NBT组织定位染色结果
NBT染色后观察茭白茎部O2-·的分布状态,可以看出横切面(图1A)中维管束位置染色较深,其他部位染色较浅;纵切(图1B)染色发现茭白茎部的O2-·主要分布在维管束周围,局部成片分布。由此可见,茎部膨大过程中,龙茭2号茎部各部分均有O2-·的存在,O2-·的分布可能是沿着维管束生长的方向四周分散。
对不同发育阶段龙茭2号茭白的基部、中部、尖端进行NBT染色观察发现(图2),茭白茎部肉质茎膨大过程中,SOD在不同发育阶段各部分均存在活性表达,不同部位NBT着色程度不同,在15 cm长度的茭白茎部中,茎基部及中部着色较深,尖端着色较浅,而在5 cm长度的茭白茎部,茎尖端着色较深。茭白不同发育阶段的各部位着色程度不同,说明不同发育阶段及不同部位O2-·的分布存在差异。
2.2 SOD活性变化
图3表明,同一发育时期中,茎中部的SOD活性大多高于基部及尖端。不同发育时期,发育早期(5 cm)SOD活性较高;随着发育时期的推进,SOD活性先降低后升高;但不同发育期间茭白茎部尖端部分SOD的活性较稳定,且在发育早期SOD活性均高于其他两个时期。在龙茭2号的3个发育时期中,茎基部、中部及尖端SOD活性变化趋势均表现为先升后降,与NBT染色观察结果基本一致。
2.3 过氧化物酶(POD)活性变化
由图4可以看出,龙茭2号茎部POD活性在发育时期及分布部位中均有差异:同一发育阶段的茎中部POD酶活最低、尖部最高;茎部不同发育阶段的基部、中部和尖端POD酶活均呈现先降后升的变化趋势;同一发育阶段中尖端POD活性最高、基部次之、中部最低。
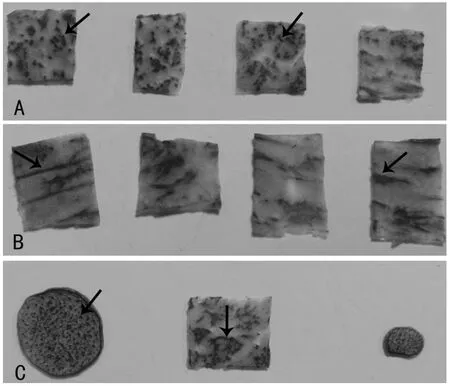
图1 茭白茎部NBT染色的横切及纵切观察
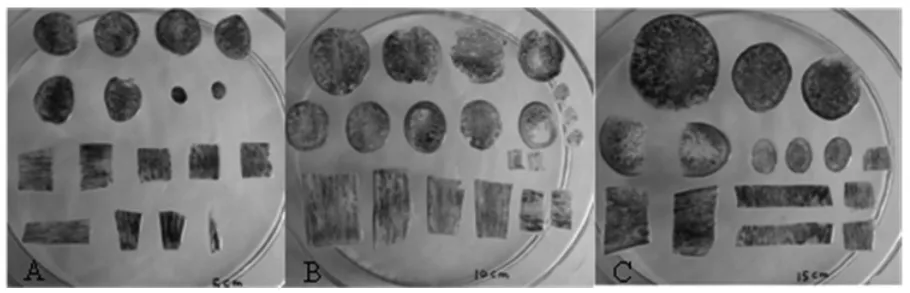
图2 茭白茎部不同发育阶段染色观察
3 讨论与结论
茭白是我国除莲藕外的第二大水生蔬菜,具有重要的经济价值[8]。目前研究表明,茭白孕茭与茭白黑粉菌的侵染密切相关。茭白组织切片观察发现,茭白茎部分布着大量的茭白黑粉菌,正常交白茎部黑粉菌以菌丝形态存在,可在薄壁组织细胞间穿梭绕行,也可以直接穿过细胞在茎部伸展[9]。茭白黑粉菌侵染茭白的机制目前尚不明确,但是茭白孕茭过程中黑粉菌的侵染共生必然引发茭白植株产生一系列的防御反应,并在共生孕茭过程中保持一种应急防御平衡。本试验通过茭白茎部NBT染色观察发现,茭白茎部存在活性氧的激活及相关的保护酶的表达调控,保护酶染色在茎部各部位均能观察到,但在维管束周围颜色较深,可能是维管束周围的保护酶活性较高。部分保护酶的活性变化可能与茭白黑粉菌侵染相关。
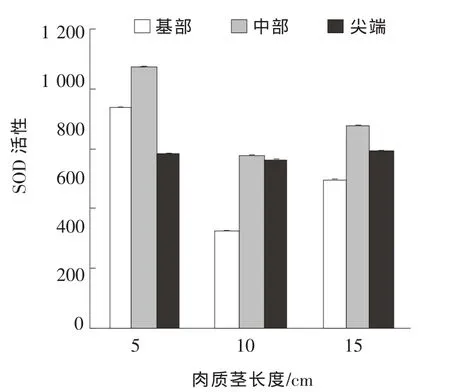
图3 龙茭2号SOD活性变化
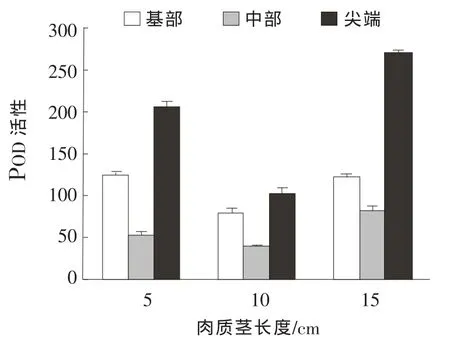
图4 龙茭2号POD活性变化
病原真菌侵染植株时会引发植物自身的应激防御反应,进而保护植物免受病原真菌侵害,目前针对活性氧暴发等相关应激反应,植物体内形成了2种主要的保护机制,包括酶促和非酶促两类[10]。研究表明,这2种保护机制在植物体内活性氧的清除和维持中具有重要作用[11]。在茭白的发育过程中,保护酶类如SOD的活性存在明显的变化,龙茭2号发育早期SOD活性较高、发育中期活性降低,发育后期SOD活性又有所升高,可能与茭白黑粉菌的侵染分布有关。茭白孕茭发育早期,黑粉菌成功侵染茭白植株,引发茭白植株产生应激反应,如活性氧暴发,茭白植株通过对保护酶活性的调控维持体内正常生长所需的活性氧含量,进而导致发育早期SOD活性较高;随着茭白发育的进行,黑粉菌在茭白茎部膨大的过程中伸展扩散到茎部的各个部位,与茭白维持共生状态,茭白植株应激反应降低,相关保护酶活性也随之降低;到了发育后期,茭白茎部停止发育,茎部内黑粉菌数量增多,再一次引发茭白植株的应急防御反应,进而导致相关保护酶活性升高。由此可见,茭白植株相关保护酶的活性变化与黑粉菌侵染密切相关,对其开展进一步研究有助于阐明茭白孕茭过程中茭白植株与黑粉菌的互作机制。
[1]陈守良,徐克学.菰属ZizaniaL.植物的分支分类研究[J].植物研究,1994,14(4):385-394.
[2]You W,Liu Q,Zou K,et al.Morphological and molecular differences in two strains ofUstilago esculenta[J].Current microbiology,2011,62(1):44-54.
[3]杜秀敏,殷文璇,赵彦修,等.植物中活性氧的产生及清除机制[J].生物工程学报,2001(2):121-125.
[4]江解增,张强,曹碚生.茭白肉质茎膨大过程中保护酶的活性变化[J].江苏农业科学,2007(3):93-95.
[5]刘伟.茭白肉质茎膨大期间的氧化胁迫研究[D].杭州:浙江大学,2011.
[6]宋凤鸣,葛秀春.枯萎病菌侵染后棉苗体内超氧化物歧化酶和过氧化氢酶活性的变化及与抗病性的关系[J].浙江大学学报:农业与生命科学版,1999,25(4):373-377.
[7]秦国政,田世平,刘海波,等.拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J].中国农业科学,2003,36(1):89-93.
[8]姜丽娜,符建荣,符长焕,等.平衡施肥对茭白产量和品质的影响[J].浙江农业学报,2003,15(3):161-166.
[9]施国新,徐祥生.茭白黑粉菌在茭白植株内形态发育的初步研究[J].云南植物研究,1991,13(2):167-172.
[10]孙国荣,彭永臻,阎秀峰,等.干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响[J].林业科学,2003,(1):165-167.
[11]吕品,张岩,李建华,等.植物细胞活性氧的产生和清除机制[J].生物学教学,2010(2):4-5.
