鼎湖山典型森林土壤苯系物通量对模拟氮沉降的响应
2015-12-06郑丽丽郭萍萍易志刚
郑丽丽,郭萍萍,易志刚
福建农林大学资源与环境学院,福建 福州 350002
鼎湖山典型森林土壤苯系物通量对模拟氮沉降的响应
郑丽丽,郭萍萍,易志刚*
福建农林大学资源与环境学院,福建 福州 350002
苯系物(BTEX)是一类重要的挥发性有机化合物(VOCs),能参与大气光化学反应,并对人体健康有重要影响。土壤能释放或吸收BTEX,氮沉降会影响土壤生态过程,从而可能影响土壤BTEX通量。有关森林土壤BTEX通量对氮沉降响应的研究十分有限。运用静态箱采样、利用大气预浓缩仪-GC-MS研究了鼎湖山两种典型森林——马尾松林(Pine forest, PF)和季风常绿阔叶林(Monsoon evergreen broadleaf forest, BF)土壤BTEX通量对模拟氮沉降增加的响应。结果表明:自然氮沉降条件下,PF土壤吸收BTEX,乙苯吸收速率最大(-51.52±10.94) pmol·m-2·s-1,低氮抑制了PF土壤对BTEX的吸收,中氮主要使土壤由“汇”变为“源”;BF土壤释放BTEX,甲苯释放速率最高(7.11±0.12) pmol·m-2·s-1,施氮降低了BF土壤BTEX释放量或使土壤由“源”变“汇”,且低氮和高氮的影响效果更显著。施氮条件下,PF土壤甲苯与乙苯、间/对二甲苯、邻二甲苯通量显著相关,BF土壤苯与甲苯、间/对二甲苯、邻二甲苯显著相关。土壤BTEX通量无明显日变化规律,对照和高氮样地最大释放均出现在7:00,最大吸收出现在19:00(对照样地)和13:00(高氮样地)。自然氮沉降条件下,BF土壤CO2通量(29.46±3.27) mg·m-2·h-1显著高于PF土壤(11.02±0.96) mg·m-2·h-1,两个水平氮处理均促进了两种林型土壤CO2的释放。土壤BTEX通量与土壤温度、大气温度和CO2浓度无显著相关性;邻二甲苯和乙苯通量与土壤湿度呈显著相关。
氮沉降;苯系物;挥发性有机化合物;通量;马尾松林;季风常绿阔叶林
苯系物(BTEX)是一类重要的挥发性有机化合物(VOCs),属单环芳烃,包括苯(benzene)、甲苯(toluene)、乙苯(ethyl benzene)和二甲苯(xylene)的同分异构体。BTEX具有很强的挥发性,易进入空气中,参与大气化学过程,对臭氧和光化学烟雾的生成具有贡献(Atkinson,2000)。除空气外,土壤也是BTEX的“汇”,大气中的BTEX可通过干湿沉降进入土壤。随着土壤环境条件的改变,土壤中BTEX也有可能挥发进入大气(Esteve等,2007;鲁炳闻等,2010)。目前,对土壤中BTEX的研究多集中在分析方法及污染土壤中BTEX的环境行为和生态毒理上(Ezquerro等,2004;周启星和王美娥,2009;鲁炳闻等,2010),关于森林BTEX研究报道较少(Heiden等,1999;Kesselmeier等,2000;White等,2009)。
我国是继欧洲、北美之后的全球第3大氮沉降集中区,尤其是处于经济高速发展的华南地区(Galloway等,2004)。广东鼎湖山年降水氮沉降量为35.6~38.4 kg·hm-2(以N计),与欧洲高氮沉降区相当(Klimont等,2009)。氮沉降可影响森林生态系统结构与功能,如引起土壤酸化、养分失衡、微生物多样性改变、凋落物分解变化等(Magill等,2004;Hoegberg等,2006;方华和莫江明,2006;蔡玉婷等,2013),而土壤 VOCs主要源于土壤微生物、地表凋落物和植物根系,因此氮沉降可能会影响森林土壤与大气间VOCs交换通量。
因此,在氮沉降全球化的趋势下,研究土壤BTEX通量对大气氮沉降的响应有重要意义,不仅可以获得森林土壤BTEX排放清单,还能正确评价土壤BTEX对大气化学和土壤生态的潜在影响。
1 材料与方法
1.1 研究地概况
鼎湖山国家级自然保护区(23°09′21″~23°11′30″ N,112°30′39″~112°33′41″ E)位于广东省中西部,属亚热带季风性气候,年均气温 20.9 ℃,最冷月(1月)和最热月(7月)的平均温度分别为12.6和28.0 ℃。年平均降雨量为1678 mm,干、湿季明显,其中80%分布在4─9月(刘效东等,2014)。
实验选取保护区内的两种典型森林:马尾松林(Pine forest, PF)和季风常绿阔叶林(Monsoon evergreen broadleaf forest, BF)为研究对象。PF为1930年前人工种植,林内以马尾松为主,还有少量的桉树。因长期受人为活动干扰,该林退化严重,林分结构简单;BF地处保护区的核心区,已有400多年的保护历史。该林林冠重叠、稠密,种类丰富,结构复杂(Mo等,2003)。各样地具体描述见文献(Mo等,2003;Huang等,2012)。
1.2 实验设计
PF和BF分别设置9和12个氮处理样方(10 m×20 m),进行外加氮实验。其中BF设置4个处理:对照、低氮、中氮和高氮,分别在林地喷施0、50、100和150 kg·hm-2·a-1(以N计),PF设置3个氮处理,即对照、低氮和中氮。每个处理均设3个重复。自2003年7月起,每月月底喷施NH4NO3(Zhang等,2008)。
1.3 样品采集与分析
样品采集于2012年3月中旬进行。气体样品利用静态箱法收集。静态箱为组合式,由底箱和盖箱两部分组成。底箱为圆环,直径25 cm,高度10 cm,打入地下 2~3 cm,尽量避免切断细根,保留地表凋落物;盖箱为顶部密封的圆桶,直径25 cm,高度35 cm。箱内装有风扇,以充分混匀箱内气体。采样箱设计参阅文献(Zhang等,2008)。分别在罩箱后0和30 min用医用注射器采集箱内气体样品,并收集于2 L Teflon采样袋中。每次样品采集时间为10:00─10:30。同时,观测BF对照和高氮样地土壤BTEX通量日变化情况(10:00开始,每隔3小时收集1次)。在通量测定的同时测定气温、5 cm深处土壤温度和湿度。
BTEX分析采用 Entech 7100预浓缩系统和Agilent 7890A/5975型色谱-质谱(GC-MS)联用仪。将Teflon采样袋接入预浓缩系统Entech7100,经三级液氮冷肼,去除样品中的 H2O和 CO2,并经-150 ℃冷聚焦进入GC-MS分离检测。色谱条件:采用HP-5色谱柱(30 m×250 μm×0.25 μm),升温程序为:初始温度40 ℃,保持3 min,后以3 ℃·min-1升到140 ℃;再以 10 ℃·min-1升温至240 ℃,保持3 min;质谱条件:EI电离源,电离电压70 eV,离子源温度270 ℃,数据采集采用单扫模式(SIM)。采用标准质谱图库(NIST08)、标准气体保留时间双重条件定性,采用峰面积-浓度标准曲线内标法进行定量。
CO2采用HP-4890D气相色谱仪(GC)分离,经镍触媒转化器转换后,用氢火焰离子化检测器(FID)进行检测,检测器、分离柱温度分别为220和55 ℃,采用标准气体外标法进行定量。
1.4 通量计算与统计分析
气体通量是指单位时间单位面积箱内该气体的流通量,正值表示土壤作为“源”,即土壤释放该气体,负值表示土壤作为“汇”,即土壤吸收该气体,用公式(1)表示为:

其中,F为气体通量(pmol·m-2·s-1),ΔC为单位时间内气体的体积摩尔浓度差(pmol·m-3),V为静态箱的有效容积(m3),A为土壤面积(m2)。
利用 SPSS20.0进行单因素方差分析(ANOVA),然后以 Duncan多重检验法检验地表BTEX通量在不同林型间和处理间的差异显著性。
2 结果与分析
2.1 自然氮沉降下森林土壤BTEX通量
通过对鼎湖山自然保护区内2种森林70个气体样品进行测定,分析了5种主要BTEX,即苯、甲苯、乙苯、间/对二甲苯和邻二甲苯。因为对照样地未进行任何氮处理,因此其BTEX通量情况基本反映了自然氮沉降下两林地土壤BTEX的“源汇”动态。PF土壤BTEX通量均为负值,而BF土壤BTEX通量则全为正值,说明PF土壤是BTEX的“汇”,吸收BTEX,BF土壤释放BTEX,是BTEX的弱“源”。
PF中,BTEX通量在-70.46~-7.72 pmol·m-2·s-1之间,其中乙苯吸收量(-51.52±10.94) pmol·m-2·s-1最大,约占所测BTEX吸收量的33.82%,间对二甲 苯 (-32.59±14.36) pmol·m-2·s-1和 邻 二 甲 苯(-30.52±11.18) pmol·m-2·s-1次之,分别占21.39%和20.03%。相较之下,BF土壤BTEX通量显著低于PF 土壤(P<0.05),其通量介于 0.93~10.82 pmol·m-2·s-1之间,排放量较高的为甲苯(7.11±0.12) pmol·m-2·s-1和乙苯(6.46±2.52) pmol·m-2·s-1,分别占总排放量的29.59%和22.25%。土壤VOCs来源主要有植物根系、土壤微生物和地表凋落物(Leff和Fierer,2008)。生物因子(如微生物群落组成、微生物生物量等)和非生物因子(如土壤温度、土壤含水量等)均会影响土壤 VOCs的吸收与释放。Asensio等(2007a,2007b)对西班牙刺叶栎苗圃土壤VOCs通量进行研究,发现土壤温度升高会促进土壤VOCs排放,土壤含水量升高则增大土壤VOCs“汇”率;Ramirez等(2010)在美国卡尔霍恩实验林的结果表明,不同微生物释放VOCs的种类和数量各异;Leff和 Fierer(2008)在美国不同生态系统(沙漠,温带森林,高山苔原)实验结果表明,土壤和凋落物种类不同,释放的VOCs也不同。因此,PF和BF对照样地土壤BTEX通量的差异可能是由于两林地凋落物组成、土壤理化性质和微生物群落差异导致。
2.2 外源施氮对森林土壤BTEX通量的影响
施氮处理对土壤BTEX通量影响较大,但影响效果随林分不同而异(表1)。PF低氮处理抑制土壤对BTEX的吸收,中氮处理使土壤发生功能转变,即土壤甲苯和二甲苯通量由“汇”变为“源”(P<0.05)。其原因可能是 PF人为干扰严重(主要是凋落物层和林下层的收割),土壤含氮量较低,对氮仍有一定的需求空间(Mo等,1995,2003),只有当氮浓度达到较高水平时(中氮),才会对土壤BTEX通量产生明显影响。BF中,3种水平氮沉降主要使土壤由BTEX“源”变为“汇”,且低氮和高氮沉降样地土壤BTEX通量与对照样地之间差异达到显著性水平(P<0.05)。可能是由于BF保存完好,长期氮沉降后土壤氮含量相对较高且达到饱和(Mo等,2003),低浓度外源氮就可能打破土壤平衡,影响微生物多样性,从而使土壤源与汇功能发生转变(Fu等,1995;叶万辉等,2008)。

表1 氮沉降对马尾松林和阔叶林土壤苯系物通量的影响Table 1 Impact of nitrogen deposition on soil BTEX flux in PF and BF pmol·m-2·s-1
施氮后PF土壤甲苯与乙苯、间/对二甲苯、邻二甲苯通量显著相关,BF土壤苯与甲苯、间/对二甲苯、邻二甲苯显著相关(P<0.05)(表 2),说明土壤BTEX吸收与释放可能由相似途径产生(如某一类微生物甚至是相同的功能基因控制),导致施氮后其响应一致。已有研究表明,黄杆菌属(Flavobacterium sp.)、假单孢杆菌属(Pseudomonas sp.)和红球菌属(Rhodococcus sp.)可以吸收降解土壤中的 BTEX,将苯和甲苯完全矿化成 CO2和H2O(Jindrova等,2002;周启星和王美娥,2009)。此外,研究发现真菌也可降解BTEX(Nikolova和Nenov,2005)。同时,BTEX也会对微生物群落结构和功能产生影响(Fahy等,2005)。BTEX之间是否由相同功能基因所控制有待进一步研究。
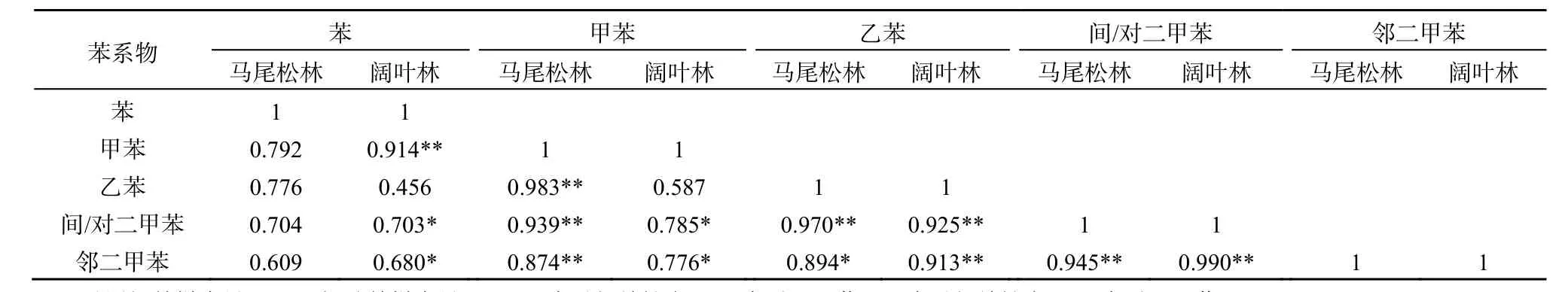
表2 马尾松林和阔叶林施氮样地土壤苯系物相关系数Table 2 Correlation coefficients between each BTEX in PF and BF floor with nitrogen treated
2.3 森林土壤BTEX通量日变化
对照样地土壤 BTEX通量变化在-20.25~17.69 pmol·m-2·s-1之间(图1A),尽管各化合物无明显的日变化规律,但其峰值出现的时间基本一致,最大排放量出现在 7:00,最大吸收量出现在 19:00;高氮样地BTEX通量在-107.83~8.82 pmol·m-2·s-1之间,与前述结果一致:施氮降低了土壤BTEX的释放,或使土壤由源变为汇。高氮样地土壤最大排放也出现在7:00,最大吸收出现在午后(13:00),且此时BTEX吸收通量显著高于其他时间点,夜间(19:00~4:00)BTEX通量变化波动较缓(图1B),可能是由于夜间温度较低,酶活性降低导致土壤BTEX通量变化不明显。土壤中VOCs主要源于微生物活动,土壤BTEX的日变化特征可能与土壤微生物和酶活性有关,但还需要后续深入研究。
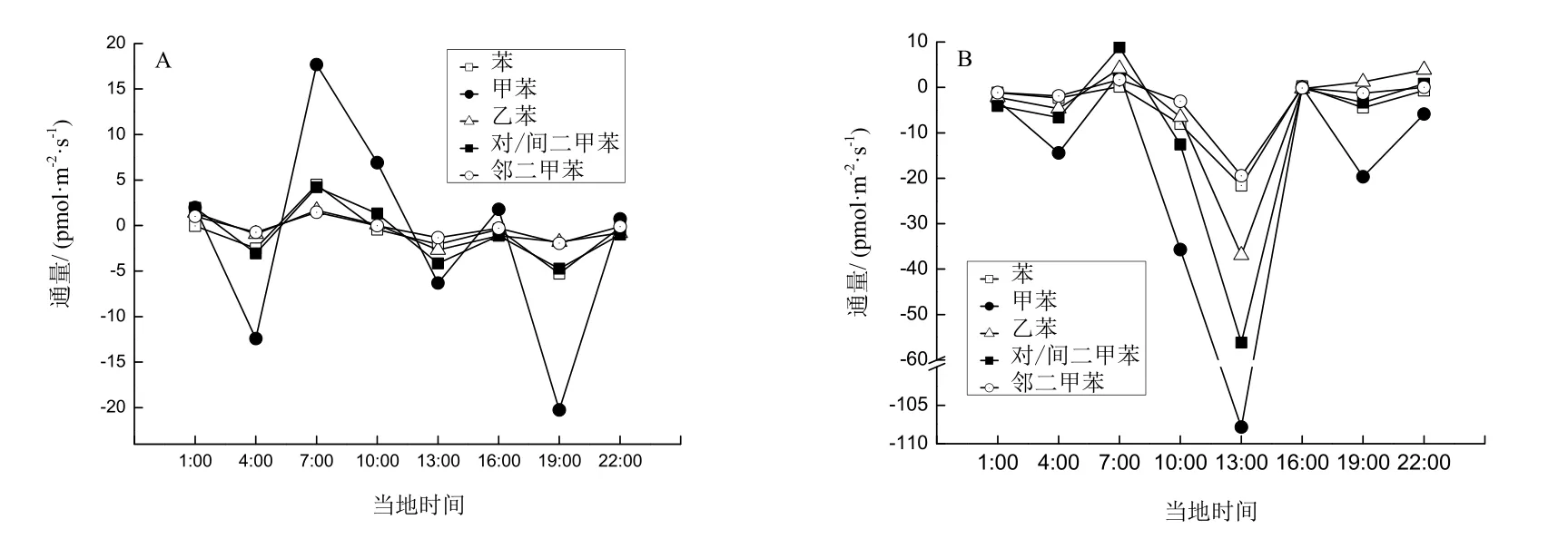
图1 阔叶林对照样地(A)和高氮样地(B)土壤苯系物通量日变化Fig. 1 Diurnal variations of BTEX flux in BF floor without N (A) and with high-N (B) treated
2.4 BTEX通量与CO2通量及土壤温湿度的关系
Wang和Wu(2008)认为CO2水平是影响VOCs通量的一个重要因子。本文土壤CO2通量结果表明,自然氮沉降下,BF土壤CO2释放速率(29.46±3.27) mg·m-2·h-1显著高于 PF土壤(11.02±0.96)mg·m-2·h-1(P<0.05)。森林土壤释放的CO2主要源于:植物根系的自养呼吸、土壤微生物和土壤动物的异养呼吸以及有机质的矿化分解,其中根系呼吸和微生物代谢是主要来源(Singh和Gupta,1977;Steudler等,1991)。根据鼎湖山多年的观测资料(Brown等,1995;Mo等,2003,2007),处于演替顶级阶段的BF,无论土壤微生物生物量、根系生物量、土壤有机碳含量以及凋落物分解速率,均高于PF;此外,BF内气候温暖潮湿,更利于植物根系和微生物的代谢。因此BF土壤CO2通量高于PF。PF和BF土壤CO2释放量对氮沉降的响应基本一致,即所有氮处理样地土壤CO2释放量均高于对照样地CO2释放量(表3)。其中,低氮条件下PF土壤CO2释放量显著高于中氮和对照样地(P<0.05);BF中,施氮对土壤CO2释放的促进作用随氮沉降升高而增强,且中氮和高氮处理样地土壤CO2释放量显著高于对照和低氮处理样地(P<0.05)。前文已经提及,土壤CO2主要来源植物根系和土壤生物呼吸以及有机质的分解,而有效氮水平的增加有利于增加细根生物量、刺激土壤微生物量和活性,加快有机质的分解,从而促进了土壤CO2释放(Mo等,2007;Janssens等,2010)。

表3 氮沉降对马尾松林和阔叶林土壤CO2通量的影响1)Table 3 Impact of nitrogen deposition on soil CO2flux in PF and BF mg·m-2·h-1
相关分析表明,BF对照样地和高氮样地,CO2通量与BTEX通量之间无显著相关性,此与 Gray和 Fierer(2012)研究结果一致,而有报道指出土壤或凋落物释放的VOCs与CO2浓度紧密相关(Leff和 Fierer,2008;Asensio等,2008)。这可能是由于土壤BTEX产生和吸收过程是同时发生的,两者的加和可能使通量较小甚至为零,由此导致BTEX通量与CO2通量之间无明显相关性。本研究也未发现土壤BTEX通量与土壤温度呈显著相关。此结果与Asensio等(2008)报道不一致,其研究结果表明土壤VOCs排放随土壤温度升高而增大。这可能是由于本研究中土壤温度变化幅度较小(1 ℃以内),使土壤温度对BTEX通量的影响不明显;土壤BTEX通量与大气温度之间也无显著相关性,可能是采集气样时,土壤被静态箱罩住导致BTEX通量受外界气温影响较弱。BF对照样地土壤邻二甲苯通量(图2A)、高氮样地土壤乙苯通量(图2B)分别与土壤体积含水率呈线性相关,其相关方程分别为:y=31.57x-3.23(r=0.71,P<0.05)和y=632.69x-57.38(r=0.72,P<0.05),说明邻二甲苯和乙苯通量受土壤含水率的影响。
3 结论
施氮抑制了PF土壤对BTEX的吸收,且抑制效果随施氮水平的升高而明显,中氮甚至使PF土壤功能发生转变,即由“汇”变为“源”;低氮输入使BF土壤发生功能转变,即由“源”变为“汇”。不同林型间差异可能是由于BF保存完好,长期氮沉降后土壤氮含量已达到饱和,低氮输入便使土壤做出明显响应;PF由于人为扰动,土壤氮含量有限,只有达到一定氮水平后土壤才会做出明显响应。森林土壤是陆地生态系统重要碳库,而土壤VOCs通量在碳循环中占一定的比例(Gray和Fierer,2012),不断加剧的全球氮沉降会对土壤VOCs源汇功能产生影响,进而可能影响森林生态系统碳循环。因此,在估算氮沉降对森林碳氮循环的影响时,需要将氮沉降作为环境因子,考虑不同林型VOCs通量对氮沉降的响应。
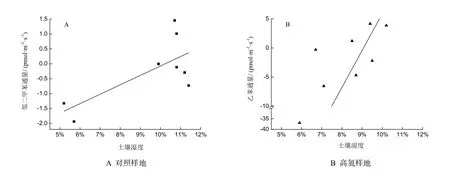
图2 土壤苯系物通量与土壤含水率的关系Fig. 2 The correlations between BTEX flux and soil water content
土壤BTEX通量无明显日变化规律,说明部分VOCs通量存在较大的时空变异性,这也为野外研究工作开展增添难度。土壤部分BTEX通量受土壤含水率影响,与土壤温度、大气温度或CO2浓度单独不显著相关。一方面可能是由于本研究采样次数有限,无较大温度波动,另一方面可能存在其他影响BTEX通量的因子。土壤BTEX通量日变化和其影响因素不确定性较大,在未来研究中,还需通过探寻森林土壤VOCs与土壤微生物及土壤酶的相互关系,进而深入了解氮沉降对森林土壤VOCs通量的影响机理。
ASENSIO D, PENUELAS J, FILELLA I, et al. 2007a. On-line screening of soil VOCs exchange responses to moisture, temperature and root presence [J]. Plant and Soil, 291(1/2): 249-261.
ASENSIO D, PENUELAS J, PRIETO P, et al. 2008. Interannual and seasonal changes in the soil exchange rates of monoterpenes and other VOCs in a Mediterranean shrubland [J]. European Journal of Soil Science, 59(5): 878-891.
ASENSIO D, PENUELAS J, OGAYA R, et al. 2007b. Seasonal soil VOC exchange rates in a Mediterranean holm oak forest and their responses to drought conditions [J]. Atmospheric Environment, 41(11): 2456-2466.
ATKINSON R. 2000. Atmospheric chemistry of VOCs and NOx [J]. Atmospheric environment, 34(12): 2063-2101.
BROWN S, LENART M, MO J, et al. 1995. Structure and organic matter dynamics of a human-impacted pine forest in a MAB reserve of subtropical China [J]. Biotropica: 276-289.
ESTEVE F, ARMENTA S, GARRIGUES S, et al. 2007. Headspace–mass spectrometry determination of benzene, toluene and the mixture of ethylbenzene and xylene isomers in soil samples using chemometrics [J]. Analytica chimica acta, 587(1): 89-96.
EZQUERRO O, ORTIZ G, PONS B, et al. 2004. Determination of benzene, toluene, ethylbenzene and xylenes in soils by multiple headspace solid-phase microextraction [J]. Journal of chromatography A, 1035(1): 17-22.
FAHY A, LETHBRIDGE G, EARLE R, et al. 2005. Effects of long-term benzene pollution on bacterial diversity and community structure in groundwater [J]. Environmental microbiology, 7(8): 1192-1199.
FU S, YI W, DING M. 1995. Mineralization of soil microbial C, N, P and K in different vegetation types at Dinghushan Biosphere Reserve [J]. Acta Phytoecologica Sinica, 19(3): 217-224.
GALLOWAY J N, DENTENER F J, CAPONE D G, et al. 2004. Nitrogen cycles: past, present, and future [J]. Biogeochemistry, 70(2): 153-226.
GRAY C M, FIERER N. 2012. Impacts of nitrogen fertilization on volatile organic compound emissions from decomposing plant litter [J]. Global Change Biology, 18(2): 739-748.
HEIDEN A, KOBEL K, KOMENDA M, et al. 1999. Toluene emissions from plants [J]. Geophysical Research Letters, 26(9): 1283-1286.
HOEGBERG P, FAN H, QUIST M, et al. 2006. Tree growth and soil acidification in response to 30 years of experimental nitrogen loading on boreal forest [J]. Global Change Biology, 12(3): 489-499.
HUANG W, ZHANG D, LI Y, et al. 2012. Responses of soil acid phosphomonoesterase activity to simulated nitrogen deposition in three forests of subtropical China [J]. Pedosphere, 22(5): 698-706.
JANSSENS I, DIELEMAN W, LUYSSAERT S, et al. 2010. Reduction of forest soil respiration in response to nitrogen deposition [J]. Nature Geoscience, 3(5): 315-322.
JINDROVA E, CHOCOVA M, DEMNEROVA K, et al. 2002. Bacterial aerobic degradation of benzene, toluene, ethylbenzene and xylene [J]. Folia microbiologica, 47(2): 83-93.
KESSELMEIER J, KUHN U, WOLF A, et al. 2000. Atmospheric volatile organic compounds (VOC) at a remote tropical forest site in central Amazonia [J]. Atmospheric Environment, 34(24): 4063-4072.
KLIMONT Z, COFALA J, XING J, et al. 2009. Projections of SO2, NOxand carbonaceous aerosols emissions in Asia [J]. Tellus B, 61(4): 602-617.
LEFF J W, FIERER N. 2008. Volatile organic compound (VOC) emissionsfrom soil and litter samples [J]. Soil Biology and Biochemistry, 40(7): 1629-1636.
MAGILL A H, ABER J D, CURRIE W S, et al. 2004. Ecosystem response to 15 years of chronic nitrogen additions at the Harvard Forest LTER, Massachusetts, USA [J]. Forest Ecology and Management, 196(1): 7-28.
MO J, BROWN S, LENART M, et al. 1995. Nutrient dynamics of a human-impacted pine forest in a MAB Reserve of subtropical China [J]. Biotropica: 290-304.
MO J, BROWN S, PENG S, et al. 2003. Nitrogen availability in disturbed, rehabilitated and mature forests of tropical China [J]. Forest Ecology and Management, 175(1): 573-583.
MO J, ZHANG W, ZHU W, et al. 2007. Response of soil respiration to simulated N deposition in a disturbed and a rehabilitated tropical forest in southern China [J]. Plant and soil, 296(1/2): 125-135.
NIKOLOVA N, NENOV V. 2005. BTEX degradation by fungi [J]. Water Science & Technology, 51(11): 87-93.
RAMIREZ K S, LAUBER C L and FIERER N. 2010. Microbial consumption and production of volatile organic compounds at the soil-litter interface [J]. Biogeochemistry, 99(1/3): 97-107.
SINGH J, GUPTA S. 1977. Plant decomposition and soil respiration in terrestrial ecosystems [J]. The Botanical Review, 43(4): 449-528.
STEUDLER P, MELILLO J, BOWDEN R., et al. 1991. The effects of natural and human disturbances on soil nitrogen dynamics and trace gas fluxes in a Puerto Rican wet forest [J]. Biotropica: 356-363.
VITOUSEK P M, ABER J D, HOWARTH R W, et al. 1997. Human alteration of the global nitrogen cycle: sources and consequences [J]. Ecological applications, 7(3): 737-750.
WANG X, WU T. 2008. Release of isoprene and monoterpenes during the aerobic decomposition of orange wastes from laboratory incubation experiments [J]. Environmental science & technology, 42(9): 3265-3270.
WHITE M, RUSSO R, ZHOU Y, et al. 2009. Are biogenic emissions a significant source of summertime atmospheric toluene in the rural Northeastern United States? [J]. Atmospheric Chemistry and Physics, 9(1): 81-92.
ZHANG W, MO J, YU G, et al. 2008. Emissions of nitrous oxide from three tropical forests in Southern China in response to simulated nitrogen deposition [J]. Plant and Soil, 306(1/2): 221-236.
蔡玉婷, 黄永芳, 张太平, 等. 2013. 模拟氮沉降对木荷人工幼林地土壤氮素、碳素和微生物量垂直分布的影响[J]. 生态环境学报, 22(5): 755-760.
方华, 莫江明. 2006. 氮沉降对森林凋落物分解的影响[J]. 生态学报, 26(9): 3127-3136.
刘效东, 周国逸, 陈修治, 等. 2014. 南亚热带森林演替过程中小气候的改变及对气候变化的响应[J]. 生态学报, 34(10): 2755-2764.
鲁炳闻, 韩春媚, 周友亚, 等. 2010. 土壤中苯系物的顶空气相色谱-质谱联用测定方法研究[J]. 农业环境科学学报, 29(4): 812-816.
叶万辉, 曹洪麟, 黄忠良, 等. 2008. 鼎湖山南亚热带常绿阔叶林 20公顷样地群落特征研究[J]. 植物生态学报, 32(2): 274-286.
周启星, 王美娥. 2009. BTEX在土壤中的环境行为研究进展[J]. 生态学杂志, 28(8): 1647-1654.
Responses of Soil BTEX Fluxes to Simulated Nitrogen Deposition in Two Dominated Forests of Dinghushan, China
ZHENG Lili, GUO Pingping, YI Zhigang*
College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China
BTEX are known as a type of volatile organic compounds (VOCs), which involve in atmospheric photochemical process and pose threats to human health and environment. Soil can act as both source and sink for BTEX. Increasing nitrogen deposition may influence soil ecological processes leading to changes in soil BTEX fluxes. Although nitrogen deposition has received much attention, the research on soil BTEX fluxes impacted by nitrogen deposition is still scarce. In this study, employing the static-chamber coupled with preconcentrator-GC-MS techniques, the responses of soil BTEX fluxes to simulated elevated nitrogen deposition were studied in two dominated forests, namely, pine forest (PF) and monsoon evergreen broadleaf forest (BF) in Dinghushan. The results showed that PF soil acted as sink for BTEX in the controlled sites, with the maximum uptake rate of (-51.52±10.94) pmol·m-2·s-1for ethyl benzene. BTEX uptake rates decreased with low nitrogen additions and the soil function changed from “sink” to “source” with medium nitrogen additions in PF. In BF, meanwhile, soil acted as source for BTEX in controlled sites, with the maximum emission rate of (7.11±0.12) pmol·m-2·s-1for toluene. BTEX emission rates decreased, or the soil changed the function from “source” to “sink” after the nitrogen additions in BF, with the significant difference in low and high nitrogen addition sites from those in controlled sites. In addition, significantly high correlation coefficients were observed between toluene and ethyl benzene, xylene in PF soil as well as between benzene and toluene, xylene in BF soil with nitrogen treated. On the basis of measurements every 3 h each day for controlled and high nitrogen addition sites in BF, no clear diurnal variations were found for BTEX fluxes. The highest emission rates appeared at 7:00 in both sites and the highest uptake rates appeared at 19:00 and 13:00 in the controlled site and high nitrogen addition site, respectively. Soil CO2emission rates (29.46±3.27) mg·m-2·h-1in BF were significantly higher than those in PF in controlled sites (11.02±0.96) mg·m-2·h-1, and the rates in all the nitrogen addition sites increased compared with those in the controlled sites in both forests. Soil BTEX fluxes showed no significant correlation with soil temperature, air temperature or CO2emission rates, but o-xylene and ethyl benzene fluxes showed significant correlation with soil water content.
nitrogen deposition; BTEX; VOCs; flux; pine forest; monsoon evergreen broadleaf forest
10.16258/j.cnki.1674-5906.2015.03.005
X171.1
A
1674-5906(2015)03-0396-06
郑丽丽,郭萍萍,易志刚. 鼎湖山典型森林土壤苯系物通量对模拟氮沉降的响应[J]. 生态环境学报, 2015, 24(3): 396-401.
ZHENG Lili, GUO Pingping, YI Zhigang. Responses of Soil BTEX Fluxes to Simulated Nitrogen Deposition in Two Dominated Forests of Dinghushan, China [J]. Ecology and Environmental Sciences, 2015, 24(3): 396-401.
国家自然科学基金项目(41473083;41173090)
郑丽丽(1990年生),女,硕士研究生,研究方向为环境生态学;E-mail: kimberly_211@163.com *通讯作者:易志刚(1973年生),男,副教授,博士。E-mail: zgyi@fafu.edu.cn
2015-01-19
