Fe2O3纳米粒子的配位聚合物固相热解制备及其储锂性能
2015-12-05戚丹丹江大光秦德才张校刚南京航空航天大学材料科学与技术学院江苏省能量转换材料与技术重点实验室南京210016
戚丹丹 张 防 江大光 秦德才 张校刚(南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京 210016)
Fe2O3纳米粒子的配位聚合物固相热解制备及其储锂性能
戚丹丹张防*江大光秦德才张校刚
(南京航空航天大学材料科学与技术学院,江苏省能量转换材料与技术重点实验室,南京210016)
以1,4-苯二甲酸为配体,FeCl3为金属盐,采用溶剂热法合成了苯二甲酸-铁配位聚合物晶体。以其为前驱体,通过固相热解制备了尺寸均一的α-Fe2O3纳米粒子。利用XRD、FT-IR、SEM及TEM等手段对配位聚合物及其热解产物进行了表征。将α-Fe2O3纳米粒子用作锂离子电池负极材料,电化学测试结果表明:在0.1 A·g-1电流密度下充放电50次后,材料的可逆比容量仍保持在530 mAh·g-1,表现出较高的比容量和优异的循环稳定性。
α-Fe2O3;配位聚合物;固相热解;锂离子电池
0 引 言
近十几年来,铁氧化物如Fe2O3、Fe3O4等材料以其独特的物理化学性质以及在磁性[1-2]、催化[3-4]及电化学[5-6]等领域的潜在应用引起研究者的广泛关注。其中,α-Fe2O3作为常温下最稳定的铁氧化物,具有资源丰富,环境友好,高抗腐蚀性等特点,可应用于颜料、气敏元件及催化剂等领域[7-9]。此外,有研究表明α-Fe2O3是潜在的锂离子电池负极材料[10-12]。作为一类通过可逆转换反应实现电化学储锂的电极材料,其相对于商业石墨(372 mAh·g-1)具有更高的比容量。然而,有研究表明[13-14],当Fe2O3颗粒粒径较大时,在电化学充放电过程中存在不可逆的晶体相转变,导致其循环性能差,极大限制了其广泛应用。
大量研究发现,α-Fe2O3材料的微观结构,如晶体颗粒的尺寸大小、均匀性和微观形貌对其电化学性能有重要影响[15-16]。为了提高和改善Fe2O3的电化学性能,研究者采用溶剂热法[17-18]、模板法[19-20]及刻蚀法[21]等方法制备了不同形貌和结构的α-Fe2O3电极材料,并研究了其电化学性能。近来,以过渡金属配位聚合物为前驱体,利用固相或液相热解制备过渡金属氧化物微纳米材料的方法,由于具有操作简单、形貌可控及成本低等特点引起研究者的极大关注[22-24]。例如,Ogal等通过选择MOF-177为前驱体,经固相热解制备了CuO纳米颗粒[25],其在100 mA· g-1电流密度下循环40圈仍可保持538 mAh·g-1的可逆比容量;Cho等利用MIL-88的固相热解制备了纺锤型的纳米α-Fe2O3[26],其在200 mA·g-1电流密度下循环50圈后可逆比容量仍保持911 mAh·g-1。我们课题组前期通过选择合适的配位聚合物作为前驱体,利用液相热解的方法成功制备了六方形Co3O4纳米片[27]和多面体Mn3O4纳米晶[28]。电化学测试表明,材料展现出了优异的电化学性能。
本文研究了金属铁的苯二甲酸配位聚合物在空气中的热分解反应。首先,以对苯二甲酸(p-H2bdc)为配体,采用溶剂热法合成了苯二甲酸-铁(Fe-BDC)配位聚合物。然后,以其为前驱体,通过将其在空气中固相高温热解制备了尺寸均一的α-Fe2O3纳米粒子。将其用作锂离子电池负极材料,利用电化学测试研究了其电化学储锂性能。结果表明,利用该方法制备的α-Fe2O3纳米材料表现出较高的电化学可逆容量和优异的循环稳定性。该方法具有简单易操作、可复制、成本低等特点,具备潜在应用价值。
1 实验部分
1.1试剂与仪器
六水合氯化铁(FeCl3·6H2O)(化学纯,南京化学试剂有限公司),1,4-苯二甲酸(p-H2bdc)(分析纯,中国医药上海化学试剂公司),N,N-二甲基甲酰胺 (分析纯,国药集团化学试剂有限公司),无水乙醇(分析纯,南京化学试剂有限公司),乙炔黑(电池级,杉杉科技有限公司),N-甲基吡咯烷酮 (NMP)(化学纯,国药集团化学试剂有限公司),聚偏氟乙烯(PVDF) (SIMGA-ALORICH公司),电解液:1 mol·L-1LiPF6的EC/DMC(EC和DMC的体积比为1∶1)(张家港市国泰华荣化工新材料有限公司)。
X-射线衍射 (XRD)分析采用德国Bruker D8 advance X射线衍射仪(Cu Kα,λ=0.154 18 nm,管电压40 kV,扫描范围5°~80°);傅里叶变换红外光谱(FT-IR)测试采用美国Nicolet 750傅里叶变换红外光谱仪,扫描波数范围400~4 000 cm-1;热重分析(TG)采用瑞士TGA/SDTA851e热分析仪测定,升温速率为10℃·min-1;SEM和TEM表征分别采用德国LEO-1550场发射扫描电子显微镜和美国FEI TECNAI-20透射电子显微镜。
1.2材料制备
1.2.1Fe-BDC配位聚合物的合成
分别称取1 mmol FeCl3·6H2O(0.270 1 g)和1 mmol 1,4-苯二甲酸(0.166 1 g)溶于装有10 mL H2O和5 mL DMF的混合溶剂中,室温下磁力搅拌30 min。然后将其转入带有聚四氟乙烯内衬的30 mL不锈钢高压反应釜中密封,并置于180℃烘箱内反应12 h。反应结束后,将反应釜自然冷却至室温。反应液经过滤后可得到红褐色沉淀物,并将其用DMF和蒸馏水各洗涤3次,然后将其置于真空干燥箱内60℃干燥24 h。
1.2.2α-Fe2O3纳米粒子的制备
将干燥后的Fe-BDC样品转移至陶瓷磁舟内,并将其置于管式炉的中间位置,管式炉两端开口通向空气。设置管式炉以5℃·min-1的升温速率升至450℃,并在此温度下保温2 h。自然冷却后,得到红褐色粉末α-Fe2O3。
1.3电极片的制备及电化学性能测试
将活性材料α-Fe2O3、导电剂乙炔黑、粘结剂聚偏氟乙烯(PVDF)按照6∶3∶1的质量比溶解在适量的N-甲基-吡咯烷酮(NMP)中。混合成糊状后,将浆料均匀地涂在事先准备好的铜箔上,置于真空干燥箱110℃下干燥12 h后称重(电极片上约含0.9 mg α-Fe2O3活性材料)。将其作为模拟电池的正极,锂片作为负极,聚丙烯微孔膜Celgard 2400为隔膜,电解液采用1 mol·L-1LiPF6(EC∶DMC体积比为1∶1),在充满氩气的手套箱中组装成CR2016型扣式电池。电池的恒流充放电和循环寿命测试在 Land CT2001A电池测试系统(武汉金诺电子有限公司)上进行。循环伏安(CV)测试在CHI 660C电化学工作站(上海辰华仪器有限公司)上完成,电压测试范围0.01~3 V,扫描速率0.3 mV·s-1。
2 结果与讨论
2.1Fe-BDC晶体的物性表征
为了考察Fe-BDC晶体中对苯二甲酸根与铁离子的配位方式,我们将Fe-BDC晶体与配体p-H2bdc的红外光谱进行了对比,结果如图1所示。图1(a)中位于1 715和1 411 cm-1处的特征峰可归属于配体中C=O和O-H的伸缩振动,位于1 614和1 560 cm-1处的弱吸收峰则对应苯环上C=C的伸缩振动[29]。而图1(b)中1 715 cm-1处羧酸的特征吸收峰消失,表明羧基与铁离子进行了配位。且在1 671和1 425 cm-1处出现了新吸收峰,分别归属于羧酸根的非对称和对称伸缩振动,此结果表明Fe-BDC晶体具有聚合物结构[30]。另外,对苯二甲酸的配位方式可根据羧酸根的2个特征吸收峰的波数差值(Δν)来判断[31]。如Δν>200 cm-1为单齿配位,Δν<200 cm-1为双齿配位。由图1(b)可知,羧酸根的2个特征吸收峰(1 671和1 425 cm-1)的Δν>200 cm-1,由此可判断对苯二甲酸与铁离子采用单齿方式配位。
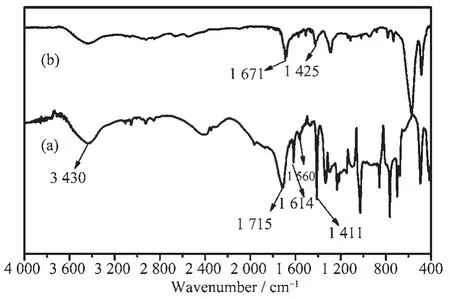
图1 配体p-H2bdc(a)及Fe-BDC晶体(b)的红外光谱Fig.1 FT-IR spectra of p-H2bdc ligand(a)and as-synthesized Fe-BDC(b)
为了确定Fe-BDC晶体的热分解温度和失重过程,我们对其进行了热重分析,结果如图2所示。由图可知,样品在低于250℃时未出现明显的失重过程,表明配合物分子中不包含配位或游离的结晶水分子。当温度高于250℃时,样品开始分解,并出现明显的失重过程,对应着配合物中金属-有机骨架的分解。当温度高于400℃时,此失重过程结束,表明样品完全分解为Fe2O3。根据以上的分析结果,结合实验合成中金属盐与配体的反应物质的量之比为1∶1以及材料电中性的假设,我们初步推测所合成的Fe-BDC配位聚合物的分子式为[Fe(BDC)]n,因为按照该分子式计算出配合物的失重百分比为27%,与实验测得的数值(26.2%)非常接近。

图2 Fe-BDC晶体的热重曲线Fig.2 TG curve of as-synthesized Fe-BDC
为了研究合成的Fe-BDC的晶体结构,我们对此晶体做了粉末XRD表征,结果如图3所示。Fe-BDC晶体的XRD图中尖锐而强的衍射峰表明了其良好的结晶性。

图3Fe-BDC晶体的XRD图Fig.3 XRD pattern of as-synthesized Fe-BDC
2.2α-Fe2O3纳米粒子的物性表征
根据热重分析结果,为保证样品完全分解为Fe2O3,将热解实验温度确定为450℃,并在此温度下保温2 h。为了考察热解产物的晶体结构,对其做了XRD表征,并与标准图对照,结果见图4。由图可知,其特征衍射峰归属于六方晶系的α-Fe2O3(JCPDS No.33-0664,晶胞参数 a=0.503 6 nm,c=1.374 9 nm),尖锐而强的衍射峰表明了热解产物的结晶性良好。图中未出现其他杂质衍射峰,表明热解产物为纯的α-Fe2O3。
为研究热解产物α-Fe2O3的微观形貌,分别对其做了SEM和TEM表征。图5(a)为α-Fe2O3的SEM照片,从图中可知,α-Fe2O3由球形的纳米粒子组成,且粒子尺寸较均一。图5(b)为α-Fe2O3的TEM照片,由图可见α-Fe2O3为尺寸均一的纳米粒子,这与SEM的结果一致,放大照片显示纳米粒子直径大约在40~80 nm之间(图5(c))。由于热解过程中未添加任何分散剂,因此α-Fe2O3纳米粒子出现了一定程度的团聚(图5(a,b,c))。EDS分析(图5(d))表明纳米粒子由Fe和O 2种元素组成(Au、Si和C来自于测试所用的导电胶和硅片),此结果进一步表明该纳米粒子为Fe2O3,与XRD的分析结果一致。

图4 热解产物的XRD图Fig.4 XRD pattern of thermolysis products
2.3α-Fe2O3电极的电化学测试与分析
为了研究α-Fe2O3电极在充放电过程中的电化学反应,我们首先对其进行了循环伏安(CV)测试,测试电压区间为0.01~3 V,扫描速度为0.3 mV·s-1,结果如图6(a)所示。第一次阴极电流扫描时,在1.58 V出现一个弱峰,对应着Li+在Fe2O3晶格中的嵌入[32];接着在0.67 V左右出现一个强还原峰,对应的电化学反应是Fe2O3被还原为金属Fe0以及无定形Li2O的生成[33]。第一次阳极电流扫描时,在1.69~1.89 V范围内出现一个宽化的氧化峰,对应的电化学反应是Fe0氧化为Fe3+的过程,同时伴随着Li2O的分解。在随后的扫描过程中还原峰逐渐偏移到了0.76 V,而氧化峰的位置未发生明显的偏移。CV曲线良好的重现性表明Fe2O3电极的储锂反应有着非常好的可逆性。根据CV的测试结果,Fe2O3电极总的电化学反应可表示如下:
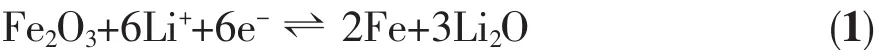
图6(b)为α-Fe2O3电极在0.1 A·g-1电流密度下的前3次充放电曲线。从图中可以看出,首次放电曲线在电压为0.87和1.1 V处出现了2个放电平台,这与CV曲线中2个还原峰的出现位置一致。在1.1 V左右出现的较短平台,对应的是Li+嵌入Fe2O3晶体结构中[34];0.87 V处出现的较长的放电平台,对应的是Li+与Fe2O3反应生成Li2O和Fe。根据充放电测试的结果,纳米Fe2O3电极的首次放电比容量和充电比容量分别为1 112.2和717.4 mAh·g-1,不可逆容量损失为334.8 mAh·g-1。首次不可逆容量损失较大是转化反应电极材料普遍存在的问题。根据文献[35-36],较大的首次不可逆容量损失主要源于首次放电时SEI膜的形成和电解液的分解会造成一部分Li+的不可逆损失。从第二次循环开始,充放电曲线的充放电平台趋于平稳,曲线形状基本未发生变化,且容量衰减缓慢,说明Fe2O3电极的充放电反应具有良好的充放电稳定性和可逆性。

图6 Fe2O3电极的电化学性能图(a)在0.3 mV·s-1扫速下的前3次循环伏安曲线;(b)在0.1 A·g-1电流密度下的前3次恒流充放电曲线;(c)在0.1 A·g-1电流密度下的循环寿命图;(d)在不同电流密度下的循环性能图Fig.6 Electrochemical properties of Fe2O3electrode(a)CV curves of the initial three cycles at a scan rate of 0.3 mV·s-1; (b)Initial three charge-discharge curves at a current density of 0.1 A·g-1;(c)Cycling performance at a current density of 0.1 A·g-1;(d)Cycling performance at different current densities
循环寿命和倍率性能是评价锂离子电池电极材料性能的重要参数,为此我们分别考察了α-Fe2O3电极在0.1 A·g-1电流密度下连续充放电50次的循环稳定性和在不同电流密度下的倍率性能,结果如图6(c)和6(d)所示。从图6(c)中可以看出,Fe2O3电极在前五次的充放电循环中,其比容量出现了一定程度的衰减,但在随后的充放电循环中,其比容量衰减趋缓慢。大于95%的库伦效率表明材料的充放电反应可逆性较高。电极在循环50次之后,材料的可逆比容量仍高达530 mAh·g-1,且未出现明显的衰减,表明纳米α-Fe2O3电极具有优异的循环稳定性。同样测试条件下,该结果优于其他方法制备的纳米Fe2O3电极[37-39]。较高的可逆比容量和优异的循环稳定性可归因于材料良好的结晶性以及其较小的纳米颗粒尺寸[40-41]。图6(d)为Fe2O3电极在不同电流密度下的循环性能。从图中可以看出,当电流密度分别为0.1、0.2、0.5和1 A·g-1时,电极的可逆比容量分别为690.4、632.6、534.3和335.3 mAh·g-1。随着电流密度的增大,Fe2O3电极比容量逐渐衰减,这是因为Fe2O3材料的电子导电性不好,当在大电流密度下进行充放电时,电极表面会出现一定程度的粉化,使得参加电化学反应的活性物质减少[42]。当电流密度从1 A·g-1减小到0.2 A·g-1时,可逆比容量又可从335.3 mAh·g-1恢复到606.7 mAh·g-1。此结果表明Fe2O3电极具有良好的倍率性能,这主要归功于Fe2O3材料的纳米结构,球形的纳米颗粒增大了电极与电解液的接触面积,且其较小的颗粒尺寸可有效缩短Li+的传输距离,有利于Li+的快速传输。
3 结 论
采用溶剂热法合成了苯二甲酸-铁配位聚合物,通过将其高温固相热解制备了尺寸均一的球形α-Fe2O3纳米材料。将其用作锂离子电池的负极材料,Fe2O3电极在0.1 A·g-1电流密度下充放电50次后仍可保持530 mAh·g-1的可逆比容量,表现出优异的循环稳定性和较高的可逆比容量。更重要的是,该方法具有制备过程简单、可大量合成等优点,可适用于制备其他具有特定形貌和结构的过渡金属氧化物纳米材料。
[1]GUO Wei(郭巍),WU Hang(吴行),ZHENG Zhen-Zhong(郑振忠),et al.Electronic Components and Materials(电子元件与材料),2010,12:31-33
[2]Xu J S,Zhu Y J,Chen F.J.Solid State Chem.,2013,199:204-211
[3]Lai L,Huang G,Wang X,et al.Carbon,2011,49:1581-1587
[4]Zeng Y,Yao J,Li D,et al.ACS Appl.Mater.Interfaces, 2011,3(1):35-42
[5]Poizot P,Laruelle S,Grugeon S.Nature,2000,407:496-499
[6]Deng H,Long D,Liu X,et al.J.Power Sources,2011,196 (5):3887-3893
[7]GU Bao-Xia(顾晓霞),DIAO Xun-Gang(刁训刚),HAO Lei (郝雷).Aerospace Materials and Technology(宇航材料工艺), 2008,3:58-62
[8]WANG Zhong-Chun(王忠春),LIU Er-Sheng(刘尔生),CHEN Nai-Sheng(陈耐生),et al.Chinese J.Struc.Chem.(结构化学),1996,15(6):450-453
[9]Niu M T,Huang F,Cui L F,et al.ACS Nano,2010,4(2): 681-688
[10]ZHANG Ying(张颖),GAO Xue-Ping(高学平),HU Heng(胡恒),et al.Chinese J.Inorg.Chem.(无机化学学报),2004,20 (9):1013-1017
[11]Chen J,Xu L,Yu T,et al.Adv.Mater.,2005,17:582-587
[12]Zhu X J,Zhu Y W,Murali S,et al.ACS Nano,2011,5(4): 3333-3338
[13]Okada J,Yamaki I.J.Ind.Eng.Chem.,2004,10:1104-1113
[14]ZHAO Tie-Peng(赵铁鹏),GAO De-Shu(高德淑),LEI Gang-Tie(雷钢铁),et al.Acta Chim.Sinica(化学学报),2009,67 (17):1957-1961
[15]Xu X,Cao R,Chao J,et al.Nano Lett.,2012,12:4988-4991
[16]Zhang L,Wu H B,Lou X W.CrystEngComm,2013,15:9332 -9335
[17]Wang B,Chen J S,Lou X W.J.Mater.Chem.,2012,22: 9466-9468
[18]Jia X,Chen J J,Xu J H,et al.Chem.Commun.,2012,48: 7410-7412
[19]Wang Z,Luan D,Madhavi S,et al.Chem.Commun.,2011, 47:8061-8063
[20]Kang N,Park J H,Choi J,et al.Angew.Chem.Int.Ed., 2012,51:6626-6632
[21]Zhu T,Yang X H,Yang H G,et al.J.Am.Chem.Soc., 2010,132:13162-13168
[22]Li C C,Chen L B,Wang T H,et al.Chem.Eur.J.,2010,16: 5215-5221
[23]Jiang H L,Xu Q.Chem.Commun.,2011,47(12):3351-3370
[24]Morsali A,Masoomi M Y.Coord.Chem.Rev.,2012,256: 2921-2943
[25]Abhik B,Upendra S,Madhavi S,et al.Nano Energy,2013, 2(6):1158-1163
[26]Xu X D,Cao R G,Cho J,et al.Nano Lett.,2012,12:4988-4991
[27]ZHANG Fang(张防),HAO Liang(郝亮),ZHANG Xiao-Gang (张校刚),et al.Chinese J.Inorg.Chem.(无机化学学报), 2010,26(5):827-831
[28]Zhang F,Hao L,Zhang X G.Mater.Chem.Phys.,2011,126: 853-858
[29]Arenas J F,Marcos J I.Spectrochim.Acta,Part A,1980,36 (12):1075-1081
[30]Baca S G,Gherco O A,Gdaniec M,et al.Inorg.Chim.Acta, 2004,357(12):3419-3429
[31]Nakamoto K,Translated by HUANG De-Ru(黄德如),WANG Ren-Qing(汪仁庆).Infrared and Raman Spectra of Inorganic and Coordination Compounds.3rd Ed.(无机和配位化合物的红外和拉曼光谱.3版).Beijing:Chemical Industry Press, 1986.
[32]Banerjee A,Bhatnagar S,Ogale S,et al.Nano Energy,2013, 2(5):890-896
[33]Aravindan V,Gnanaraj J,Liu H K,et al.Chem.Eur.J., 2011,17:14326-14346
[34]Park C M,Kim J H,Sohn H J,et al.Chem.Soc.Rev., 2010,39:3115-3141
[35]Geissler W,Schmidt M,Aurbach D,et al.Electrochem. Commun.,2003,5:946-951
[36]Wang Z,Luan D,Hu Y,et al.Energy Environ.Sci.,2012,5: 5252-5258
[37]Reddy M V,Yu T,Shen Z X,et al.Adv.Funct.Mater., 2007,17:2792-2796
[38]Wu X L,Guo Y G,Wan L J,et al.J.Phys.Chem.C,2008, 112:16824-16829
[39]Wang B,Chen J S,Wu H B,et al.J.Chem.Soc.,2011,133: 17146-17148
[40]Chen J S,Zhu T,Yang X H,et al.J.Chem.Soc.,2010,132: 13162-13167
[41]Kim H S,Piao Y,Kang S H,et al.Electrochem.Commun., 2010,12:382-386
[42]Zaghib K,Goodenough J B,Mauger A,et al.J.Power Sources, 2009,194:1021-1023
Fe2O3Nanoparticles Prepared by Solid-State Thermolysis of Fe-Based Coordination Polymer and Their Enhanced Lithium Storage Properties
QI Dan-DanZHANG Fang*JIANG Da-GuangQIN De-CaiZHANG Xiao-Gang
(College of Material Science and Engineering,Nanjing University of Aeronautics and Astronautics, Jiangsu Key Laboratory of Materials and Technology for Energy Conversion,Nanjing 210016,China)
α-Fe2O3nanoparticles with uniform size were synthesized via a complex-precursor strategy.First,iron ion-based coordination polymer was synthesized via a solvothermal method by using p-benzene-dicarboxylic acid (p-H2bdc)as ligand.Second,α-Fe2O3nanoparticles with uniform size were prepared via a solid state pyrolysis procedure.The synthesized coordination polymer and Fe2O3product were characterized by XRD,FT-IR,SEM and TEM respectively.When used as anode material for lithium-ion batteries,the Fe2O3electrode can deliever a stable reversible capacity of 530 mAh·g-1after 50 charge-discharge cycles at a current density of 0.1 A·g-1, which showed a higher specific capacity and superior cycle stability.
α-Fe2O3;coordination polymer;solid-state thermolysis;lithium-ion battery
O614.81+1;TQ152
A
1001-4861(2015)06-1171-06
10.11862/CJIC.2015.159
2015-01-20。收修改稿日期:2015-03-07。
江苏省自然科学基金(No.BK2011740),江苏高校优势学科建设工程资助项目。
*通讯联系人。E-mail:zhangfang@nuaa.edu.cn;会员登记号:S06N0455M1006。