肿瘤浸润T淋巴细胞在乳腺癌原发灶中的表达与预后的关系
2015-12-05蒋正华韩旭
蒋正华 韩旭
1.浙江金华广福医院十二病区腹部肿瘤外科,浙江金华321000;2.湖州师范学院附属第一医院胸外科,浙江湖州313000
肿瘤浸润T淋巴细胞在乳腺癌原发灶中的表达与预后的关系
蒋正华1韩旭2
1.浙江金华广福医院十二病区腹部肿瘤外科,浙江金华321000;2.湖州师范学院附属第一医院胸外科,浙江湖州313000
目的研究肿瘤浸润T淋巴细胞在乳腺癌原发灶中的表达及其与预后的关系。方法回顾性收集乳腺癌患者105例临床资料、病理资料和石蜡包埋病理标本,采用免疫组化检测CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞在乳腺癌原发灶的表达,采用COX单因素和多因素分析无病生存率(DFS)和总生存率(OS)相关因素。结果105例患者乳腺癌原发灶CD3+阳性101例(96.19%),CD4+阳性55例(52.38%),CD8+阳性71例(67.62%),CD3+T淋巴细胞浸润与年龄、肿瘤直径、临床分期、SBR分级、ER表达、PR表达、HER-2表达、淋巴结状态无关,CD4+T淋巴细胞浸润与SBR分级、HER-2表达有关(P<0.05),CD8+T淋巴细胞浸润与SBR分级有关(P<0.05)。单因素分析显示,临床分期、SBR分级、HER-2阳性、淋巴结转移、CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润与DFS有关(P<0.05);临床分期、SBR分级、HER-2阳性、淋巴结转移、CD4+浸润、CD8+浸润与OS有关(P<0.05);多因素分析显示,CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润是DFS的保护因素(HR=0.655、0.534,P<0.05);CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润是OS的保护因素(HR=0.525、0.628,P<0.05)。结论乳腺癌原发灶普遍存在CD3+T淋巴细胞浸润,CD4+T淋巴细胞、CD8+T淋巴细胞浸润与病变程度有关,两者均与乳腺癌较好预后有关。
乳腺癌;肿瘤浸润T淋巴细胞;CD4+T淋巴细胞;CD8+T细胞;生存率
肿瘤浸润淋巴细胞(TILs)是一类特殊淋巴细胞,在肿瘤免疫机制中处于免疫应答和调控作用前沿,在体内局部抗肿瘤过程中发挥重要作用,包括T淋巴细胞、B淋巴细胞、NK状细胞等在乳腺癌病变区聚集浸润,不同来源的TILs对肿瘤细胞作用不尽相同,有研究认为TILs与治疗效果和生存率相关[1,2]。可通过早
期检测评估和制定治疗方案,提高治疗针对性,降低复发率,改善患者预后。T淋巴细胞是机体重要的抗肿瘤免疫应答细胞,主要介导细胞免疫抑制或杀伤肿瘤细胞,CD3+是T淋巴细胞主要表面标志物,CD4+、CD8+T淋巴细胞是T淋巴细胞主要的两种亚型,CD4+T淋巴细胞对体液免疫和细胞免疫有调节作用,分泌细胞因子激活CD8+T淋巴细胞,CD8+T淋巴细胞则具有细胞毒性作用,直接杀伤肿瘤细胞。以往研究对不同来源T淋巴细胞浸润强度及其对预后的影响存在差异。本研究对乳腺癌原发灶组织中CD3+、CD4+、CD8+T淋巴细胞表达及其对患者无病生存率(DFS)和总生存率(OS)的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
回顾性收集2008年6月~2012年5月在我院手术治疗的乳腺癌患者105例临床资料、病理资料和石蜡包埋病理标本,患者均为女性,年龄34~69岁,平均(52.34±4.37)岁,纳入标准:均经术后病理证实为原发乳腺癌,TNM临床分期Ⅰ~Ⅲ期[3],术前未进行放疗、化疗、靶向治疗、免疫调节剂治疗等,均顺利完成乳腺癌根治术,临床资料、病理资料、病理标本及术后随访资料完整。其中浸润性导管癌76例,乳腺髓样癌29例,TNM临床分期Ⅰ期23例,Ⅱ期49例,Ⅲ期33例,淋巴结转移35例,ER阳性78例,PR阳性62例,HER-2阳性23例,术后辅助化疗91例,辅助放疗33例,同步放化疗18例,内分泌治疗58例,均未行手术去势。术后随访截止期为2014年6月,共25~70个月,中位随访时间46个月。
1.2 免疫组化
所有石蜡样本连续切4 μm厚薄片,取其中病灶特征明显切片进行烘烤、甲苯脱蜡、梯度酒精水化、高压修复、3%H2O2孵育灭活内源性过氧化物酶、封闭非特异性抗原位点等预处理,加入鼠抗人CD3+、CD4+、CD8+单克隆抗体(均购自福建迈新公司)作为一抗,4℃孵育过夜,漂洗、复温37℃,加生物素标记二抗工作液37℃孵育30 min,PBS缓冲液漂洗、DAB显色、苏木素复染,高倍显微镜下镜检,PBS替代一抗作阴性对照。
1.3 结果判定
高倍视野(×400倍)在病灶随机选择5个视野,应使所选视野分布于病灶各部位,CD3+、CD4+、CD8+染色均定位于淋巴细胞胞膜。观察显色强度:无显色计0分,黄色或浅棕色计1分,棕色计2分,深棕色计3分;观察显色面积:进行视野淋巴细胞计数,<5%淋巴细胞着色计0分,<25%淋巴细胞着色计1分,25%~50%淋巴细胞着色计2分,>50%淋巴细胞着色计3分;显色强度和显色面积得分相乘,<2分为阴性(-),≥2分为阳性[2]。
1.4 统计学方法
采用SPSS19.0统计学进行分析,计量资料以(x±s)表示,等级资料采用软件Kruskal-Wallis秩和检验,分类变量与连续变量的相关性采用Spearman秩相关性分析,生存分析采用Kaplan-Meier法,相关因素分析采用COX风险比例模型进行单因素和多因素分析,单因素分析P<0.1的因素可为纳入多因素分析。α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 CD3+、CD4+、CD8+在乳腺癌原发灶的表达与病理特征的关系
105例患者乳腺癌原发灶CD3+阳性101例(96.19%),CD4+阳性55例(52.38%),CD8+阳性71例(67.62%),CD3+T淋巴细胞浸润与年龄、肿瘤直径、临床分期、SBR分级、ER表达、PR表达、HER-2表达、淋巴结状态无关,CD4+T淋巴细胞浸润与SBR分级、HER-2表达有关(P<0.05),CD8+T淋巴细胞浸润与SBR分级有关(P<0.05),见表1。
2.2 乳腺癌DFS和OS影响因素COX单因素分析
随访期间复发或远处转移13例,死亡9例,经Kaplan-Meier法分析,2年无病生存率85.45%,生存率93.23%,3年无病生存率81.23%,生存率89.93%,5年无病生存率76.23%,生存率84.92%。将临床及病理相关因素带入COX模型为自变量,分别以无病生存率(DFS)和总生存率(OS)为因变量,单因素分析示,临床分期、SBR分级、HER-2阳性、淋巴结转移是DFS危险因素(HR=2.351、2.936、3.025、2.105,P<0.05),CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润对DFS有保护作用(HR=0.636、0.513,P<0.05);临床分期、SBR分级、HER-2阳性、淋巴结转移是OS危险因素(HR=3.251、3.562、4.251、3.024,P<0.05),CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润对OS有保护作用(HR=0.622、0.565,P<0.05),见表2。
2.3 乳腺癌DFS和OS影响因素COX多因素分析
单因素分析P<0.05的因素带入多因素分析,SBR分级、淋巴结转移是DFS的独立危险因素(HR=2.526、2.415,P<0.05),CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润是DFS的保护因素(HR=0.655、0.534,P<0.05);淋巴结转移是OS的独立危险因素(HR=2.065,P<0.05),CD4+T淋巴细胞浸润、CD8+T淋巴细胞浸润是OS的保护因素(HR=0.525、0.628,P<0.05),见表3。

表1CD3+、CD4+、CD8+在乳腺癌原发灶的表达与病理特征的关系(%)

表2乳腺癌DFS和OS影响因素COX单因素分析
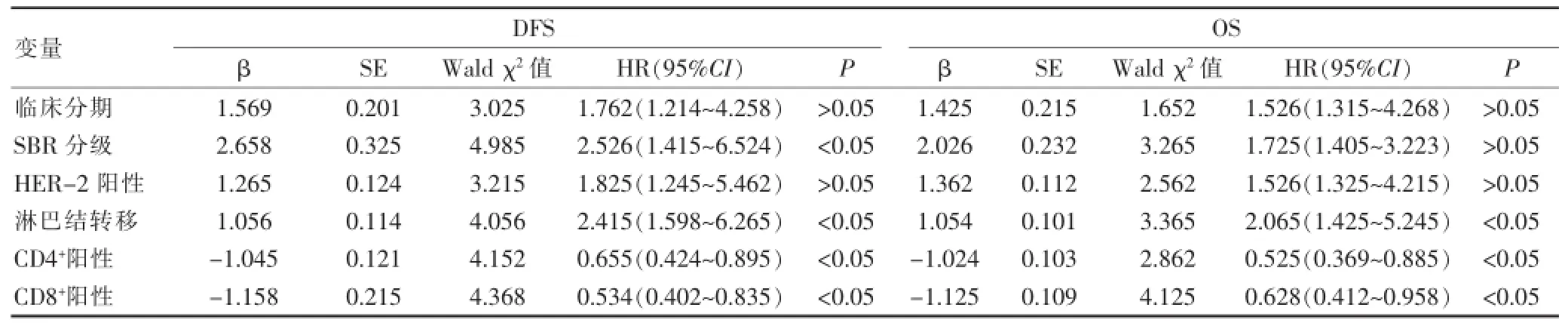
表3乳腺癌DFS和OS影响因素COX多因素分析
3 讨论
T淋巴细胞是由重要的TILs组成,并且各亚群在肿瘤免疫中都发挥着重要作用,本组浸润性导管癌76例,乳腺髓样癌29例,原发灶CD3+阳性101例(96.19%)反映了乳腺癌癌巢内普遍存在T淋巴细胞浸润,有研究发现肿瘤细胞间质也存在大量的T淋巴
细胞浸润,但与生存率的关系并不明确[4,5]。张同先等[6]研究中128例患者浸润性导管癌和髓样癌组织中均呈CD3+阳性,而CD3+T淋巴细胞浸润程度与分化程度、淋巴结转移有关,分化越低表达强度越低,有淋巴结转移的表达强度明显低于无转移。CD4+T淋巴细胞调节Th1和Th2平衡,介导肿瘤免疫,与肿瘤细胞相互作用而参与抗肿瘤和免疫逃逸过程,在肿瘤组织中表达并不高[7],本组CD4+阳性55例(52.38%),CD8+T淋巴细胞是肿瘤组织中主要的浸润T淋巴细胞亚型,本组CD8+阳性71例(67.62%),与文献报道相似。CD4+T淋巴细胞浸润与SBR分级、HER-2相关,SBR分级越严重CD4+阳性率越高,HER-2阳性则CD4+阳性率更高,CD8+T淋巴细胞浸润与SBR分级相关,SBR分级越严重CD8+阳性率越高,均显示CD4+T淋巴细胞、CD8+T淋巴细胞浸润可能与乳腺癌生物学特征及恶性程度有关[8]。
本组乳腺癌患者随访时间25~70个月,中位随访时间46个月,复发或远处转移13例,死亡9例,2年无病生存率85.45%,生存率93.23%,3年无病生存率81.23%,生存率89.93%,5年无病生存率76.23%,生存率84.92%,术后存在较高的复发或远处转移风险,分析肿瘤浸润T淋巴细胞表达及其他临床资料与预后的关系有助于为临床干预提供参考指标。在COX单因素分析显示,临床分期、SBR分级、HER-2阳性、淋巴结转移均可提高复发风险(HR=2.351、2.936、3.025、2.105),同时也是OS危险因素(HR=3.251、3.562、4.251、3.024),而原发灶组织中CD4+T淋巴细胞、CD8+T淋巴细胞浸润则对DFS和OS有一定保护作用。肿瘤预后受到多种因素共同影响,而本研究反映出的危险因素均与肿瘤生物学特征和病情严重程度有关,与以往多项流行病学调查结果相似[9,10],本研究提示CD4+T淋巴细胞、CD8+T淋巴细胞浸润机体免疫机制在肿瘤灶内主要发挥抗肿瘤免疫作用。尽管CD4+T淋巴细胞存在多种亚群并通过多种细胞因子发挥不同免疫功能,肿瘤细胞可自行分泌免疫抑制细胞因子干扰肿瘤免疫,或通过分泌TGF-β选择性抑制CD4+T淋巴细胞,CD4+T淋巴细胞调节使Th1/Th2平衡向Th2漂移则参与肿瘤免疫逃逸[11,12],研究结果则显示,在乳腺癌原发灶内的免疫调节可能是有利于细胞免疫对肿瘤的杀伤。并且多因素分析也证实,CD4+细胞是DFS和OS的独立影响因素,与更好的预后有关。本研究纳入病理为浸润性导管癌和乳腺髓样癌,在以往的研究中这两种类型的CD4+细胞表达较其他类型乳腺癌更高[13],因此,CD4+T淋巴细胞浸润对其他类型乳腺癌的影响仍需进一步研究。
CD8+T淋巴细胞可直接溶解和杀死异体细胞、微生物及肿瘤细胞,是机体细胞免疫的主要力量,其受到CD4+T淋巴细胞的调控,以上结果提示CD4+T淋巴细胞在乳腺癌灶内的作用有利于抗肿瘤免疫,与CD8+T淋巴细胞高表达相符,在大肠癌组织中CD8+T淋巴细胞浸润与临床分期、组织分型等有关,恶性程度越高CD8+细胞表达越高,而CD8+T淋巴细胞浸润程度越高预后越好[14],在本研究中也部分体现了这种情况,提示机体在对抗恶性肿瘤细胞时调动细胞免疫的能力可能受到肿瘤细胞生物学特征的影响,而CD8+T淋巴细胞浸润则反映机体免疫反应强度,存在个体化因素影响。同时也支持对于患者免疫功能的调节可能有利于提高患者预后的观点[15],而激发CD8+T淋巴细胞活性可能是干预的作用点。本研究显示CD8+T淋巴细胞浸润是DFS和OS的独立影响因素,与更好的预后有关。
综上所述,乳腺癌原发灶组织中普遍存在CD3+T淋巴细胞浸润,CD4+T淋巴细胞、CD8+T淋巴细胞浸润与病变程度有关,两者均与乳腺癌较好预后有关。
[1]曹林林,刘颖男,郑德明,等.乳腺癌患者手术前后T淋巴细胞亚群变化的实验研究[J].中国实验诊断学,2013,17(1):113-114.
[2]Meyerhuber P,Conrad H,Starck L,et al.Targeting the epidermal growth factor receptor(HER)family by T cell receptor gene-modified T lymphocytes[J].Journal of molecular medicine,2010,88(11):1113-1121.
[3]James A,Thompson Minu K,Srivastava Jacobus J,et al.The absence of invariant chain in MHC II cancer vaccines enhances the activation of tumor-reactive type 1 CD4+T lymphocytes[J].Cancer immunology,immunotherapy:CII,2008,57(3):389-398.
[4]林泽伟,骆必伟,袁晓东,等.原发性肝癌患者肿瘤浸润T淋巴细胞亚群分析[J].中国现代普通外科进展,2013,16(7):523-526,541.
[5]何建明,黄湛,吴家豪.CD8+肿瘤浸润淋巴细胞与乳腺癌预后的关系[J].中国普通外科杂志,2013,22(11):1475-1478.
[6]张同先,张巍,刘芬,等.CD20+B和CD3+T淋巴细胞在乳腺浸润性导管癌和髓样癌中的表达及与预后的关系[J].肿瘤防治研究,2013,40(5):463-467.
[7]于海明,焦顺昌,杨俊兰,等.乳腺癌原发灶T淋巴细胞浸润与预后的关系[J].中国医学科学院学报,2013,35(2):199-206.
[8]张宗勤,张小峰.淋巴细胞浸润肿瘤的调节机制[J].中国肿瘤生物治疗杂志,2013,20(3):372-375.[9]王鸿雁,史秦峰,孙颖,等.人乳腺癌组织及局部引流淋巴结中调节性T细胞分析[J].中华病理学杂志,2013,42(2):95-100.
[10]曲婵娟,易玲,张洪涛.肿瘤免疫治疗热点及肺癌疫苗研究近况[J].中华肿瘤杂志,2013,35(6):401-404.
[11]Janneh O,Chandler B Hartkoorn.Intracellular accumulation of efavirenz and nevirapine is independent of P-glycoprotein activity in cultured CD4 T cells and primary human lymphocytes[J].The Journal of Antimicrobial Chemotherapy,2009,64(5):1002-1007.
[12]Yuan H,Hsiao YH,Zhang Y,et al.Destructive impact of T-lymphocytes,NK and Mast cells on basal cell layers: Implications for tumor invasion[J].BMC Cancer,2013,13(6):258.
[13]Zhao S,Yang X,Lu N,et al.The amount of surface HLA-I on T lymphocytes decreases in breast infiltrating ductal carcinoma patients[J].The Journal of international medical research,2011,39(2):508-513.
[14]翟志伟,王振军.肿瘤浸润淋巴细胞在结直肠癌中的研究进展[J].中华胃肠外科杂志,2013,16(8):797-800.
[15]Matkowski R,Gisterek I,Halon A.The prognostic role of tumor-infiltrating CD4 and CD8 T lymphocytes in breast cancer[J].Anticancer Research,2009,29(7):2445-2451.
Tumor-infiltrating T lymphocytes relationship with prognosis in primary tumors in breast cancer
JIANG Zhenghua1HAN Xu2
1.No.12 Ward of Abdominal Tumor Surgery,Guangfu Hospital of Jinhua City in Zhejiang Province,Jinhua321000,China;2.Department of Thoracic Surgery,the First Affiliated Hospital of Huzhou Teachers College,Huzhou313000,China
Objective To research tumor-infiltrating T lymphocytes in breast primary tumor expression and the relationship with prognosis.Methods Retrospectively collected clinical data of 105 cases of breast cancer patients,pathological data and paraffin-embedded pathological specimens,using immunohistochemical detection of CD3+T cells,CD4+T cells,CD8+T cells in primary tumors in breast cancer,used univariate and multivariate COX factor analysis of diseasefree survival(DFS),overall survival(OS)related factors.Results The primary tumor CD3+positive 101 cases(96.19%), in 105 cases with breast cancer CD4+positive 55 cases(52.38%),CD8+positive 71 cases(67.62%),CD3+T cells infiltration with age,tumor size,clinical stage,differentiation degree,SBR grade,ER expression,PR expression,HER-2 expression and lymph node status were independent,CD4+T cells infiltration were related to SBR grade,HER-2(P< 0.05),CD8+T cells infiltration were related to cell differentiation and SBR grade(P<0.05).Univariate analysis showed that clinical stage,degree of differentiation,SBR grade,HER-2 positive,lymph node metastasis,CD4+T cells infiltration,CD8+T cells infiltration were related to DFS(P<0.05);clinical stage,SBR grade,HER-2-positive,lymph node transfer,CD4+T cells infiltration,CD8+infiltration were related to OS(P<0.05);multivariate analysis shows,CD4+T cells infiltration,CD8+T cells infiltration were protective factor for DFS(HR=0.655,0.534,P<0.05);CD4+T cells infiltration, CD8+T cells infiltration were protective factor for OS(HR=0.525,0.628,P<0.05).Conclusion The prevalence of breast cancer primary tumor infiltration of CD3+T cells,CD4+T cells,CD8+T cells infiltration and related lesions,both with better prognosis in breast cancer.
Breast cancer;Tumor-infiltrating T lymphocytes;CD4+T cells;CD8+T cells;Survival
R737.9
A
1673-9701(2015)06-0013-04
2014-09-25)
国家医学教育发展中心课题项目(2012-03-07-143)
