转化生长因子β1联合生长分化因子-5体外诱导骨髓间质干细胞向类髓核细胞分化的实验研究
2015-12-05迅山西医科大学山西太原030001
邢 峰 马 迅山西医科大学,山西太原 030001
转化生长因子β1联合生长分化因子-5体外诱导骨髓间质干细胞向类髓核细胞分化的实验研究
邢 峰 马 迅▲
山西医科大学,山西太原 030001
目的 探讨转化生长因子β1联合生长分化因子-5体外诱导骨髓间质干细胞向类髓核细胞分化的可能性。 方法 取SD大鼠骨髓间质干细胞,流式细胞仪检测两种干细胞CD105、CD90、CD44、CD29、CD45、CD34、CD24的表达。将增殖至第三代的BMSCs分为对照、TGF-β1、GDF-5、TGF-β1+ GDF-5四组,分别以含不同细胞因子诱导液培养14d后,采用RT-PCR检测各组细胞Ⅱ型胶原、蛋白多糖、SOX-9基因的表达。 结果 两种干细胞CD105、CD90、CD44、CD29表达阳性; CD45、CD34、CD24表达阴性。向类髓核细胞诱导培养14d后,TGF-β1、GDF-5、TGF-β1与GDF-5三组的Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平较对照组均有明显升高,差异有统计学意义(P<0.05)。联合诱导组经过诱导后的Collagen typeⅡ、Aggrecan、SOX-9基因表达水平明显高于TGF-β1组及GDF-5组,差异有统计学意义(P<0.05)。结论 GDF-5与TGF-β1都具有诱导BMSCs向类髓核细胞分化的能力,且二者之间具有协同作用,联合应用可以更好的诱导BMSCs向类髓核细胞分化。
转化生长因子β1;生长分化因子-5;骨髓间质干细胞;类髓核细胞;椎间盘;Ⅱ型胶原
脊柱退行性疾病是严重危害人类健康和生命的重要疾病,椎间盘退变(intervertebral disc degenerative diseases,DDD)是其主要的病理改变。传统保守治疗和手术治疗方法只然能缓解临床症状,并不能从根本上缓解椎间盘的退变。近年来随着生物技术的发展,以细胞治疗为基础的生物治疗技术为椎间盘退变性疾病提供了一种新的治疗策略。骨髓间充质干细胞(bone marrow mesenchyme stem cells,BMSCs)具有向多种细胞分化的能力,合适的微环境及环境中相关细胞因子的存在是BMSCs定向分化的前提。转化生长因子β1(transforming growth factor beta 1,TGF-β1)是软骨及髓核组织工程中常用的细胞因子,能够诱导BMSCs 向类软骨细胞和类髓核细胞分化,并且在软骨形成过程中有着重要的作用。生长分化因子-5(growth and differentiation factor-5)也称为软骨源性形态发生蛋白 -1(cartilage-derived morphogenetic protein-1,CDMP-1)是骨形态发生蛋白家族中的一员,具有促进软骨形成和发育的能力。本实验旨在探讨转化生长因子β1联合生长分化因子-5体外诱导骨髓间质干细胞向类髓核细胞分化的可能性,为髓核组织工程研究提供相关理论与实验依据。
1 材料与方法
1.1实验材料与仪器
SD大鼠骨髓间质干细胞成软骨诱导培养液(Cyagen,美国);重组人TGF-beta1(PeproTech,美国);重组人GDF-5(PeproTech,美国);荧光定量试剂盒(TaKaRa,日本);7300荧光实时定量PCR扩增仪(Applied Biosystems,美国)。
1.2BMSCs的分离与培养
无菌条件下,取SD大鼠股骨骨髓,200目滤网过滤去除残留组织,PBS冲洗3次,加入20%胎牛血清的DMEM/F12培养液吹打均匀,计数后,按细胞密度为1×104/L接种于25cm2培养瓶中,置于37℃、5%CO2培养箱培养。每3天换液1次,倒置显微镜观察细胞生长情况。原代培养细胞达到80%~90%融合时,加入质量浓度为0.25%的胰蛋白酶消化,计数后按1∶2分瓶传代。
1.3流式细胞术进行表面免疫表型鉴定
取第3代BMSCs,胰蛋白酶消化,每管取1mL浓度为1×105/mL的细胞,PBS洗涤,弃上清用于标记。每种细胞均设同型对照(IgG1-PE抗体),其余测定管中分别加入荧光单克隆抗体CD105、CD90、CD29、CD45、CD44、CD34、CD24(荧光染料均为PE),混匀后室温避光孵育30min, PBS清洗,重悬于500μL PBS(含质量浓度为1%的多聚甲醛),BACKMAN FC500型流式细胞仪检测。根据同型对照的荧光强度设定阴性细胞群阈值,观察各组阳性细胞表达率及荧光强度。
1.4BMSCs向类髓核细胞诱导分化
1.4.1实验分组 (1)对照组;(2)TGF-β1组;(3)GDF-5组;(4)TGF-β1+ GDF-5组。
1.4.2培养基配置 (1)无血清低糖DMEM、1mM丙酮酸钠、0.1mM维生素C、10-7M地塞米松;(2)(1)+10ng/mL重组人TGF-β1;(3)(1)+100ng/mL重组人GDF-5;(4)(1)+10ng/mL重组人TGF-β1+100ng/mL重组人GDF-5。
1.4.3向类髓核细胞诱导分化方法 分别取脂肪、髓核来源第3代间充质干细胞,胰蛋白酶消化制成单细胞悬液,细胞计数板计数,转移到15mL离心管中,1000rpm离心5min,弃上清,每7.5×105个细胞用1mL不完全诱导液重悬,1000rpm离心5min,弃上清,用完全诱导液以5×105/mL的浓度重悬,每0.5毫升细胞悬液分装入15mL离心管中,1000rpm离心5min,将离心管盖拧紧后松开半圈,置 37℃、5%CO2、饱和湿度培养箱中静置24h。每2~3天完全换液,换液后轻弹离心管底部,使细胞球悬浮。每2~3d换液1次,按照时间分组连续诱导14d。
1.5SYBR green法荧光定量PCR分析
诱导完成后,以Trizol法提取各组细胞总RNA,测定RNA浓度,按照RT试剂盒说明书将RNA逆转录为cDNA,按照SYBR green荧光定量RT-PCR试剂盒说明,反应体系为:2×SYBR Premix Ex Taq 10μL,Rox DyeⅡ 0.4μL,上游引物 0.8μL,下游引物 0.8μL,cDNA 2μL,去离子水:6μL。反应条件:90℃预变性10s,随后90℃变性5s,60℃延伸40s,共40个循环。采用ΔΔCt法,即以β-actin为内参照基因,计算各样品ΔCt(目的基因 Ct-内参基因Ct),设定某一正常对照ΔCt值为校正样品,计算ΔΔCt(各样品ΔCt-校正品ΔCt),某样品的目的基因mRNA相对表达量(RQ)可用如下公式计算:RQ=2-ΔΔCt每一样品均设2个重复孔,计算其均值作为RQ值。每次PCR反应后均进行熔解曲线分析以确认扩增产物的特异性。
目的基因和内参照基因的引物序列如下:Aggrecan(ACAN)引物序列如下:上游引物5′-CCACTGGAGAGGACTGCGTAG-3′,下游引物5′- GGTCTGTGCAAGTGATTCGAG -3′。Type II collagen_1(COL2A1)引物序列如下:上游引物5′-GGAAGAGTGGAGACTACTGGATTGAC-3′,下游引物5′-TCCATGTTGCAGAAAACCTTCA-3′。Sexdetermining region Y box 9 (SOX-9)引物序列如下:上游引物5′- AGGAAGCTGGCAGACCAGTACC-3′,下游引物5′- GGGTCTCTTCTCGCTCTCGTTCA-3′。内参基因b-actin引物序列如下:上游引物:5′-TCCTAGCACCATGAAGATC-3′,下游引物:5′-AAACGCAGCTCAGTAACAG-3′。
1.6统计学处理
2 结果
2.1干细胞的分离与培养
原代细胞3~4d贴壁,细胞形态以短梭形居多,少量为三角形及多边形,形态饱满,胞核明显,折光性好;15~20d达到90%融合,传至第3代,细胞形态均一、排列紧密,呈螺旋状生长。见图1。
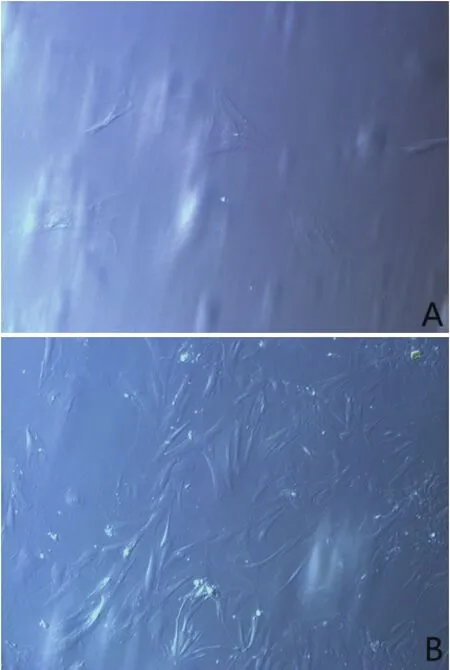
图1 BMSCs细胞形态(X100)
2.2干细胞的鉴定
流式细胞术检测BMSCs结果显示CD105、CD90、CD44、CD29均为阳性;造血干细胞标志CD45、CD34均为阴性;成熟髓核细胞标志物CD24均为阴性。见图2。
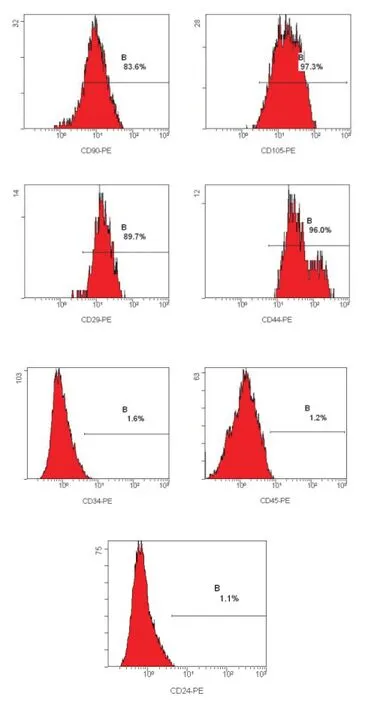
图2 流式细胞仪鉴定
2.3细胞外基质相关基因的表达
各组诱导14d后,采用Realtime PCR对各组Collagen type Ⅱ、Aggrecan、SOX-9基因进行定量检测,结果显示,TGF-β1(2)、GDF-5(3)、TGF-β1与GDF-5(4)三组的Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平较对照组均有明显升高,差异有统计学意义(P<0.05)。联合诱导(4)组经过诱导后的Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平明显高于TGF-β1(2)组及GDF-5(3) 组,差异有统计学意义(P<0.05)。TGF-β1(2)组与GDF-5(3)组Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平无统计学意义(P>0.05)。见图3。

图3 RT-PCR检测Collagen type Ⅱ、Aggrecan、SOX-9基因的表达
3 讨论
椎间盘退行性病变引起的颈肩、腰腿痛在临床骨科十分常见[1]。造成椎间盘退行性变的主要原因通常认为是中央髓核的退变所致,细胞减少且功能退化,髓核脱水,合成蛋白聚糖和Ⅱ型胶原蛋白能力减弱,且难以自行逆转[2-3]。目前临床常规手术如髓核摘除、人工椎间盘置换等虽然可以缓解病痛,却难以完全模拟和替代髓核复杂的生物力学功能,同时还存在并发症和远期疗效不佳的问题,故更不宜应用于椎间盘退变的早期治疗。组织工程技术的日益发展和成熟,为解决上述难题带来了希望。研究表明转化生长因子β1与生长分化因子-5均具有体外促进骨髓间质干细胞向类髓核细胞分化的能力,然而二者联合诱导骨髓间质干细胞向类髓核细胞分化效果如何目前未见相关报道。因此,本实验通过探讨转化生长因子β1联合生长分化因子-5体外诱导骨髓间质干细胞向类髓核细胞分化的可能性,为髓核组织工程研究提供相关理论与实验依据。
2004年,Risbud等[4]首次以包含TGF-β1的培养基在低氧条件下将BMSCs在体外诱导分化为类髓核细胞表型,使其髓核细胞转录产物蛋白多糖、Ⅱ型胶原及SOX9表达均显著增高[5],证实了TGF-β具有在体外诱导干细胞向类髓核细胞分化的能力,如今TGF-β的利用已成为体外诱导干细胞向类髓核细胞分化最常使用的方法之一[6-9]。
生长分化因子-5也称为软骨源性形态发生蛋白-1是骨形态发生蛋白家族中的一员, 作用于骨骼系统,具有促进软骨形成和发育的能力。其具有多种调节功能,可用于软骨、骨、关节、肌腱、韧带、椎间盘等的组织工程研究与治疗。Wang 等[10]将带有CDMP-1及TGF-β的腺病毒分别转染到兔和人椎间盘细胞中,结果显示CDMP-1与TGF-β过表达可以促进椎间盘细胞的增殖以及细胞外基质的合成。Maitre等[11]的研究发现,退变人髓核细胞在包含GDF-5的诱导液培养后蛋白多糖与Ⅱ型胶原基因表达增高,且蛋白多糖产物增多。
髓核细胞外基质主要由胶原纤维和蛋白聚糖构成, 髓核细胞的主要功能是分泌胶原蛋白和酸性粘多糖[12],其中Ⅱ型胶原占大部分,它和聚集蛋白聚糖、SOX-9被认为是髓核细胞的特征性标志[5],且在国内外众多学者的研究当中作为干细胞向类髓核细胞诱导分化的评定标准[7-8,13-15]。本实验分别用包含TGF-β1、GDF-5、TGF-β1与GDF-5,及无细胞因子4种诱导液诱导BMSCs向类髓核细胞分化,大体观察诱导48h后,TGF-β1、GDF-5、TGF-β1与GDF-5三组离心管中的细胞均形成细胞球,第一次换液后轻弹离心管底部,细胞球悬浮于诱导液中,而对照组离心管中无细胞球形成。荧光定量PCR测定细胞外基质相关基因蛋白多糖、Ⅱ型胶原及SOX-9的表达,采用SPSS13.0软件进行统计学处理,单因素方差分析结果显示, TGF-β1(2)、GDF-5(3)、TGF-β1与GDF-5(4)三组的Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平较对照组均有明显升高,联合诱导(4)组经过诱导后的Collagen type Ⅱ、Aggrecan、SOX-9基因表达水平明显高于TGF-β1(2)组及GDF-5(3)组,表明GDF-5与TGF-β1都具有诱导BMSCs向类髓核细胞分化的能力,且二者之间具有协同作用,联合应用可以更好的诱导BMSCs向类髓核细胞分化。
体外诱导BMSCs向类髓核细胞表型分化是一个复杂的过程,适宜的微环境、细胞因子以及诱导方法是其分化的必要条件。因此,需探索合适的细胞因子组合及其浓度才能达到最佳的诱导分化效果,以构建更加优质的组织工程化髓核。另外,有必要从分子水平进一步探索BMSCs向类髓核细胞诱导分化的信号传导和分化机制, 以及如何长期维持诱导后的髓核细胞表型,在低氧、低糖、低PH、高渗透压为特点的椎间盘内环境下其生存、增值,以及向类髓核细胞诱导分化的能力如何,这些都有待于进一步的研究。
[1] van Tulder MW, Koes BW, Bouter LM. A cost-of-illness study of back pain in The Netherlands[J]. Pain, 1995, 62(2): 233-240.
[2] Kepler CK, Ponnappan RK, Tannoury CA, et al. The molecular basis of intervertebral disc degeneration[J]. Spine J, 2013, 13(3): 318-330.
[3] Liebscher T, Haefeli M, Wuertz K, et al. Age-related variation in cell density of human lumbar intervertebral disc[J]. Spine (Phila Pa 1976), 2011, 36(2): 153-159.
[4] Risbud MV, Albert TJ, Guttapalli A, et al. Differentiation of mesenchymal stem cells towards a nucleus pulposuslike phenotype in vitro: implications for cell-based transplantation therapy[J]. Spine (Phila Pa 1976), 2004,29(23): 2627-2632.
[5] Sive JI, Baird P, Jeziorsk M, et al. Expression of chondrocyte markers by cells of normal and degenerate intervertebral discs[J]. Mol Pathol, 2002, 55(2): 91-97.
[6] Feng G, Jin X, Hu J, et al. Effects of hypoxias and scaffold architecture on rabbit mesenchymal stem cell differentiation towards a nucleus pulposus-like phenotype[J]. Biomaterials, 2011, 32(32): 8182-8189.
[7] Clarke LE, McConnell JC, Sherratt MJ, et al. Growth differentiation factor 6 and transforming growth factorbeta differentially mediate mesenchymal stem cell differentiation, composition and micromechanical properties of nucleus pulposus constructs[J]. Arthritis Res Ther, 2014, 16(2): R67.
[8] Stoyanov JV, Gantenbein-Ritter B, Bertolo A, et al. Role of hypoxia and growth and differentiation factor-5 on differentiation of human mesenchymal stem cells towards intervertebral nucleus pulposus-like cells[J].Eur Cell Mater, 2011,20(21): 533-547.
[9] Tapp H, Deepe R, Ingram JA, et al. Adipose-derived mesenchymal stem cells from the sand rat: transforming growth factor beta and 3D co-culture with human disc cells stimulate proteoglycan and collagen type I rich extracellular matrix[J]. Arthritis Res Ther,2008,10(4):R89.
[10] Wang H, Kroeber M, Hanke M, et al. Release of active and depot GDF-5 after adenovirus-mediated overexpression stimulates rabbit and human intervertebral disc cells[J]. J Mol Med (Berl),2004, 82(2):126-134.
[11] Le Maitre CL, Freemont AJ, Hoyland JA. Expression of cartilage-derived morphogenetic protein in human intervertebral discs and its effect on matrix synthesis in degenerate human nucleus pulposus cells[J]. Arthritis Res Ther,2009,11(5):R137.
[12] Melrose J, Ghosh P, Taylor TK. A comparative analysis of the differential spatial and temporal distributions of the large(aggrecan, versican)and small (decorin,biglycan,fibromodulin)proteoglycans of the intervertebral disc[J]. J Anat,2001,198(Pt 1):3-15.
[13] Gantenbein-Ritter B, Benneker LM, Alini M, et al. Differential response of human bone marrow stromal cells to either TGF-beta(1)or rhGDF-5[J]. Eur Spine J,2011, 20(6):962-971.
[14] Dai J, Wang H, Liu G, et al. Dynamic compression and co-culture with nucleus pulposus cells promotes proliferation and differentiation of adipose-derived mesenchymal stem cells[J]. J Biomech,2014,47(5):966-972.
[15] Sun Z, Liu ZH, Zhao XH, et al. Impact of direct cell co-cultures on human adipose-derived stromal cells and nucleus pulposus cells [J]. J Orthop Res,2013,31(11):1804-1813.
An experimental research of transforming growth factor β1 combined with growth differentiation factor-5 inducing bone marrow mesenchymal stem cells to differentiate into nucleus pulposus-like cells
XING Feng MA Xun
Shanxi Medical University, Taiyuan 030001, China
Objective To explore the possibility of transforming growthβ1 combined with growth differentiation factor-5 inducing bone marrow mesenchymal stem cells to differentiate into nucleus pulposus-like cells. Methods Bone marrow mesenchymal stem cells were taken from Sprague-Dawley rats and flow cytometer was used to detect the expression of CD105, CD90, CD44, CD29, CD45, CD34 and CD24 of two kinds of stem cells. BMSCs proliferating to the third generation were divided into control group, TGF-β1 group, GDF-5 group and TGF-β1+ GDF-5 group. After 14 days' cultivation of inducing medium of different cytokines, RT-PCR were used to detect the expression of collagen typeⅡ, proteoglycan and SOX-9 genes in every group. Results The CD105, CD90, CD44 and CD29 of two kinds of stem cells had positive expressions while CD45, CD34 and CD24 of two kinds of stem cells had negative expressions. After 14 days' inducing cultivation of bone marrow mesenchymal stem cells, gene expression levels of Collagen typeⅡ, Aggrecan and SOX-9 in TGF-β1 group、GDF-5 group and TGF-β1+ GDF-5 group were significantly increased than those in the control group. The difference was statistically significant (P<0.05). The gene expression level of Collagen type Ⅱ, Aggrecan and SOX-9 in TGF-β1+ GDF-5 group were significantly higher than that in TGF-β1 group and GDF-5 group. The difference was statistically significant (P<0.05). Conclusion TGF-β1 and GDF-5 both have the ability to induce bone marrow mesenchymal stem cells to differentiate into nucleus pulposus-like cells and there is synergistic effect between them. The combined application can better induce BMSCs to differentiate into nucleus pulposus-like cells.
Transforming growth factor β1; Growth differentiation factor-5; Bone marrow mesenchymal stem cells; Nucleus pulposus-like cells; Intervertebral disk; Collagen type Ⅱ
R329
B
2095-0616(2015)11-20-05
山西医科大学科技创新基金(01201114)。
▲
(2015-02-13)
