格特隐球菌在河北地区引起1例脑膜炎的临床与实验研究
2015-12-03窦红涛万喆杨启文王瑶王贺谢秀丽刘娟李若瑜徐英春
窦红涛 万喆 杨启文 王瑶 王贺 谢秀丽 刘娟 李若瑜 徐英春
(1.中国医学科学院北京协和医学院北京协和医院检验科,北京100730;2.北京大学第一医院皮肤性病科北京大学真菌与真菌病研究中心,北京100034)
格特隐球菌在河北地区引起1例脑膜炎的临床与实验研究
窦红涛1万喆2杨启文1王瑶1王贺1谢秀丽1刘娟1李若瑜2徐英春1
(1.中国医学科学院北京协和医学院北京协和医院检验科,北京100730;2.北京大学第一医院皮肤性病科北京大学真菌与真菌病研究中心,北京100034)
目的 报道1例我国河北地区由格特隐球菌引起的脑膜炎,并对该菌进行试验研究。方法 将分离自患者脑脊液中的隐球菌分别接种于Chromagar显色培养基和刀豆氨酸⁃甘氨酸⁃溴麝香草酚蓝(CGB)培养基35℃培养,使用API 20C AUX、全自动微生物鉴定仪Vitek 2 Compact、生物梅里埃基质辅助激光解析电离飞行时间质谱分析(MALDI⁃TOF MS)、rDNA ITS和IGS序列分析等方法对该菌进行菌种鉴定,并使用ATB FUNGUS 3进行抗真菌药敏试验。结果 该菌在显色培养基上35℃培养48 h后为白色略带粉色菌落,在CGB培养基35℃培养5 d后使CGB培养基由黄色变为蓝色。API 20C AUX、Vitek 2 Compact和MALDI⁃TOF MS的鉴定结果均为新生隐球菌,rDNA ITS和IGS序列分析均提示该菌为格特隐球菌。5⁃氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑、伏立康唑对该菌的最小抑菌浓度分别是≤4 μg/mL、≤0.5 μg/mL、≤1 μg/mL、≤0.125 μg/mL、≤0.06 μg/mL。结论 CGB培养基、rDNA ITS和IGS序列分析能够区分新生隐球菌和格特隐球菌,应重视格特隐球菌的分离鉴定。
格特隐球菌;河北地区;CGB培养基;鉴定;序列测定;抗真菌药敏试验
[Chin J Mycol,2015,10(1):11⁃15]
隐球菌属[1]有37多个种,但是其中仅有新生隐球菌和格特隐球菌与人类感染最为密切。新生隐球菌地域分布广泛,可从鸟粪、鸟巢、树干等处分离,又分为格鲁比变种和新生变种,多感染免疫缺陷患者。格特隐球菌主要分布在热带及亚热带地区,多感染免疫正常人群,1999年以来格特隐球菌在地处温带的加拿大温哥华岛及美国部分地区引起了人类隐球菌感染的爆发流行,然而关于我国格特隐球菌感染临床特征的研究匮乏,格特隐球菌感染主要分布在上海、江苏、福建、浙江、广东、海南等省份[2],华北地区尚未见报到。本文报道格特隐球菌引起隐球菌性脑膜炎一例,该患者来自华北地区,免疫力正常。本研究在使用Chromagar显色培养基和刀豆氨酸⁃甘氨酸⁃溴麝香草酚蓝 (Canavanine⁃glycine⁃bromthymol blue,CGB)培养基、API 20C AUX、Vitek等常规鉴定的基础上,进一步用生物梅里埃的基质辅助激光解析电离飞行时间质谱分析 (Matrix⁃Assisted Laser Desorption Ionization⁃Time⁃of⁃Flight Mass Spectrome⁃try,MALDI⁃TOF MS)以及核糖体DNA的 ITS和IGS序列分析鉴定该菌。
1 材料和方法
1.1 病历摘要
患者,男,62岁,来自河北衡水,务农,无出差史,无明显诱因出现间断头痛、发热44 d,最高体温38.8℃,全身乏力,后发展为双颞部跳痛乃至全脑部疼痛,伴恶心、非喷射性呕吐两次,头颅CT未见明显异常,胸部CT显示双肺结节影,HBsAg、HCV⁃Ab、HIV⁃Ab均为阴性,血常规基本正常,凝血正常,ESR、CRP、Ig正常,补体CH50 60.5 U/mL,T细胞亚群:CD4+、CD8+细胞比例正常,血清肿瘤标记物正常,抗酸染色阴性,结核抗体阴性。腰穿脑脊液压力为330 mmH2O,脑脊液生化提示蛋白含量1.91 g/L,糖0.9 mmol/L,氯化物111 mmol/L,细胞总数450/mm3,白细胞170/mm3,单核30%。脑脊液新生隐球菌抗原检测阳性1∶1 024,脑脊液墨汁染色阳性,脑脊液培养阳性为新生隐球菌,诊断为隐球菌性脑膜炎,两性霉素B从1 mg逐渐加量至25 mg Qd(1⁃3⁃5⁃10⁃15⁃25)联合氟康唑200 mg Bid治疗,后改为联合5⁃FC 2 g Tid。出现意识模糊后,右侧脑室穿刺引流,留置引流管,每周一、三、五行两性霉素B鞘内注射,剂量分别为0.1 mg⁃0.2 mg⁃0.2 mg⁃0.2 mg⁃0.4 mg。愈后较好,出院后,继续口服氟康唑200 mg Qd巩固治疗1 a,至今未见复发。该患者没有基础疾病,属于免疫正常人群,来自我国温带地区,脑脊液压力较高,经规范的抗隐球菌治疗愈后较好。
1.2 试验菌株
除从上述患者脑脊液中分离到的菌株 (编号PU8)外,同时选取北京大学第一医院真菌与真菌病研究中心惠赠的新生隐球菌(ATCC32045)和格特隐球菌(日本千叶大学真菌医学研究中心),分别编号PU58、PU61。
1.3 常规鉴定
Chromagar显色培养基鉴定 Chromagar显色培养基购自郑州博赛公司,接种试验菌株后35℃培养。
CGB培养基鉴定 CGB培养基按照参考文献配制[3],接种试验菌株后35℃培养。
API 20C AUX鉴定 按照API 20C AUX说明书操作。
Vitek鉴定 使用全自动微生物鉴定仪Vitek 2 Compact配套的YST酵母菌鉴定卡上机鉴定。
1.4 分子鉴定
MALDI⁃TOF MS鉴定 使用生物梅里埃的MALDI⁃TOF MS质谱分析。
rDNA ITS和IGS序列分析 参照Meyer等[4]的方法提取基因组DNA。用真菌通用引物ITS1与ITS4扩增其rDNA ITS区,用IGSF与IGSR引物扩增其IGS区,引物ITS1、ITS4、IGSF和IGSR的序列分别为 ITS1,5‘⁃TCCGTAGGTGAACCT⁃GCGG⁃3’,ITS4,5‘⁃TCCTCCGCTTATTGATATGC⁃3’,IGSF,5⁃‘ATCCTTTGCAGACGACTTGA⁃3’,IG⁃SR,5‘⁃GTGATCAGTGCATTGCATGA⁃3’。ITS PCR反应条件[5]:98℃变性30 s;然后98℃变性5 s,56℃退火5 s,72℃延伸20 s,35个循环;最后72℃延伸1 min。IGS PCR反应条件[5]:98℃变性30 s;然后98℃变性5 s,60℃退火5 s,72℃延伸20 s,35个循环;最后72℃延伸1 min。PCR扩增产物送北京睿博兴科生物技术有限公司双向测序。原始序列与其序列彩图对比、分析并拼接后进入GenBank进行同源序列搜索 (http://blast.ncbi.nlm.nih.gov/Blast.cgi)。使用序列分析软件CLC 6.8.1(http://www.clcbio.com/products/clc⁃sequence⁃viewer/)分别对PU8、PU58和PU61的ITS及IGS序列进行比较。
1.5 抗真菌药敏试验
使用生物梅里埃公司的ATB FUNGUS 3对PU8进行抗真菌药敏试验,测试该菌对5⁃氟胞嘧啶(5⁃FC)、两性霉素B(AMB)、氟康唑(FLC)、伊曲康唑 (ITR)、伏立康唑 (VRC)的最小抑菌浓度(MIC)。
2 结 果
2.1 Chromagar显色培养基鉴定
在Chromagar显色培养基35℃培养48 h后PU8、PU58及PU61均为白色略带粉色菌落,PU8及PU58略显干燥,而PU61为黏液型菌落见图1。
2.2 CGB培养基鉴定
CGB培养基35℃培养5 d后,接种 PU8和PU61的CGB培养基变为深蓝色,而接种PU58的CGB培养基仍为黄色(见图2)。
2.3 常规方法及分子方法鉴定
常规方法及分子方法的鉴定结果见表1。对于PU8和PU61,API 20C、Vitek及质谱分析的鉴定结果均为新生隐球菌,但rDNA ITS序列和IGS序列分析的鉴定结果为格特隐球菌,PU58常规方法及分子方法的鉴定结果均为新生隐球菌。
2.4 rDNA ITS和IGS的序列比较
PU8、PU58和PU61的rDNA ITS序列比较见图3,PU8、PU58和PU61的IGS序列比较见图4。
2.5 药敏结果
5⁃氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑、伏立康唑对该菌的MIC分别是≤4 μg/mL、≤0.5 μg/mL、≤1 μg/mL、≤0.125 μg/mL、≤0.06 μg/mL。
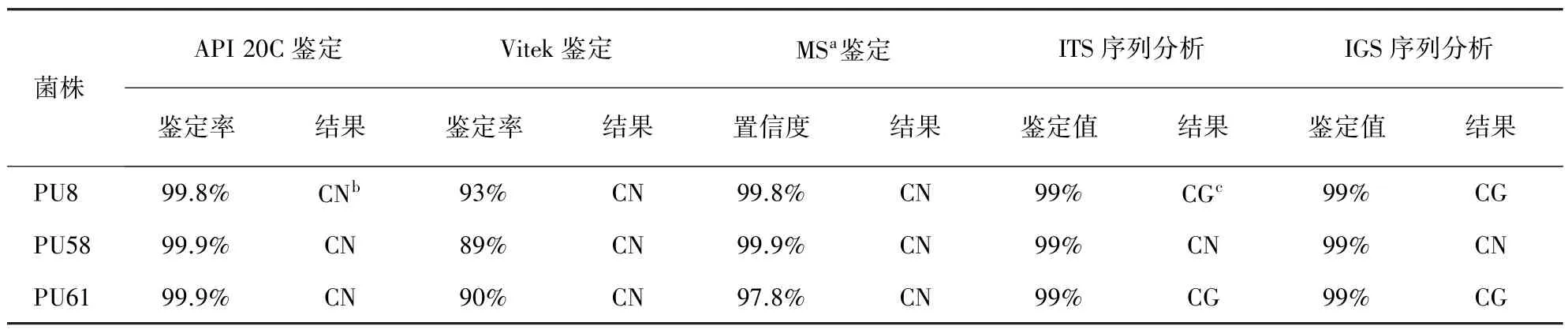
表1 PU8、PU58、PU61的常规方法及分子方法鉴定结果Tab.1 Identification results of conventional and molecular methods for PU8,PU58 and PU61
3 讨 论
格特隐球菌和新生隐球菌在临床可以引起脑膜炎、肺炎等多种感染,其诊断主要是依靠墨汁染色、组织病理、真菌培养及鉴定、隐球菌抗原检测等[6]。酵母菌的鉴定在临床实验室的鉴定主要依靠Chromagar显色培养基、API 20C、全自动微生物鉴定仪Vitek、Microscan等,然而对于新生隐球菌及格特隐球菌上述方法目前都是区分不开的,美国BD公司即将上市的BD PhoenixTM酵母菌鉴定板,同样不能区分新生隐球菌和格特隐球菌。McTag⁃gart L等[5]用CGB培养基试验了123株隐球菌,结果27株格特隐球菌中有25株(93%)使CGB培养基变为蓝色,其它隐球菌未使CGB培养基变为蓝色。Klein KR等[7]用CGB培养基测试了102株酵母菌,结果17株格特隐球菌全部使CGB培养基变为蓝色,54株新生隐球菌均未将CGB培养基变为蓝色,但有几株其他隐球菌使CGB培养基变为蓝色,其他酵母菌如1株近平滑念珠菌、1株阿萨希毛孢子菌和1株黏液毛孢子菌也使CGB培养基变了蓝色。本试验中PU8和PU61均使CGB培养基变为蓝色,两株菌经rDNA ITS和IGS序列分析均鉴定为格特隐球菌。总之,有必要在隐球菌的常规鉴定中借助CGB培养基区分新生隐球菌和格特隐球菌。我们分析格特隐球菌在临床上少见报到的原因一方面是该菌分布具有一定的区域性,但另一方面鉴定方法需要改进或补充试验,如rDNA ITS或(和)IGS序列测定能很好的鉴定区分新生隐球菌和格特隐球菌[5],测序成本目前也较为合理。从图3和图4可以看出PU8、PU58和PU61之间rD⁃NA ITS序列差异较小,而IGS序列差异较大,这也提示我们IGS序列相比ITS序列能够更好地区分新生/格特隐球菌。
基质辅助激光解析电离飞行时间质谱分析(Matrix⁃Assisted Laser Desorption Ionization⁃Time⁃of⁃Flight Mass Spectrometry,MALDI⁃TOF MS)近年来在微生物鉴定等方面发展迅速,在短短几分钟内就能将绝大多数微生物快速准确地鉴定到种的水平[8]。本试验中MALDI⁃TOF MS使用的是法国生物梅里埃公司产品,未能将两株格特隐球菌准确鉴定到种,提示该产品软件在新生隐球菌和格特隐球菌的区分能力上有待升级。德国布鲁克公司的MALDI⁃TOF MS能够较好的区分新生隐球菌和格特隐球菌,Firacative C等[9]使用德国布鲁克公司的MAL⁃DI⁃TOF MS不但准确区分了164株新生隐球菌和格特隐球菌,而且还对试验菌株进行了分子分型。
刘伟等[10]比较了 ATB FUNGUS 3与 CLSI M27⁃A2法对172株酵母菌临床分离株的抗菌活性,得出结论ATB FUNGUS 3与CLSI推荐的微量肉汤稀释法具有良好的一致性,20株新生隐球菌除了AMB有3株略有差异外,其余药物的MIC基本一致。Li M等[11]使用微量肉汤稀释法和ATB FUNGUS 3对52株新生隐球菌和9株格特隐球菌进行了药敏试验,结果显示不同种、不同基因型之间的体外药敏试验没有明显差异。本研究试验菌株较少,致使格特隐球菌的药敏结果不具代表性,有待进一步扩大样本数量。
新生隐球菌根据荚膜抗原不同被分为A、B、C、D和AD等5个血清型,依据分子生物学方法分类,新生隐球菌 (A、D和AD血清型)分为VNI、VNII、VNIII、VNIV和VNB等基因型,格特隐球菌(B和C血清型)分为VGI、VGII、VGIII和VGIV等基因型[12]。日本的隐球菌血清分型试剂已经停产,目前隐球菌的基因分型取代了其血清分型,基因分型更加准确并且有助于了解菌株之间基因差异以及地域的分布[13]。不同的基因型在流行病学,毒力特征,地理分布等方面均有所不同[1,6]。新生/格特隐球菌的基因分型现多采用多位点序列分型[14⁃15](MLST),MLST是国际人兽真菌协会推荐[16]的用于新生/格特隐球菌的基因分型方法,该方法分辨力高,重复性好,可实现实验室间的数据共享与比对,并且不需要标准菌株。本研究报道的分离自河北地区的格特隐球菌分子分型、毒力特征以及流行病学等特点还有待进一步研究。

图1 PU8(左)、PU58(中)及PU61(右)在Chromagar显色培养基35℃培养48 h 图2 PU8、PU58、PU61在CGB培养基上35℃培养5 d图3 PU8、PU58和PU61之间rDNA ITS序列比较 图4 PU8、PU58和PU61之间IGS序列比较Fig.1 Culture of PU8(left),PU58(middle)and PU61(right)on Chromagar at 35℃ for 48 h Fig.2 Culture of PU8,PU58 and PU61 on CGB at 35℃ for five days Fig.3 Comparision of sequences for rDNA among PU8,PU58 and PU61 Fig.4 Comparision of IGS sequences among PU8,PU58 and PU61
[1] Chaturvedi V,Chaturvedi S.Cryptococcus gattii:a resurgent fun⁃gal pathogen[J].Trends Microbio,2011,19(11):564⁃571.
[2] 陈敏,潘炜华,邓淑文,等.格特隐球菌感染病例临床特征分析[C].2012年中国菌物学会学术年会会议摘要,2012:88.
[3] Kwon⁃Chung KJ,Polacheck I,Bennett JE,et al.Improved diag⁃nostic medium for separation ofCryptococcus neoformansvar.neoformans(serotypes A and D)andCryptococcus neoformans var.gattii(serotypes B and C)[J].J Clin Microbiol,1982,15(3):535⁃537.
[4] Meyer W,Castañeda A,Jackson SZ,et al.Molecular typing of IberoAmericanCryptococcus neoformansisolates[J].Emerg In⁃fect Dis,2003,9(2):189⁃195.
[5] McTaggart L,Richardson SE,Seah C,et al.Rapid identification ofCryptococcus neoformansvar.grubii,C.neoformansvar.neo⁃formans,andC.gattiiby use of rapid biochemical tests,differen⁃tial media,and DNA sequencing[J].J Clin Microbiol,2011,49(7):2522⁃2527.
[6] Negroni R.Cryptococcosis.Clinics in dermatology[M].2012.
[7] Klein KR,Hall L,Deml SM,et al.Identification ofCryptococcus gattiiby use of L⁃canavanine glycine bromothymol blue medium and DNA sequencing[J].J Clin Microbiol,2009,47(11):3669⁃3672.
[8] Chen JH,Yam WC,Ngan AH,et al.Advantages of using matrix⁃assisted laser desorption ionization⁃time of flight mass spectrome⁃try as a rapid diagnostic tool for identification of yeasts and my⁃cobacteria in the clinical microbiological laboratory[J].Journal of clinical microbiology,2013,51(12):3981⁃3987.
[9] Firacative C,Trilles L,Meyer W.MALDI⁃TOF MS enables the rapid identification of the major molecular types within theCryp⁃tococcus neoformans/C.gattiispecies complex[J].PLos One,2012,7(5):e37566.
[10] 刘伟,乔建军,马彦,等.ATB FUNGUS 3与CLSI M27⁃A2微量液基稀释法测定酵母菌药物敏感性的一致性比较[J].中华检验医学杂志,2009,32(9):1034⁃1037.
[11] Li M,Liao Y,Chen M,et al.Antifungal susceptibilities of Cryp⁃tococcus species complex isolates from AIDS and non⁃AIDS pa⁃tients in Southeast China[J].Braz J Infect Dis,2012,16(2):175⁃179.
[12] Kwon⁃Chung KJ,Fraser JA,Doering TL,et al.Cryptococcus neo⁃formansandCryptococcus gattii,the etiologic agents of crypto⁃coccosis[J].Cold Spring Harbor perspectives in medicine,2014:doi:10.1101/cshperspect.a019760.
[13] Romeo O,Scordino F,Chillemi V,et al.Cryptococcus neofor⁃mans/Cryptococcus gattii species complex in southern Italy:an overview on the environmental diffusion of serotypes,genotypes and mating⁃types[J].Mycopathologia,2012,17(4):283⁃291.
[14] Cogliati M,Zamfirova RR,Tortorano AM,et al.Molecular epide⁃miology of Italian clinicalCryptococcus neoformansvar.grubiii⁃solates[J].Medical mycology 2013,51(5):499⁃506.
[15] Cogliati M.Global Molecular Epidemiology ofCryptococcus neo⁃formansandCryptococcus gattii:An Atlas of the Molecular Types[J].Scientifica,2013:doi:10.1101/cshperspect.a019760.
[16] Meyer W,Aanensen DM,Boekhout T,et al.Consensus multi⁃lo⁃cus sequence typing scheme for Cryptococcus neoformans and Cryptococcus gattii[J].Medical mycology,2009,47(6):561⁃570.
Clinical presentation and laboratory study for a case of cryptococcal meningitis caused by Cryptococcus gattii in Hebei province
DOU Hong⁃tao1,WAN Zhe2,YANG Qi⁃wen1,WANG Yao1,WANG He1,XIE Xiu⁃li1,LIU Juan1,LI Ruo⁃yu2,XU Ying⁃chun1
(1.Department of clinical laboratory,Peking Union Medical College Hospital,Chinese Academy Of Medical Sciences&Peking Union Medical College,Beijing 100730,China;2.Department of Dermatology,Peking University First Hospital,Research Center for Mycology,Peking University,Beijing 100034,China)
Objective To report a case of meningitis caused byCryptococcus gattiiin North China and related laboratory investi⁃gation.Methods The strain isolated from the patient mentioned above was inoculated on the Chromagar media and Canavanine⁃gly⁃cine⁃bromthymol blue(CGB)media at 35℃.API 20C AUX、Vitek 2 Compact、Matrix⁃Assisted Laser Desorption Ionization⁃Time⁃of⁃Flight Mass Spectrometry(MALDI⁃TOF MS)、ribosomal ITS and IGS sequence analysis were performed for identification.Antifungal susceptibility test was also performed with ATB FUNGUS 3.Results The color of the strain on the Chromagar media was colorless and slight pink.It turned the CGB media blue five days later.It was identified asCryptococcus neoformansby API 20C AUX、Vitek 2 Compact and MALDI⁃TOF MS.It was considered asCryptococcus gattiiby sequence analysis of genes of ribosomal ITS and IGS.The minimal inhibitory concentrations of 5⁃Flucytosine、AmphotericinB、Fluconazole、Voriconazole、Itriconazole against the isolate were≤4 μg/mL、≤0.5 μg/mL、≤1 μg/mL、≤0.125 μg/mL、≤0.06 μg/mL respectively.Conclusions CGB media、ribosomal ITS and IGS sequence analysis can discriminateCryptococcus gattiifromCryptococcus neoformans.CGB is an easy method to identifyC.gattii.I⁃solation and identification ofC.gattiineed to be paid more attention.
Cryptococcus gattii;Hebei province;CGB media;identification;sequencing;antifungal susceptibility test
R 519.4
A
1673⁃3827(2015)10⁃0011⁃05
2014⁃12⁃07
[本文编辑] 施 慧
首都临床特色应用研究(Z141107006614006)
窦红涛,男(汉族),硕士,副主任技师.E⁃mail:hongtaodou@sina.com
徐英春,E⁃mail:xycpumch@139.com
