预测:2016年美国FDA即将批准新药概述
2015-12-03孙友松
孙友松
预测:2016年美国FDA即将批准新药概述
孙友松
2015年全年美国FDA共批准45个新分子实体和新生物制品,本文列出了2016年可能获FDA批准的新药目录,并对具体批准日期进行了预测。
新药批准;预测;新分子实体;新生物制品
为了帮助制药企业及研究机构研发人员从宏观把握国际上新药审评审批的发展趋势以及适应证领域的全球进展与未来竞争情况,笔者根据药物的FDA受理时间、审评资格、审评进度及临床研究结果等情报,对2016年美国FDA可能获批的新药进行了批准时间和适应证的预测分析。
1 2016年度即将获批的药物
2006—2014年,美国FDA平均每年批准28个新分子实体和新生物制品,2015年全年美国FDA共批准45个新分子实体和新生物制品,创近十年新高,预计未来几年批准数量会保持平稳甚至小幅回落。2016年即将到来,众多重磅炸弹级别药物也即将揭开神秘面纱。表1共列出86个可能在2016年获批的新药。
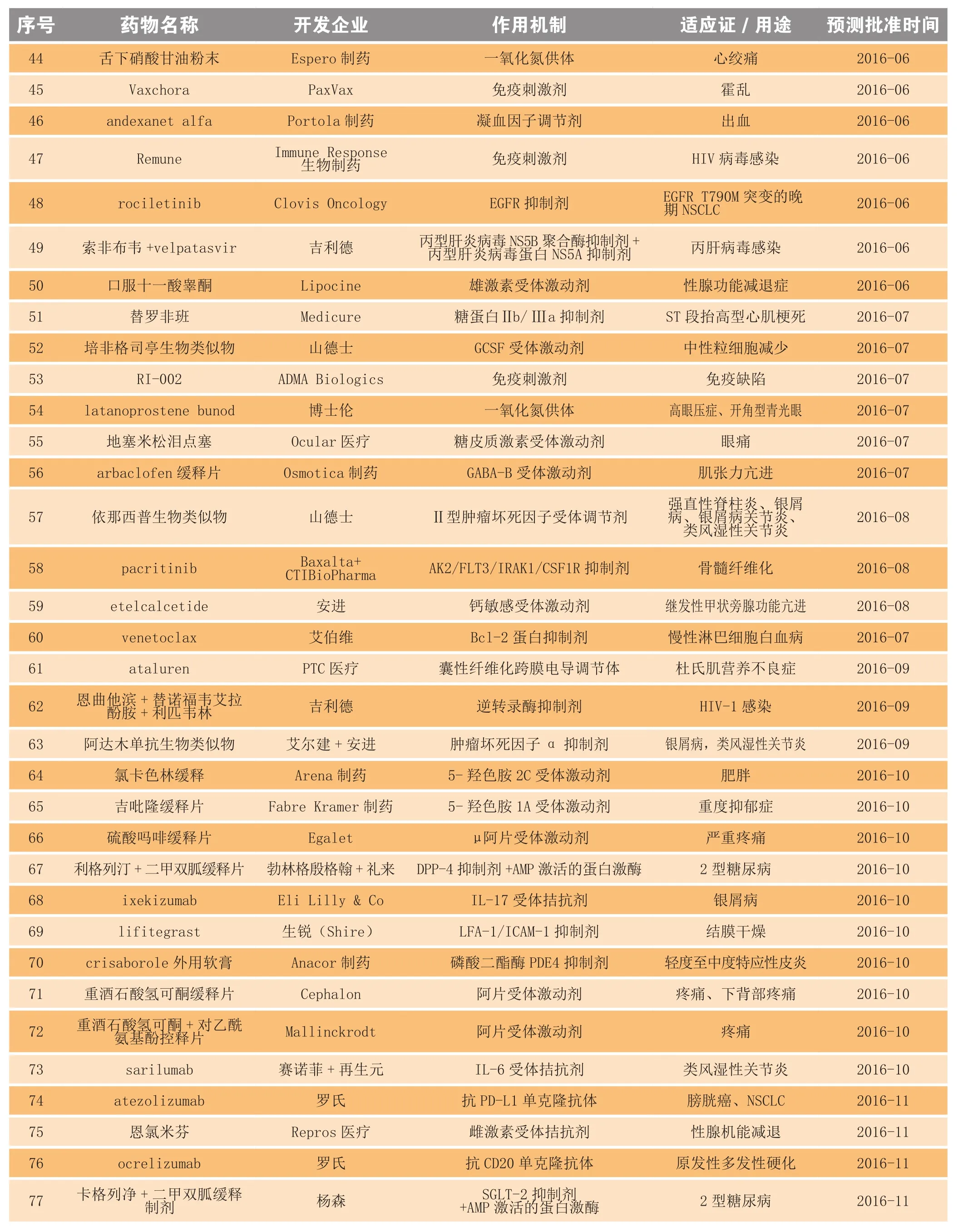
续表1
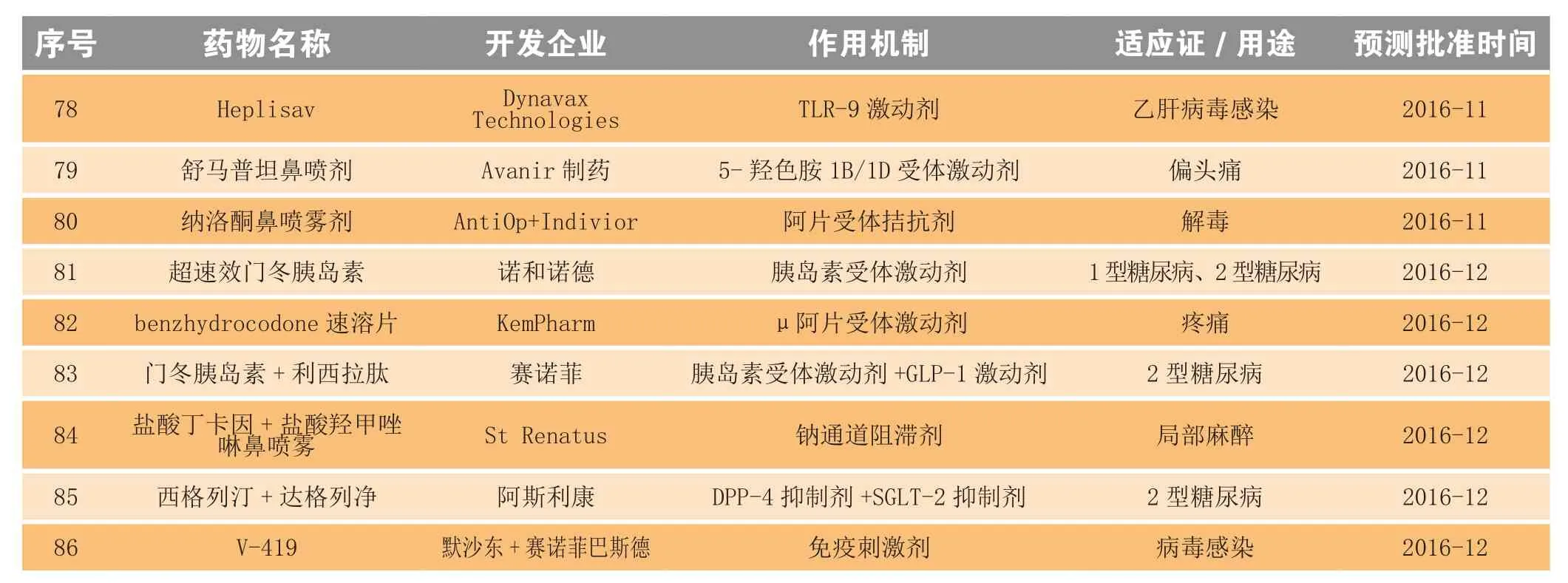
续表1
2 2016年度备受瞩目的新药
2015年度,诺华公司的心衰药物LCZ 696、安进公司的PCSK9抑制剂evolocumab、赛诺菲公司的PCSK9抑制剂alirocumab、Alkermes制药公司的精神分裂治疗药物月桂酰阿立哌唑、勃林格殷格翰公司的抗凝药物达比加群酯解毒剂Praxbind、安进公司的溶瘤病毒疗法T-vec、Sprout制药公司的女性性欲低下失调药物氟班色林、基因泰克公司的MEK抑制剂cobimetinib、阿斯利康公司的EGFR抑制剂osimertinib和武田公司的口服蛋白酶体抑制剂Ixazomib可谓是2015年度最受关注的药物,而2016年热点话题药物数量相比2015年略有减少,以下列出2016年最能吸引眼球的新药。
2.1 atezolizumab
Atezolizumab是一种全人源化抗程序性死亡配体-1(PD-L1)单克隆抗体,由罗氏公司开发,药物开发代号MPDL3280A。同类药物中,阿斯利康公司已明确表示durvalumab不再作为单药开发,而德国默克公司的avelumab于2015年年末进入Ⅲ期临床研究,atezolizumab有望赶在avelumab和durvalumab之前上市,成为首个抗PD-L1单抗药物,预测该药获批适应证主要有膀胱癌和NSCLC。
2.2 nivolumab+伊匹木单抗
Nivolumab是一种全人源化抗PD-1单克隆抗体,由百时美施贵宝公司开发,商品名Opdivo®。该药是历史上首个获得批准的抗PD-1单克隆抗体,最早于2014年7月在日本获批,用于治疗不可切除或转移性晚期恶性黑色素瘤。2015年是nivolumab绽放光彩的一年,FDA在一年内共批准6次sNDA,其相继在黑色素瘤、NSCLC、肾细胞癌等疾病治疗领域取得重大突破,也成为了肿瘤免疫与小分子药物联用的首选和标配。预测该药将获准用于一线治疗晚期黑色素瘤。
默沙东公司未能赶在肿瘤免疫领域早期布局,pembrolizumab也一直比nivolumab慢半拍。目前nivolumab已获批准用于晚期鳞状/非鳞状NSCLC二线及以上疗法、单用一线治疗BRAF野生型黑色素瘤、联合依匹木单抗用于野生型BRAF(V600)突变不可切除或转移性黑色素瘤,而pembrolizumab已获批准用于一线治疗晚期黑色素瘤(且无论是否BRAF突变)、二线治疗PD-L1表达的NSCLC。总体看来两药目前差距不大,由于Keynote-042研究总生存期数据未公布,pembrolizumab暂时处于劣势。今后,nivolumab和pembrolizumab竞争的主战场将转移到肿瘤免疫联用领域。
2.3 奥贝胆酸
奥贝胆酸的持续火热让Intercept制药公司名声大噪,非酒精脂肪肝(NASH)领域目前尚无有效疗法,欧美近20%人群患有该疾病,将成为继丙肝后肝病领域又一主要市场。非酒精脂肪肝的主要发病原因是肥胖,由于人们生活方式的改变,非酒精性脂肪肝的发病率呈逐年上升态势,是发达地区和富裕阶层的常见病,甚至在我国有超越乙肝成为发病率最高慢性肝病的趋势。
奥贝胆酸是Intercept制药公司近40亿美元市值的主要资产,公司尚无上市药物。2015年Intercept制药公司向FDA递交奥贝胆酸用于治疗原发性胆汁性肝硬化(PBC)的上市申请,并启动了近2 500名非酒精脂肪肝患者参加的名为REGENERATE的Ⅲ期临床研究,研究结果预计于2017年中期公布。
为了审评补充的临床数据,FDA已经延长一次PDUFA日期,奥贝胆酸获批治疗原发性胆汁性肝硬化几乎已是板上钉钉,但其用于非酒精脂肪肝的Ⅲ期临床研究漫长,仍有很多不确定因素,最终能否获批还要看进一步的临床研究结果。
2.4 杜氏肌营养不良症治疗药物
杜氏肌营养不良症(DMD)亦称假肥大型肌营养不良症,在2015年各大医药媒体频繁露面。该领域目前主要有3个药物竞争,分别是BioMarin制药公司的drisapersen、Sarepta医疗公司的eteplirsen和PTC医疗公司的ataluren。
Drisapersen与eteplirsen的作用机制相同,都是反义核酸药物。FDA咨询委员会曾对drisapersen安全性表示担忧,也未能在PDUFA日期完成审评,但FDA咨询委员会最终还是建议批准该药。对于Eteplirsen,将在2016年1月22日召开咨询委员会,PDUFA日期2016年2月26日。FDA延迟drisapersen审评时间的原因可能是在等待针对eteplirsen的咨询委员会结果,如果eteplirsen劣于drisapersen,不被FDA咨询委员会推荐,drisapersen顺理成章会被批准。但最终结果还是要等到2016年1月底方能见分晓。最先获得FDA批准的药物还会获得一张价值近4亿美元的优先审评券,对于罕见疾病药物开发商,这张优先审评券的价值甚至可能超过药物销售年利润。
若反义核酸类DMD治疗药物drisapersen和eteplirsen均未被FDA认可,PTC医疗公司的囊性纤维化跨膜电导调节体ataluren甚至有机会拿到该优先审评券。Ataluren是目前唯一已上市的DMD药物,在欧洲部分国家获批。
2.5 替诺福韦艾拉酚胺复方
替诺福韦艾拉酚胺(TAF)复方药中,恩曲他滨+替诺福韦艾拉酚胺和恩曲他滨+替诺福韦艾拉酚胺+利匹韦林值得关注,两种产品即将批准的适应证均为HIV-1感染。
替诺福韦艾拉酚胺(TAF)是逆转录酶抑制剂替诺福韦(TDF)的前药,由吉利德公司开发,该类产品主要以复方为主,包括埃替格韦+cobicistat+恩曲他滨+替诺福韦艾拉酚胺(E/C/F/TAF)、利匹韦林+恩曲他滨+替诺福韦艾拉酚胺(R/F/TAF)、恩曲他滨+替诺福韦艾拉酚胺(F/TAF)、地瑞拉韦+cobicistat+恩曲他滨+替诺福韦艾拉酚胺(D/C/F/TAF)以及GS-9883+恩曲他滨+替诺福韦艾拉酚胺(GS-9883/F/TAF)多个复方,其中E/C/F/TAF已于2015年11月5日获批。
与替诺福韦相比,替诺福韦艾拉酚胺有更好的骨骼和肾脏安全性,有望替代替诺福韦。未来替诺福韦艾拉酚胺在抗HIV药物领域和抗乙肝药物领域市场潜力巨大。
2.6 复方grazoprevir+elbasvir
自2011年以来,丙肝治疗领域经历了几次跨越式发展,先是福泰制药公司的特拉匹韦和默沙东公司的波普瑞韦,2013年吉利德公司索非布韦上市将治愈丙肝引入大众视野,2014年吉利德公司鸡尾酒疗法Harvoni和艾伯维公司鸡尾酒疗法Viekira Pak更是成为丙肝治疗市场的两匹黑马,丙肝治疗领域进入发展高潮,消除丙肝疾病指日可待。
百时美施贵宝公司复方达卡他韦+asunaprevir、Viekira Pak、Harvoni和默沙东公司的复方grazoprevir/ elbasvir先后获得FDA突破性疗法认定资格。在Harvoni和Viekira Pak获得批准后,FDA撤销了复方达卡他韦+asunaprevir和复方grazoprevir+elbasvir两药的突破性疗法认定资格,但2015年4月默沙东公司的复方产品又失而复得该资格。
相比于Harvoni和Viekira Pak,复方grazoprevir+ elbasvir作为第3个丙肝鸡尾酒疗法的优势有限,虽然多了基因6型丙肝适应证,但复方grazoprevir+elbasvir上市时间晚了1年多,市场挑战依然严峻。默沙东公司未来可能采取的价格战策略也会对Harvoni和Viekira Pak构成严重威胁,中低收入患者市场开发也是突破口之一。
2.7 rociletinib
2014年,阿斯利康公司的AZD-9291(osimertinib)和Clovis Oncology公司的CO-1686(rociletinib)之争备受医药行业关注。第1代EGFR抑制剂如吉非替尼、第2代EGFR抑制剂如阿法替尼使用后10至12个月常会出现T790M耐药突变。Osimertinib和rociletinib都是第3代EGFR抑制剂,EGFR T790M突变的晚期NSCLC患者使用后,其无进展生存期有近10个月。这意味着一线使用第1代或第2代EGFR抑制剂后如产生T790M突变,还可二线使用第3代EGFR抑制剂,使患者总的无进展生存期可延长近1倍。
2015年11月13日FDA率先批准阿斯利康公司的osimertinib,对于rociletinib来说失去了市场先机。随后在Clovis Oncology公司与FDA中期会晤上,FDA要求Clovis Oncology公司提供rociletinib两种规格(500和625 mg)产品更详尽的有效性分析数据,原定的PDUFA日期也延迟3个月,增加了很多不确定性。市场风险增高及审评进度扑朔迷离,让投资者信心大减,导致Clovis Oncology股价1天内缩水近70%。未来rociletinib如果还想再扳回一局,只能凭借过硬的临床疗效了。
3 结语
本文对2016年FDA即将批准药物进行了预测,供读者参考,相关药物的最终实际批准时间还要由审评进度及临床研究结果等因素决定。今后,笔者还将对药物临床研究结果公布时间,药物临床研究成功率,未来FDA、EMA可能授予的药物审评资格,以及相关适应证市场的竞争格局等多方面情报进行预测分析,旨在为企业战略制定者提供研发策略、风险控制策略方面的参考。
Forecasting: an Overview of New Drugs to be Approved by FDA in 2016
SUN Yousong
Calender year 2015 witnessed the approval of 45 new molecular entities (NMEs) and biologics by US Food and Drug Administration(FDA). In this article, we listed new drugs likely to be approved by FDA in 2016 and forecasted their approval dates.
drug approval; forecast; new molecular entity; new biologics
R97
A
1001-5094(2015)12-0956-05
