灰毡毛忍冬对LPS诱导RAW264.7巨噬细胞炎症因子的影响
2015-12-02白仲杰任群利俸婷婷
白仲杰,任群利,俸婷婷,赵 致,周 英,林 冰*
(1.贵州大学贵州省中药民族药创制工程中心,贵州 贵阳 550025;2.贵州省药食同源植物资源研究开发中心,贵州 贵阳 550025)
灰毡毛忍冬 Lonicera macranthoides Hand-Mazz.属于忍冬科忍冬属常绿藤本植物,《中国药典》2005年版一部将其作为新收载品种,与红腺忍冬、华南忍冬一同列入新增的山银花项下[1-2]。主要含绿原酸、木犀草素等成分,具有清热解毒、抗菌消炎的功效。被广泛应用于痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温热发病等疾病的治疗[3-5]。在2005与2010年版《中国药典》中,山银花与金银花药用部位、性味归经、功能主治和用法用量都完全一致。
炎症反应作为众多疾病的一个早期反应,在疾病的发生发展中占有着重要的位置,而巨噬细胞则是调节炎性疾病的一个靶细胞,当免疫系统受到自身抗体或者特殊抗原的刺激时,巨噬细胞释放各种炎症因子和趋化因子,如白介素(interleukin,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF- α)、前列腺素 E2(prostaglandin E2,PGE2)等[6],引起细胞因子网络平衡失调,在炎症过程中起着重要的作用。目前关于山银花对炎症因子的调控作用的研究较少。本实验通过脂多糖(LPS)刺激RAW264.7小鼠巨噬细胞系建立炎症细胞模型,测定灰毡毛忍冬不同极性萃取部位对该炎症模型细胞中炎症因子分泌量的影响,从细胞水平研究灰毡毛忍冬抗炎活性,为研究灰毡毛忍冬的抗炎活性及其作用机制提供理论和实验依据。
1 材料与仪器
1.1 细胞
RAW264.7细胞系购自中国科学院昆明动物研究所细胞库。
1.2 试剂与药材
供试药材灰毡毛忍冬来自于贵州,经鉴定为忍冬科忍冬属灰毡毛忍冬的花。а-MEM培养基、胎牛血清(fetal calf serum,FCS)、PBS、L- 谷氨酰胺、二甲基亚砜(DMSO)、脂多糖(LPS)、ELISA试剂盒(sigma)、地塞米松(sigma)。
1.3 仪器
高效液相色谱仪(安捷伦科技有限公司,1260);旋转蒸发仪(上海亚荣生化仪器公司,RE-52AA);真空干燥箱(BZF-50 VACUUM OVEN);电子天平(FA1004);循环水式多用真空泵(GZX-9146MBE);低速大容量离心机(Heal Force Neofμge23R);CO2培养箱(3111,Thermo Fisher Scientific),倒置荧光显微镜(XD20-RFL,宁波舜宇仪器有限公司),超净工作台(SW-CJ-1FD,苏州净化设备有限公司);酶标仪(1510,Thermo Fisher Scientific)。
2 方法
2.1 灰毡毛忍冬不同极性萃取部位的制备
取灰毡毛忍冬过2号筛粉末20 g,按1∶10的料液比加入200 mL 75%甲醇回流提取两次,每次2 h,过滤后合并滤液,于旋转蒸发仪上浓缩成浸膏状。然后加入200 mL蒸馏水溶解制成混悬液,依次加入100 mL石油醚、二氯甲烷、乙酸乙酯、水饱和的正丁醇萃取,连续萃取2次,萃取剩余部分为水部分,回收各部位萃取溶剂于旋转蒸发仪上蒸干,再于真空干燥箱内烘干。最终依照极性大小顺序得到水、水饱和的正丁醇、乙酸乙酯、二氯甲烷、石油醚等5个萃取部位样品粉末。将5个萃取部位样品粉末用DMSO溶解后,于实验前用а-MEM培养液分别配制成浓度为100、200、400 μg/mL的样品溶液。
2.2 RAW 264.7细胞培养
小鼠单核巨噬细胞系 RAW 264.7细胞在37℃、5%CO2条件下,用含10%胎牛血清的 α-MEM培养基培养,2天换一次培养基,至对数生长期备用。
2.3 不同极性萃取部位对RAW 264.7细胞活性的影响
采用MTT法检测不同极性萃取部位对RAW264.7细胞活性的影响。待RAW264.7细胞生长至对数期后,加1 mL 0.25%胰酶消化40 s,再加入3 mLα-MEM培养基吹打消化,调整细胞密度为8×105mL-1,接种于96孔细胞培养板,每孔定容 100 μL。于37℃、5%CO2条件培养4 h 后,每孔加100 μL配制好的浓度分别为100、200和400 μg/mL的五个萃取部位的样品溶液,同时设立正常组(只加细胞和培养基)、LPS组(加入LPS刺激)和调零孔(不加细胞,只加培养基),每组设3个复孔,同时每孔加100 μL浓度为 10 μg/mL的LPS刺激,于37℃、5%CO2条件下培养72 h加入20 μL浓度为5 mg/mL MTT溶液,37℃培养4 h后,小心吸取上清液,加入150 μL的DMSO,充分震荡使结晶溶解后,于570 nm下测各孔的OD值,并计算细胞相对增殖率[7]。
细胞相对增殖率(%)=(实验孔-调零孔)/(对照孔-调零孔)×100%
2.4 ELISA法检测不同极性萃取部位对IL-6和TNF-α的抑制作用
待RAW264.7细胞生长至对数期后,加1 mL 0.25%胰酶消化40 s,再加入3 mL α-MEM培养基吹打消化,调整细胞密度为8×105mL-1,接种于96孔细胞培养板,每孔定容100 μL。于37℃、5%CO2条件培养4 h后,每孔加100 μL配制好的浓度分别为100、200和400 μg/mL的五个萃取部位的样品溶液,同时设立正常组、LPS组、地塞米松组(20 μg/mL)和调零孔,每组设3个复孔,同时每孔加100 μL浓度为10 μg/mL的 LPS刺激,于37℃、5%CO2条件下培养48 h后按照ELISA试剂盒说明书操作,检测IL-6和TNF-α的表达量。
3 结果
3.1 不同极性萃取部位对RAW264.7细胞活性的影响
五个萃取部位对RAW264.7细胞相对增殖率的影响见表1。细胞毒性分级[8]见表2。

表1 五个极性萃取部位对RAW264.7细胞相对增殖率的影响(x- ± s,n=3)Tab.1 The effect of concentrations of five extraction parts with different polarities on the RGR of RAW264.7 cell(x-±s,n=3)

表2 细胞相对增殖率和细胞毒性分级Tab.2 Relative cell proliferation rate and cell toxicity grading

表3 五个极性萃取部位对RAW264.7细胞毒性分级Tab.3 Five polar extraction parts on the toxicity grading of RAW264.7 cell
由表1、2、3可知,五个萃取部位不同浓度(100、200、400 μg/mL)作用 RAW 264.7 细胞72 h,与正常组比较,水部位和水饱和正丁醇部位(200、400 μg/mL)对细胞的活力有一定的抑制,其细胞毒性分级为1,并且有浓度依赖性。而水饱和正丁醇部位(100 μg/mL)和其它组在此浓度下对细胞活力无抑制作用。说明在大的极性萃取部位,所含的多种化学成分对于RAW264.7细胞有相对较大的抑制作用。
3.2 IL-6标准曲线的建立
IL-6标准曲线绘制结果见图1。

图1 IL-6标准曲线Fig.1 IL-6 standard curve
由图1可知,OD值在IL-6浓度为15 ng/L到480 ng/L范围之间的线性关系良好,回归方程为y=285.71x-51.26,相关系数R2=0.993 8。
3.3 TNF-α标准曲线的建立
TNF-α标准曲线绘制结果见图2。
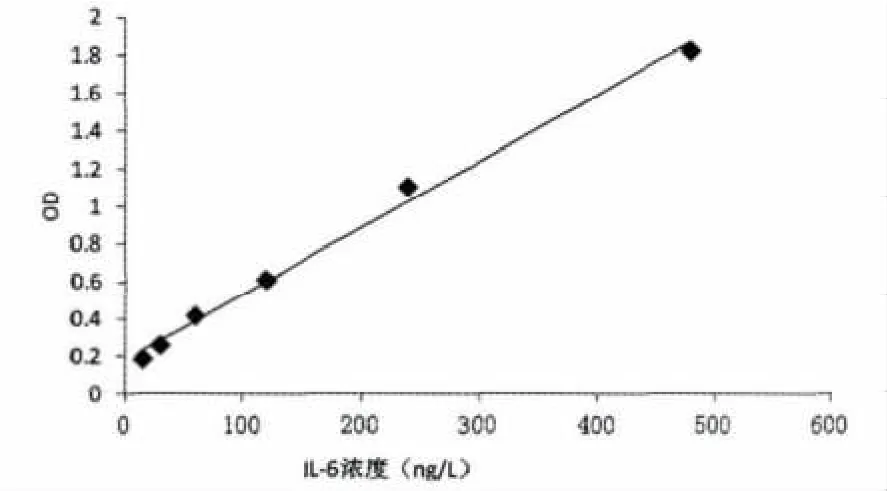
图2 TNF-α标准曲线Fig.2 TNF-αstandard curve
由图2可知,OD值在TNF-α浓度为20 ng/L到640 ng/L范围之间的线性关系良好,回归方程为y=357.14x-66.86,相关系数R2=0.993 3。
3.4 不同极性萃取部位对IL-6和TNF-α的表达量的影响结果
五个部位、三个样品浓度对RAW264.7细胞炎症模型中IL-6和TNF-α的表达量的测定结果见表4和表5。表中IL-6和TNF-α的表达量用±s(ng/L)表示,组间的显著性差异用one-way ANOVA显著性分析。
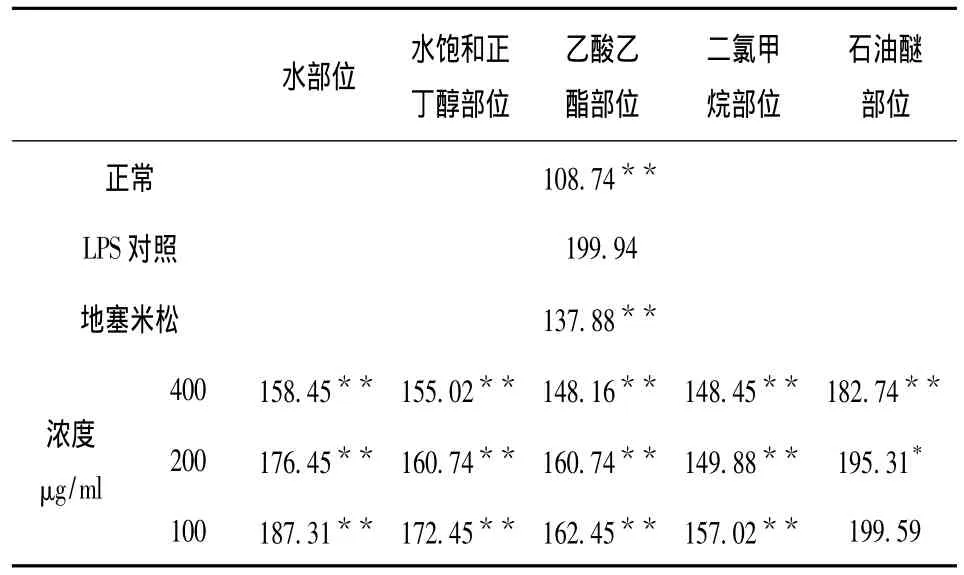
表4 五个极性萃取部位不同样品浓度对IL-6表达量的影响(x- ± s,n=3)Tab.4 The effect of concentrations of five polar extraction parts on the expression of IL-6(x- ± s,n=3)
由表4可知,LPS对照组IL-6的表达量极显著性高于正常组的表达量,P<0.01;同时与LPS对照组IL-6表达量199.94 μg/mL相比,地塞米松组IL-6 表达量为137.88 μg/mL,P <0.01,说明地塞米松对IL-6表达量有极显著地抑制作用;各个萃取部位中,除了石油醚部位(100 μg/mL)对IL-6表达量没有显著性的抑制作用外,石油醚部位(200 μg/mL)对IL-6表达量有显著性的抑制作用,P<0.05;其它各个部位对IL-6表达量均有极显著地抑制作用,P<0.01,并且其抑制作用都有浓度依赖性。相比较而言,其中以乙酸乙酯部位和二氯甲烷部位对IL-6表达量的抑制作用最为明显。
由表5可知,LPS对照组TNF-α的表达量极显著性高于正常组的表达量,P<0.01;同时与LPS对照组TNF-α表达量200.96 μg/mL相比,地塞米松组 TNF-α表达量156.98 μg/mL,P<0.01,说明地塞米松对TNF-α表达量有极显著地抑制作用;各个萃取部位中,除了水部位(100 μg/mL)对TNF-α表达量没有显著性的抑制作用外,其它各个部位对IL-6表达量均有极显著地抑制作用,P<0.01,并且其抑制作用都有浓度依赖性。相比较而言,其中以水饱和正丁醇部位和乙酸乙酯部位对TNF-α表达量的抑制作用最为明显。

表5 五个极性萃取部位不同样品浓度对TNF-α表达量的影响(x- ± s,n=3)Tab.5 The effect of concentrations of five polar extraction parts on the expression of TNF-α(x-±s,n=3)
4 讨论
4.1 RAW264.7细胞作为一种巨噬细胞,受到脂多糖外界刺激后能够启动体内炎症介质产生,并启动机体抵抗炎症系统的功能[9]。RAW264.7细胞在受到LPS刺激后,通过脂多糖结合蛋白 CD14受体和Toll样受体4等信号转导途径,激活转录因子细胞核因子κB(NF-κB)和活化蛋白-1,引起各种细胞因子和炎症介质的过度表达,触发机体内的炎症瀑布连锁反应,进一步引起全身炎症反应综合征[10]。
4.2 本实验选择RAW264.7细胞作为研究对象,采用LPS刺激,建立炎症模型以研究灰毡毛忍冬各个极性萃取部位对炎症因子的调控。经LPS刺激后,炎症因子IL-6和TNF-α的表达量明显上调,表明此炎症细胞模型成功构建。在应用灰毡毛忍冬各个极性萃取部位后,可以剂量依赖性的抑制炎症因子IL-6和TNF-α的表达,说明灰毡毛忍冬各个极性萃取部位均可通过抑制炎症因子参与炎症反应的过程。
4.3 在此次实验之前,本课题组对NO的表达也进行了研究,发现灰毡毛忍冬各个极性萃取部位对NO的表达有明显的剂量依赖性和萃取部位的极性依赖性。表明灰毡毛忍冬各个极性萃取部位可以通过调控炎症因子NO、IL-6和TNF-α的表达而参与炎症反应的过程。已知在巨噬细胞系统中有众多的信号通路和炎症介质参与炎症反应,如通过抑制信号通路 CD14[11]、PKC[12]、NF- κB[13]、AP-1等多层次、多靶点调控IL-6、TNF-α和IL-β等炎症介质的表达,从而发挥抗炎作用。灰毡毛忍冬中含有多个化学成分,其抗炎功效的具体有效成分,以及其保护作用是否涉及其他的分子作用机制,还有待继续研究。
[1]中华人民共和国药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2005:21.
[2]中华人民共和国药典委员会.中华人民共和国药典[S].一部.北京:化学工业出版社,2010:28.
[3]苏香萍,宋必卫,陈振华,等.CO2超临界萃取金银花挥发油工艺及抗炎活性研究[J].天然产物研究与开发,2006,18(4):663-666.
[4]王朝晖,童巧珍,周日宝,等.湘蕾一号金银花花蕾中挥发油组分的研究[J].湖南中医学院学报,2006,26(1):18-20.
[5]刘光海.金银花多糖的提取精制及含量测定[J].湖南中医药大学学报,2009,29(11):33.
[6]代艳文,袁 丁,万静枝,等.竹节参总皂苷通过NF-κB通路对LPS致RAW264.7细胞炎症的保护作用研究[J].中国中药杂志,2014,39(11):2 076-2 080.
[7]吴秀荣,梅全喜,杨 华,等.白木香叶提取物对LPS诱导RAW264.7巨噬细胞炎症因子的影[J].今日药学,2012,22(8):471-473.
[8]谢 勇,曾建伟,郑燕芳,等.基于炎症细胞模型的草珊瑚抗炎活性筛选[J].福建中医药大学学报,2010,20(5):35-38.
[9]MANIMTIM W M,HASDAY J D,HESTE R L,et al.Ureaplasma urealyticum modulates endotoxin-induced cytokine release by human monocytes derived from preterm and term newborns and adults[J].Infect Immun,2001,69(6):3 906-3 915.
[10]YAN G F,CONTOIS A S,FAN G L,et al.Nitric oxide derived nitrate anion contributes to endotoxic shock and multiple organ injury[J].Crit Care B,Actin Med,2002.30(3):650-654.
[11]Li S J,Cong B,Yan Y L,et al.Cholecystokinin octapeptide inhibits the in vitro expression of CD14 in rat pulmonary interstitial macrophages induced by lipopolysaccharide[J].Chin Med J,2002,115(2):276-279.
[12]Xu S J,Gao W J,Cong B,et al.Effect of cholecystokinin octapeptide on diacylglycerol-PKC signaling pathway in rat pulmonary interstitial macrophages induced by lipopolysaccharide[J].Acta Phamacol Sin,2005,26(12):1 497-1 504.
[13]Li S J,Yao Y X,Zhu G J,et al.Cholecystokinin octapeptide inhibits tumor necrosis factor- α transcription and nuclear factor- κB activity induced by lipopolysaccharide in rat pulmonary interstitial macrophages[J].Chin J Pathophysiol,2004,20(8):1 335-1 339.
