火龙果UQT和18s rRNA内参基因片段的克隆及表达分析
2015-12-02文晓鹏
罗 霞,文晓鹏
(1.贵州大学贵州省农业生物工程研究院,贵州 贵阳 550025;2.贵州大学生命科学学院,贵州 贵阳 550025;3.贵州大学山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳 550025)
基因表达分析技术在转录水平进行基因表达定量分析时,通常使用看家基因(housekeeping genes)作为内参基因(reference genes)对目标基因(target gene)表达量进行校正[1],以期获得真实可靠的结果。UQT基因和18s rRNA基因在核苷酸上具有高度的保守性和同源性,并在各种组织中表达相对恒定,因而,常被作为研究其他基因的表达模式及调控机制的分子内标[2,3]。
火龙果(Hylocereus undatus)是近年来广泛关注的一种新兴热带亚热带果树,具有很高的经济价值[4]。樊庆杰等[5]研究表明,火龙果的抗旱基因资源尤其丰富。深入探讨这些基因的表达调控规律需要内参基因作为数据标准化的对照。本文采用同源克隆法从火龙果中克隆了UQT和18s rRNA基因片段并分析其表达,为了解基因调控表达的复杂网络奠定基础。
1 材料与方法
1.1 材料
供试材料为培养70 d后的红龙果、红龙、B7(白肉种质1)、B4(白肉种质2)和紫红龙,以及干旱胁迫处理的紫红龙组培苗的茎段。
1.2 方法
1.2.1 干旱胁迫处理 用10%PEG处理生根紫红龙组培苗24 h、3 d、5 d、7 d和10 d。采集茎段,液氮速冻后置-80℃的超低温冰箱保存。
1.2.2 总RNA提取和反转录 用Trizol(天根生化科技有限公司,DP405)试剂提取保存的火龙果茎段总RNA,对提取的总RNA进行琼脂糖凝胶电泳和紫外分光光度检测。按照Quant cDNA第一链合成试剂盒(天根生化科技有限公司,KR103)说明书操作进行cDNA第一链的合成。
1.2.3 引物设计 根据GenBank中已报道的植物UQT和18s rRNA基因序列,运用Premier 5.0软件、DNAMAN分析软件及BLAST程序,设计了2对扩增保守区的引物。UQT基因的引物 U1,5’-GATTTATTTCATTGGCAGGC-3’和 U2,5’-AGGATCATCAGGATTTGGGT-3’,其目的片段为270 bp;18s rRNA基因的引物为S1,5’-TTAGGCCATGGAGGTTTCTCA-3’和 S2,5’-GAGTTGATGACACGCGCTTA-3’,其目的片段为209 bp。引物合成由上海生工生物技术公司完成。
1.2.4 RT-PCR扩增UQT基因和18s rRNA基因
PCR扩增体系都采用60 ul反应体系:2xMaster Mix 30 μl,ddH2O 21 μl,primer1 为 3 μl,primer2 为3 μl,cDNA 为 3 μl。UQT 基因扩增条件:94℃ 预变性4 min;94℃变性30 s;58℃退火30 s;72℃延伸1 min,35个循环,最后72℃延伸7 min。18s rRNA基因扩增条件:94℃预变性4 min;94℃变性30 s;55℃退火30 s;72℃延伸90 s,30个循环;最后72℃延伸10 min。
1.2.5 序列的生物信息学分析 应用NCBI(http://www.ncbi.nlm.Gov)中的ORFfinder程序进行开放阅读框(ORF)分析并将其推导为相应的氨基酸序列。通过BLAST工具进行核酸序列相似性检索,应用DNAman进行比对结果生成系统进化树。
1.2.6 基因表达分析 使火龙果内参基因UBQ和Actin基因为阳性对照,对5份火龙果种质以及其中一份红龙果材料在干旱胁迫处理下的表达特性进行分析。
2 结果与分析
2.1 总RNA的提取
琼脂糖凝胶电泳图和核酸定量检测显示,RNA电泳图谱带型清晰。28s rRNA的亮度约为18s rRNA度的2倍,OD值均在1.8~2.0 mg/L。由此可见,RNA样品的完整性较好,无明显降解,可以用于进行后续试验。
2.2 内参基因的RT-PCR扩增
以总RNA反转录所得到的第一链cDNA为模板,分别进行UQT基因和18s rRNA基因RT-RNA扩增。扩增产物经凝胶电泳检测发现,分别在约271 bp和209 bp处有1条特异条带,该序列与预测的目的片段大小相符(图1)。
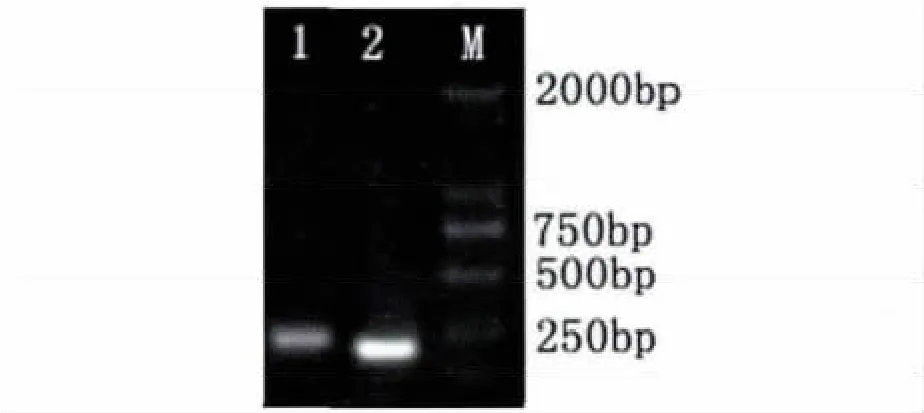
图1 火龙果UQT基因和18s rRNA基因的扩增Fig.1 Amplification of genes UQT and 18s rRNA from pitaya
2.3 序列分析
经测序和序列分析,结果表明(图2,图3),271 bp的UQT基因编码87个氨基酸序列。且UQT基因的序列和18s rRNA基因的序列与其他植物的UQT基因核苷酸序列的同源性分别为94% ~98%和98%~99%。因此推断,所克隆得到的片段分别为UQT和18s rRNA基因片断。将克隆得到的内参基因分别命名为HuUQT和Hu18s rRNA。
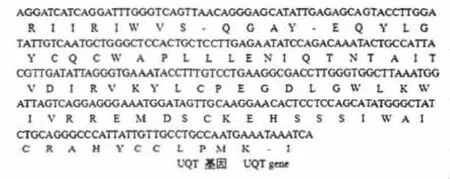
图2 UQT基因的cDNA序列及推定氨基酸序列Fig.2 cDNA sequence and amino acid sequence of UQT gene

图3 HuUQT(A)和Hu18s rRNA(B)与其它植物UQT和18s rRNA的核苷酸序列同源性分析Fig.3 Nucleotide sequence homology analysis of HuUQT and Hu18s rRNA with gene HuUQT and Hu18s rRNA of other plants
2.3 内参基因的表达分析

图4 HuActin、HuUBQ、HuUQT 和 Hu18S rRNA在火龙果不同种质的表达模式Fig.4 Expression patterns of HuActin,HuUBQ,HuUQT and Hu18S rRNA in different cultivars of pitaya
研究选择了5份不同种质的火龙果和在干旱胁迫下的紫红龙。对RT-PCR分析发现,UQT基因和18s rRNA基因与目前研究中常用的HuUBQ和HuActin基因在不同种质中均能一致性表达(图4),说明本次克隆的2个基因适用于火龙果种质之间差异的研究;且UQT基因和18s rRNA基因在干旱胁迫的表达也均一致(图5),表明这2个基因在分析火龙果抗逆基因表达模式时是合适的,且18s rRNA基因的表达稳定性较优于其余3个内参基因的表达稳定性。

图5 HuActin、HuUBQ、HuUQT 和 Hu18S rRNA在干旱胁迫下的表达模式Fig.5 Expression patterns of HuActin,HuUBQ,HuUQT and Hu18S rRNA under drought stress treatment.
3 讨论
在追踪基因表达的微小变化时,内参基因被用来作为数据标准化的对照,以校正作为模板的cDNA所存在的数量差异[6]。但是单独使用一个内参基因往往不能得到准确的定量结果,必须几个内参基因结合使用[7]。目前发现的看家基因有几百种,迄今,在火龙果研究中,只有HuUBQ和HuActin两个内参基因被克隆[8]。本研究克隆的UQT基因和18s rRNA基因能有效弥补了火龙果内参基因的不足和丰富了NCBI中火龙果内参基因。
UQT基因和18s rRNA基因是常用的内参基因[9]UQT属于泛素家族基因,广泛存在于真核细胞的热稳定多肽,在进化上显示出高度保守性,在介导细胞内蛋白质降解、转录的调节以及应激反应中发挥重要作用[10];18S rRNA的功能同整个基因谱有关(负责装配)。近来越来越多的研究利用UQT基因和18s rRNA基因作为内标来定量,如Song等研究丹参PAL基因的表达时用到了UQT作为内参[11],18S rRNA被超过90% 的研究单独用作参照基因进行定量[12],魏永赞等在分析荔枝的内参基因克隆及稳定性的研究中,表明UQT基因和18s rRNA基因在表达中有较好的稳定性[13]。
本次研究中克隆了271 bp的UQT基因片段和209 bp的18s rRNA基因片段,UQT基因编码了87个氨基酸。通过序列分析,UQT基因核苷酸序列与蓖麻、马铃薯、大豆同源性达78%以上。18s rRNA基因核苷酸序列与绒毛槐、兔尾草、陆地棉、杜仲同源性达98%以上,且两内参基因在干旱胁迫下和品种间表达较保守,进一步证明了UQT基因编码的是一种高度保守。选择几个内参基因作参照有助于得到更为可靠的表达结果,这在大豆[6]、葡萄[14]、杨树[6]中已被证实,因此本研究克隆的UQT基因和18s rRNA基因为能进一步准确研究抗逆相关基因的表达奠定基础,为研究火龙果的基因表达提供了参照序列和参考依据。
[1]Bustin SA.Quantification of mRNA using real-time reverse transcription PCR(RT-PCR):trends and problems[J].Journal of Molecular Endocrinology,2002,29(1):23-39.
[2]Thellin O,Zorzi W,Lakaye,et al.Housekeeping genes as internal standards use and limis[J].Biotechnol,1999,75:291-295.
[3]尹 静,任春林,詹亚光.可用于实时荧光定量PCR标准化的白桦内参基因[J].植物学生理学通讯,2010,46(10):1 061-1 066.
[4]张冰雪,文晓鹏.EMS对火龙果种子萌发的影响[J].山地农业生物学报,2013,32(3):194-197.
[5]Qing-Jie Fan,Feng-Xia Yan,Xiao-Peng Wen,et al.Identification of differentially-expressed genes potentially implicated in drought responsein pitaya(Hylocereus undatus)by suppression subtractive hybridization and cDNA microarray analysis[J].Gene,2014,533(1):322-331.
[6]Gutierrez L,Mauriat M,Guénin S,et al.The lack of a systematic validation of reference genes:a serious pitpall undervalued in reverse transcription-polymerase chain reaction(RT-PCR)analysis in plants[J].Plant Biotechnol J,2008,6(6):609-618.
[7]Jo Vandesompele,Katleen De Preter,Filip Pattyn,et al.Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J].Genome Biology,2002,3:0034-0034.11.
[8]颜凤霞,文晓鹏,高国丽.火龙果Actin及UBQ内参基因片段的克隆及序列分析[J].贵州农业科学,2013,41(9):1-4.
[9]戴 超,刘雪梅,周 菲.白桦基因表达半定量RT-PCR中内参基因的选择[J].经济林研究,2011,29(1):34-39.
[10]文耕云,董燕麟.Ubiquitin及其功能的研究进展[J].生物化学与生物物理进展,1992,19(2):96-99.
[11]Song Jie,Wang Zhezhi.Molecular cloning,expression and characterization of a phenylal-anine ammonia-lyase gene(SmPAL1)from Salvia miltiorrhiza[J].Mol Biol Rep,2009,36:939-952.
[12]Tricarico C,PPinzani P,Bianchi S,et al.Quant it at ive real-time reverse transcription polymerase chain reaction,normalization to rRNA or single housekeeping genes is inappropriate for human tissue biopsies[J].Anal Biochem,2002,309(2):293-300.
[13]魏永赞,赖 彪,胡福初,等.用于荔枝qPCR分析的内参基因克隆及稳定性分析[J].华南农业大学学报,2012,33(3):301-306.
[14]Reid K E,Olsson N,Schlosser J,et al.An optimized grapevine RNA isolation procedure and statistical determination of reference genes for real-time RTPCR during berry development[J].BMC plant biology,2006,6(1):27.
