调强放射治疗前后食管癌患者肺功能变化
2015-12-02耿旭红梁续飞杨华尹希张利敏郭丽娟
耿旭红,梁续飞,杨华,尹希,张利敏,郭丽娟
(河北医科大学第四医院,石家庄050000)
调强放射治疗(IMRT)是当前治疗食管癌的一种较理想的放疗技术[1],可最大限度地保护正常组织;但是,由于肺是辐射中度敏感器官,放疗可导致患者肺功能改变[2]。因此,我们观察了38例食管癌患者在IMRT前后静态肺功能的变化,探讨IMRT对食管癌患者肺功能的影响。
1 资料与方法
1.1 病例资料 2011年2月~2012年3月在河北医科大学第四医院收治的经病理证实的中、上段食管癌患者38例,男20例,女18例;年龄43~75岁,中位年龄64岁;病灶长4~10 cm,KPS≥70分;临床分期Ⅰ期4例,Ⅱ期14例,Ⅲ期20例;临床和(或)辅助检查无心肺疾病,同期放化疗18例、放疗后化疗20例。
1.2 方法
1.2.1 放疗及疗效评价方法 患者行头、颈、肩或体部热塑膜固定,静脉增强扫描进行CT模拟定位,勾画肿瘤靶区和危及器官;外扩计划靶区(PTV)若包括脊髓组织,则进行适当修改。患者采用同期加量整合技术(SIB),处方剂量总剂量60 Gy/30次,双肺V10≤40%、V20≤30%、V30≤18%。在放疗结束后1个月内行食管钡餐造影,参照疗效标准[3]评价近期疗效;根据RTOG/EORTC放射损伤分级标准[4]将急性放射性肺损伤分为0~Ⅳ级。
1.2.2 肺功能检查方法 采用德国Jaeger公司的Master Screen PFT系列肺功能测定系统,检测时对体温、大气压、饱和水蒸气状态等校正,使用定标器进行高、中、低容量校正。通气功能测定肺活量(VC)、1秒用力呼气量(FEV1)、FEV1实测值/预计值(FEV1%)、1秒率(FEV1/FVC)、最大呼气中段流速(MMEF)、最大通气量(MVV);一口气法测定一氧化碳弥散量(DLCO-SB)、每升肺泡容积的一氧化碳弥散量(DLCO-VA);脉冲震荡法(IOS)检测肺通气阻抗,包括呼吸阻抗(Zrs)、响应频率(Fres)、中心阻力(Rc)、周边阻力(Rp)、总气道阻力(R5)、中心气道阻力(R20)及弹性阻力(X5)。采用欧洲呼吸学会(ERS)的肺功能检测标准评价结果。
1.2.3 统计学方法 采用SPSS13.0统计软件。所得结果以±s表示,采用t检验或方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效及不良反应 本组完全缓解29例,部分缓解7例,无缓解2例,总缓解率达94.7%。急性放射性肺损伤0级28例、1级6例、2级3例、3级1例,2级以上肺急性放射性肺炎发生率10.5%。
2.2 食管癌患者IMRT前后肺功能指标变化 见表1。
3 讨论
放射性肺损伤是一种无菌性炎症,一旦发生即不可逆转[5],发生机制尚无定论。先前认为,电离辐射可引起肺内Ⅱ型肺泡上皮细胞[6]及肺间质毛细血管损伤[7],二者共同作用导致放射性肺损伤发生,但难以解释损伤过程中一系列的动态变化。研究发现,放射性肺损多种细胞参与、多种细胞因子调控的复杂过程[8]。目前,公认的细胞因子学说提出,细胞因子媒介的多细胞因子间的相互作用贯穿放射性肺损伤全过程[9,10]。Calveley 等[11]研究表明,当部分肺组织被照射后,炎症反应早期在全肺被激活,并以循环的方式发展到后期功能症状发生,在照射野和非照射野出现DNA损伤,通过放射启动信号转导,触发了肺的纤维化扳机,启动了成纤维细胞(FB)的增殖分裂,导致胶原蛋白的大量合成,最终形成肺间质的胶原沉积。叶江枫等[12]发现,在电离辐射后早期,放射性肺炎炎症出现,肺间质胶原纤维在局部开始明显增生;Masson染色显示,首先在血管、支气管周围胶原纤维增生,逐渐肺间质胶原纤维增生明显。魏正茂等[13]、刘来昱等[14]研究发现,放射性肺损伤是多种靶细胞在接受照射后发生的综合反应,涉及肺FB、上皮细胞、巨噬细胞等,以渗出性炎症起病,表现为上皮细胞脱落、炎细胞浸润,表面活性物质丢失,最终肺成纤维增生,胶原蛋白大量沉积,导致了肺泡塌陷及肺间质纤维化。
表1 食管癌患者IMRT前后肺功能指标变化(±s)
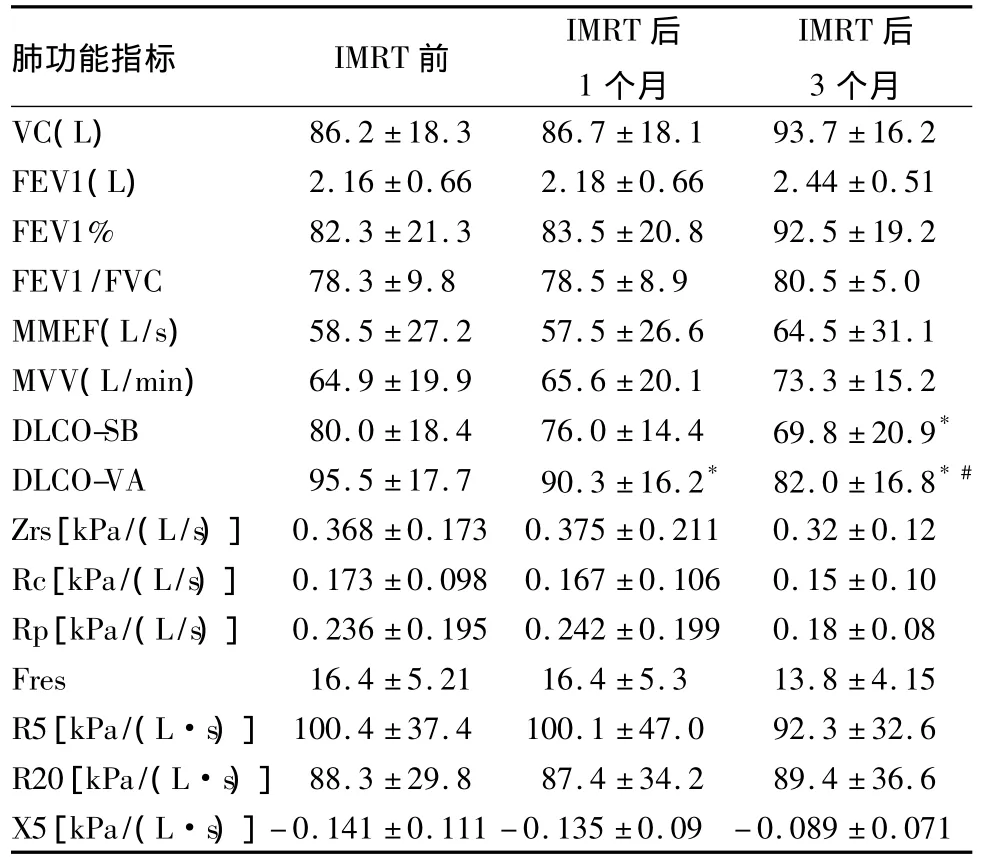
表1 食管癌患者IMRT前后肺功能指标变化(±s)
注:与IMRT前比较,*P<0.05;与 IMRT后1个月比较,#P<0.05。DLCO-SB单位为mmol/(min·kPa),DLCO-VA单位为 mmol/(min·kPa·L)。
肺功能指标 IMRT前 个月VC(L)IMRT后1个月IMRT后3-0.141 ±0.111-0.135 ±0.09 -0.089 ±0.071 86.2 ±18.3 86.7 ±18.1 93.7 ±16.2 FEV1(L) 2.16 ±0.66 2.18 ±0.66 2.44 ±0.51 FEV1% 82.3 ±21.3 83.5 ±20.8 92.5 ±19.2 FEV1/FVC 78.3 ±9.8 78.5 ±8.9 80.5 ±5.0 MMEF(L/s) 58.5 ±27.2 57.5 ±26.6 64.5 ±31.1 MVV(L/min) 64.9 ±19.9 65.6 ±20.1 73.3 ±15.2 DLCO-SB 80.0 ±18.4 76.0 ±14.4 69.8 ±20.9*DLCO-VA 95.5 ±17.7 90.3 ±16.2* 82.0 ±16.8*#Zrs[kPa/(L/s)] 0.368 ±0.173 0.375 ±0.211 0.32 ±0.12 Rc[kPa/(L/s)] 0.173 ±0.098 0.167 ±0.106 0.15 ±0.10 Rp[kPa/(L/s)] 0.236 ±0.195 0.242 ±0.199 0.18 ±0.08 Fres 16.4 ±5.21 16.4 ±5.3 13.8 ±4.15 R5[kPa/(L·s)] 100.4 ±37.4 100.1 ±47.0 92.3 ±32.6 R20[kPa/(L·s)] 88.3 ±29.8 87.4 ±34.2 89.4 ±36.6 X5[kPa/(L·s)]
本研究患者治疗缓解率高,肺通气功能不受显著影响,但是肺弥散功能在放疗后呈逐渐下降趋势,放疗后3个月为最低,DLCO-VA比DLCO-SB下降更明显。DLCO-VA反映静息状态下每分钟吸入气中能达到肺泡进行气体交换的有效通气量,其减低而VC无明显减低反映出食管癌患者在接受IMRT后肺实质无明显改变,而是肺间质改变导致的弥散功能降低;肺泡—毛细血管膜因放射性刺激发生炎症而产生变形,失去正常的结构、功能,导致呼吸膜增厚、弥散距离增大,降低了气体扩散速率;同时,由于肺泡、毛细血管及血管周围炎症,使得有效毛细血管床减少,导致通气血流比例上调,从而使得弥散功能发生障碍。本研究发现,放疗后反映肺通气功能指标值明显升高,可能与肿瘤压迫细支气管导致不同程度的肺不张,而放疗后肿瘤缩小,肺功能又有部分改善,同时肺通气阻力随着支气管压迫的解除也随着减轻有关。研究发现,放疗患者的肺通气阻力的显著降低也符合这一假设,也提示对基础肺功能异常需适当减少放疗剂量。因此,在患者放疗期间应密切注意患者肺功能的动态变化,早期发现异常并及时对症治疗,进一步减轻患者痛苦,提高患者生存质量。
[1]王军,韩春,李晓宁,等.食管癌调强放射治疗初期疗效分析[J].癌症,2009,28(11):1138-1142.
[2]林德荣,叶尚月,朱胜裕.调强放疗同步化疗中晚期食管癌的疗效观察[J].中国癌症杂志,2014,24(2):157-160.
[3]蒋朝阳,李小凯,张伶,等.适形结合调强放疗在胸中段食管癌中对正常组织受量的影响[J].现代肿瘤医学,2014,22(5):1171-1174.
[4]Cox JD,Stetz J,Pajak TF.Toxicity criteria of the Radiation Therapy Oncology Group(RTOG)and the European Organization for Research and Treatment of Cancer(EORTC)[J].Int J Radiat Oncol Biol Phys,1995,31(5):1341-1346.
[5]丁文,郭炎.放射性肺损伤[J].医学影像杂志,2005,15(9):813-816.
[6]Yi ES,Williams ST,Lee H,et al.Keratinocyte growth factor ameliorates radiation and leomycin-induced lung injury and mortality[J].Am J Pathol,1996,149(6):1963-1970.
[7]Abratt RP,Morgan GW.Lung toxicity following ches t irradiation in patients with lung cancer[J].Lung Cancer,2002,35(2):103-109.
[8]高彩霞,乔田奎,张彬,等.中下段食管癌三维适形放疗并发放射性肺损伤的相关因素分析[J].中国临床医学,2014,21(4):433-437.
[9]崔晓利,刘海玲,董秀月,等.转化生长因子B1表达在小鼠放射性肺纤维化形成过程中的作用[J].中华放射肿瘤学杂志,1999,8(1):47-49.
[10]曹京旭,张旭志.细胞因子与放射性肺损伤[J].国外医学:放射医学核医学分册,2001,25(4):181-185.
[11]Calveley VL,Khan MA,Yeung IW,et al.Partial volume rat lung irradiation:temporal fluctuations of in-field and out-of-field DNA damage and inflammatory cytokines following irradiation[J].Int J Radiat Biol,2005,81(12):887-899.
[12]叶江枫,蒙育林,杜志强.肺间质胶原纤维化与放射性肺损伤[J].中国组织工程研究与临床康复,2007,11(6):1063-1066.
[13]魏正茂,窦永起.放射性肺损伤靶细胞间的相互作用[J].临床内科学杂志,2006,11(23):791-792.
[14]刘来昱,丁轶,李启生,等.放射性肺损伤肺成纤维细胞的活化机制研究[J].南方医科大学学报,2010,30(5):1082-1084.
