恩替卡韦治疗家族聚集性慢性乙型肝炎效果观察
2015-12-02王春颖刘成永杨友国王淑侠
王春颖,刘成永,杨友国,王淑侠
(徐州市传染病医院,江苏徐州221004)
慢性乙型肝炎(CHB)具有明显的家族聚集性,国内报道占70%~80%[1]。有研究发现,家族聚集性CHB患者HBV复制活跃,肝组织受损较重,易发生肝硬化及肝癌[2,3]。但由于其病毒和宿主等因素不同于非家族聚集感染者,自然病史、疾病严重程度、抗病毒药物敏感程度等亦不同,都可能对疾病预后产生一定影响[4]。恩替卡韦是目前临床上核苷类抗病毒药物的首选药物之一,能迅速控制病毒复制,且耐药性低、不良反应少,但其对家族聚集性CHB治疗效果的报道较少。2011年7月~2012年6月,我们将恩替卡韦用于家族聚集性CHB的治疗,现分析结果。
1 资料与方法
1.1 临床资料 同期选择我院收治的CHB患者210例,均符合2000年《病毒性肝炎防治方案》中的诊断标准,且具有抗病毒治疗的适应证[5]。排除标准:①不愿或不适合肝穿刺活检者;②应用干扰素等其他抗病毒药物干预者;③合并HIV、HCV、HDV等其他病毒感染者及罹患自身免疫性肝病、药物性肝炎和肝豆状核变性者。其中具有家族聚集感染(连续三代有血缘关系的亲属中,至少出现2例乙型肝炎患者)130例(观察组),无家族聚集感染者80例(对照组)。观察组男85例、女45例,年龄(32.6±15.2)岁;对照组男 54例、女 26例,年龄(34.2±13.6)岁。两组性别、年龄具有可比性。
1.2 治疗方法 两组均口服恩替卡韦0.5 mg,1次/天,连续治疗96周。肝功能明显异常者辅以保肝对症治疗。
1.3 相关指标观察
1.3.1 肝组织炎症活动计分 治疗前及治疗96周,于彩超定位下采用美国巴德活检穿刺针、1秒钟快速穿刺法取肝组织(长度在15 mm以上)。取部分肝组织,10%甲醛固定、石蜡包埋、连续切片后行HE染色、网状纤维染色,采用半定量计分法记录肝组织炎症活动计分,观察肝组织炎症活动度。
1.3.2 血清学指标 治疗前及治疗24、48、96周采集肘静脉血10 mL,3 000 r/min离心10 min,分离血清,-80℃保存。采用西门子ADVIA-1800全自动生化分析仪、酶动力学法检测血清ALT;采用罗氏Elecsys®HBsAgⅡ定量法检测血清 HBsAg;通过PEIU标准品,制作标准曲线,定量检测血清HBeAg;采用HBV DNA定量试剂盒检测HBV DNA。
1.3.3 HBV基因部分变异位点检测 采用基因芯片法,抽取静脉血5 mL,3 000 r/min离心10 min,分离血清,-80℃保存。主要检测前C区1896位点、BCP区1762和1764位点。所有操作严格按照试剂盒说明书进行,质量控制由芯片设计的质量控制位点阴阳性对照的检测所确定。试剂盒由中国科学院微系统与信息研究所提供。
1.3.4 肝组织 HBV cccDNA 取肝组织50 mg,加入核酸提取液B 50 μL充分混匀,用研磨器(棒)充分研磨,100℃裂解10 min,13 000 r/min离心3 min,取上清液4 μL进行PCR反应。用罗氏Light-Cycler定量PCR仪检测,加入阴性样品,阳性定量标准品,循环条件:93℃ 2 min,93℃ 5 s,56℃ 45 s,共40个循环。检测范围为 2.5×103~2.5×109copies/mL。试剂盒购于北京索奥生物技术有限公司。
1.4 统计学方法 采用PEMS3.0统计软件。计量资料以±s表示,经方差齐性检验,方差齐时比较采用t检验,方差不齐时采用t'检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
观察组治疗前肝组织炎症活动计分为(8.25±3.26)分,治疗 96 周为(6.25 ±1.23)分;对照组分别为(7.96 ±2.65)、(4.02 ±1.65)分。两组治疗前肝组织炎症活动计分比较差异无统计学意义(P>0.05),治疗后均低于治疗前(P 均 <0.05),对照组治疗后炎症活动计分更低(P<0.05)。两组治疗前后各实验室指标及病毒变异情况比较见表1、2。
表1 两组治疗前后各实验室指标比较(±s)
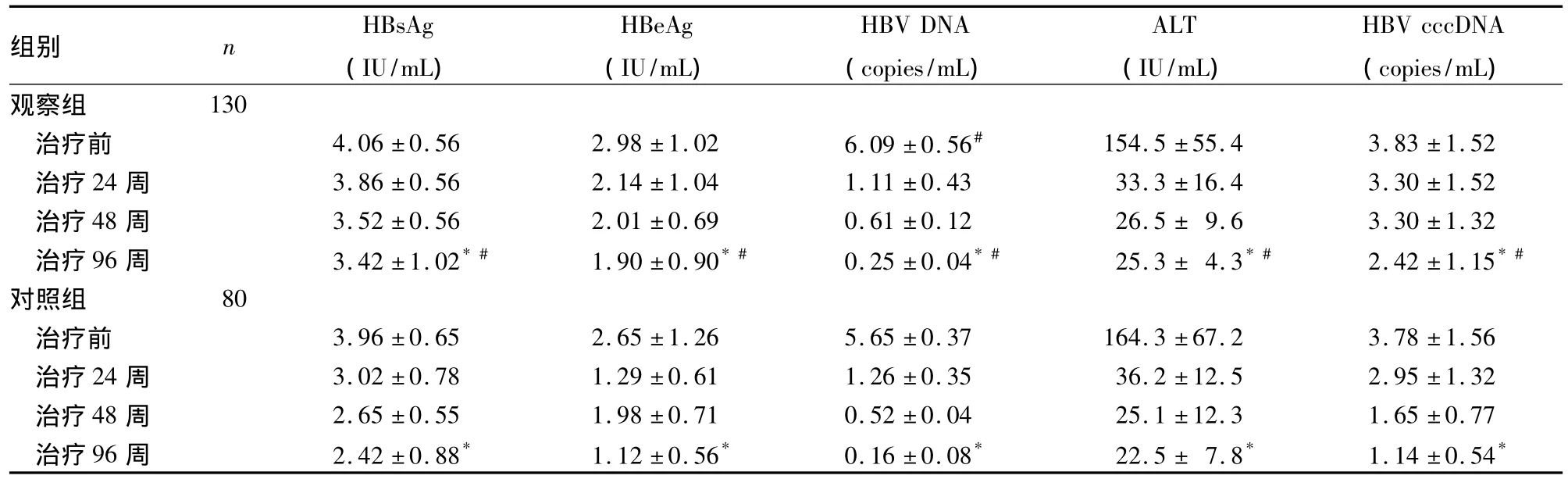
表1 两组治疗前后各实验室指标比较(±s)
注:与同组治疗前比较,*P <0.05;与对照组同期比较,#P <0.05。
组别 n HBsAg(IU/mL)HBeAg(IU/mL)HBV DNA(copies/mL)ALT(IU/mL)HBV cccDNA(copies/mL)观察组130治疗前 4.06 ±0.56 2.98 ±1.02 6.09 ±0.56# 154.5 ±55.4 3.83 ±1.52治疗24 周 3.86 ±0.56 2.14 ±1.04 1.11 ±0.43 33.3 ±16.4 3.30 ±1.52治疗 48 周 3.52 ±0.56 2.01 ±0.69 0.61 ±0.12 26.5 ± 9.6 3.30 ±1.32治疗 96 周 3.42 ±1.02*# 1.90 ±0.90*# 0.25 ±0.04*# 25.3 ± 4.3*# 2.42 ±1.15*#对照组 80治疗前 3.96 ±0.65 2.65 ±1.26 5.65 ±0.37 164.3 ±67.2 3.78 ±1.56治疗24 周 3.02 ±0.78 1.29 ±0.61 1.26 ±0.35 36.2 ±12.5 2.95 ±1.32治疗48 周 2.65 ±0.55 1.98 ±0.71 0.52 ±0.04 25.1 ±12.3 1.65 ±0.77治疗 96 周 2.42 ±0.88* 1.12 ±0.56* 0.16 ±0.08* 22.5 ± 7.8* 1.14 ±0.54*
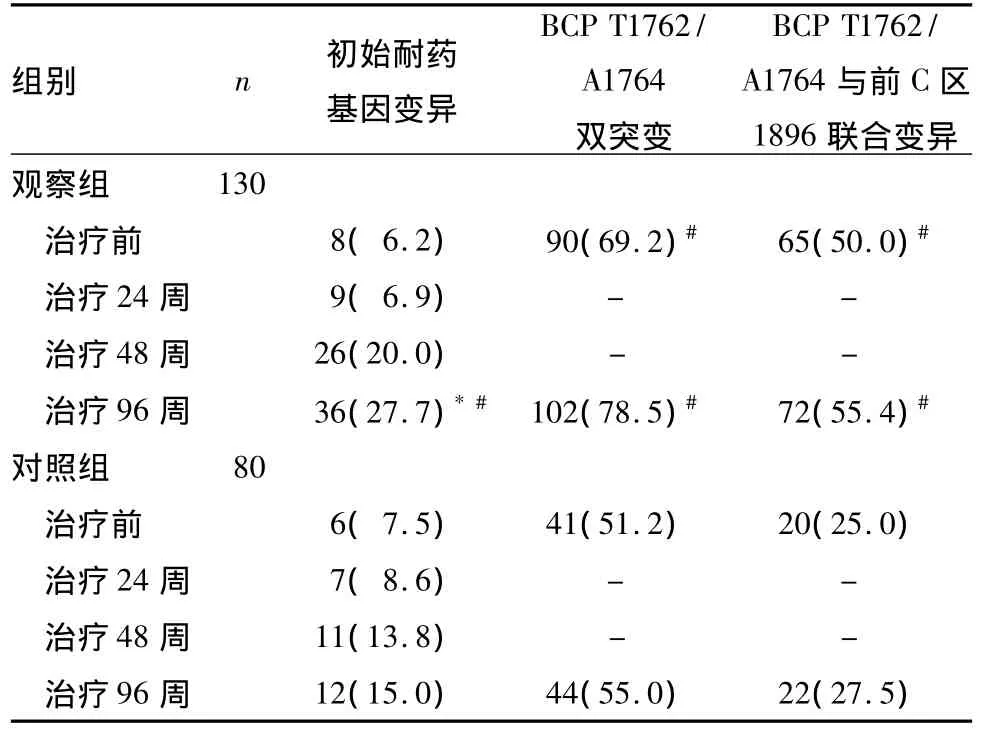
表2 两组治疗前后病毒变异情况比较[例(%)]
3 讨论
家族聚集性CHB具有治疗效果差、预后不佳的特点,表现为对干扰素和核苷类似物治疗效果较差,复发率高,肝组织病理损伤较严重[6],更容易发展为肝癌[7,8]。目前,公认的抗 HBV 药物主要有干扰素类和核苷类似物。干扰素因副作用大,不能用于重度慢性乙型肝炎患者;核苷类药物恩替卡韦以见效快,疗效确切,耐药率低,不良反应少,安全性高,被作为抗病毒治疗的首选药物之一。但其对家族聚集性CHB治疗效果的报道较少。
本研究结果显示,两组治疗后血清 HBsAg、HBeAg、ALT、HBV DNA及肝组织cccDNA均明显降低,且治疗96周对照组降低效果更明显。说明核苷类药物对家族聚集性CHB治疗效果相对较差。两组HBsAg和肝组织HBV cccDNA下降幅度均小于血清HBV DNA,符合抗病毒药物对肝组织内和血清中的HBV DNA清除效果显著,而对肝组织内HBV cccDNA的清除作用较小的规律[9],而HBsAg和肝组织HBV cccDNA相关性高[10],是抗病毒药物应答的更好指标[11]。
前C区变异常可逃避宿主免疫清除,有前C区和(或)BCP变异者则影响抗病毒疗效并使感染持续[12]。故前C区和(或)BCP变异水平是造成核苷类药物疗效不同的重要因素。本研究发现,观察组BCP区T1762/A1764双突变率及其与前C区1896联合突变率均显著高于对照组,说明发生BCP区T1762/A1764双突变后HBV复制能力加强,毒力增加[13],HBeAg表达降低,因为 HBeAg和 HBcAg具有共同的表位,在体内HBcAg较HBeAg可诱发更为强烈的抗体反应,从而加重损伤[14],其肝组织病理炎症活动计分高于对照组,更容易发展为肝硬化、肝癌,对干扰素和核苷类似物治疗效果较差,复发率高。
本研究两组抗病毒治疗前初始耐药基因变异率比较差异无统计学意义,但治疗96周观察组耐药基因变异率显著高于对照组。说明即使抗病毒药物的治疗剂量相同,但由于家族聚集感染者病毒因素,如前C区和(或)BCP变异等导致复制增强并逃避宿主免疫,病毒与抗病毒药物和宿主之间的抗争过程中逆转录酶自身突变的可能性增大,因此产生耐药的概率也会增加[15~17]。
综上所述,家族聚集性CHB疾病严重程度、耐药基因变异率较高,恩替卡韦对其治疗效果相对较差。
[1]庄辉.慢性乙型肝炎病毒感染及其防治[J].中华肝脏病杂志,2005,13(5):324-325.
[2]顾生旺.652例乙型肝炎患者家族聚集性研究[J].肝脏,2009,14(2):103-104.
[3]邵风珍,施伯安,刘文全,等.天津地区家族聚集性慢性乙型肝炎病毒感染者病毒载量及组织病变与基因型的关系[J].中华肝脏病杂志,2007,15(1):16-18.
[4]杨友国,刘成永,王春颖,等.家族聚集性慢性乙型肝炎的病毒前C区和基本核心启动子变异与临床病理的关系[J].世界华人消化杂志,2008,16(26):2997-3000.
[5]李兰娟,刘克洲.《慢性乙型肝炎防治指南(2010年版)》解读[J].中华临床感染病杂志,2011,4(1):14-15.
[6]牛春红,田新强,米亚英.山西地区家族聚集性慢性乙型肝炎病毒感染者病毒载量及组织病变与基因型的关系[J].中国现代医药杂志,2009,11(7):23-25.
[7]Sheng Y,Huang TR,Zhang ZQ,et al.Study on the relationship between familial clustering of hepatocellular carcinoma and polymorphism of cytochrome P450 2El gene in Zhuang population,Guangxi[J].Zhonghua Liu Xing Bing Xue Za Zhi,2009,30(2):151-155.
[8]庞裕,李国坚,吴继周,等.P53抗体与广西肝癌家族聚集性的相关性研究[J].中华医学遗传学杂志,2012,29(2):206-209.
[9] Levrero M,Pollicino T,Petersen J,et al.Control of cccDNA function in hepatitis B virus infection[J].J Hepatol,2009,51(3):581-592.
[10]钮志林,朱翔,沈伟强,等.干扰素对慢性乙型肝炎患者肝细胞内 HBV cccDNA、血清 HBsAg、HBV-DNA 的影响研究[J].中华医院感染学杂志,2014,24(4):792-795.
[11]Wang M,Qiu N,Lu S,et al.Serum hepatitis B surface antigen is correlated with intrahepatic total HBV DNA and cccDNA in treatment-naive patients with chronic hepatitis B but not in patients with HBV related hepatocellular carcinoma[J].J Med Virol,2013,85(2):219-227.
[12]Sonneveld MJ,Rijckborst V,Zeuzem S,et al.Presence of precore and core promoter mutants limits the probability of response to peginterferon in hepatitis B eantigen-positive chronic hepatitis B[J].Hepatology,2012,56(1):67-75.
[13]Liu CJ,Chen BF,Chen PJ,et al.Role of hepatitis B virus precore/core promoter mutations and semm Viral load on norlcirrhotic hepatocellular carcinoma:a casecontrol study[J].J Infect Dis,2006,194(5):594-599.
[14]刘成永,高玉金,侯远沛,等.乙型肝炎病毒家族聚集性感染者的基因型和基因变异特征分析[J].世界华人消化杂志,2006,14(18):1833-1835.
[15]马鹏.T细胞亚群及炎性因子对乙型病毒肝炎的诊断价值及相关性分析[J].现代仪器与医疗,2015,21(50):34-37.
[16]Tan Y,Ding K,Su J,et al.The naturally occurring YMDD mutation among patients chronieally infected HBV and untreated with lamivudine:a systematic review and meta-analysis[J].PLos One,2012,7(3):e32789.
[17]Kobayashi S,Ide T,Sata M.Detection of YMDD motif mutations in some lamivudine-untreated asymptomatic hepatitis B virus carriers[J].J Hepatol,2001,34(4):584-586.
