同型半胱氨酸对大鼠血管平滑肌细胞增殖、迁移能力的影响及其可能机制
2015-12-02鲍晓梅郑宏超
鲍晓梅,郑宏超
(上海市徐汇区中心医院,上海200031)
目前认为,动脉粥样硬化的发生、发展与血管内皮细胞损伤和血管平滑肌细胞(SMCs)增殖和迁移有关。我们既往研究证实,Hcy可通过p38MAPK(分裂原激活的蛋白激酶)途径激活NADPH氧化酶,增加活性氧(ROS)的产生,诱导内皮细胞凋亡,促进动脉粥样硬化形成[1,2]。有研究发现,Hcy引起的氧化应激反应不仅不能诱导SMCs凋亡,反而会促进其增殖和迁移[3~6],但其具体作用机制尚不明确。2014年10~12月,我们观察了Hcy对大鼠血管SMCs增殖和迁移的影响,现分析结果,探讨其可能的作用机制。
1 材料与方法
1.1 材料 健康雄性SD大鼠,8周龄,体质量(281±22)g,购自中国科学院上海生命科学研究院动物中心[许可证号:SCXK(沪)2012-0002]。Hcy、p38 MAPK抑制剂SB203580、四唑盐(MTT)、NADPH氧化酶抑制剂(DPI)及光泽精,美国Sigma公司;乙酰乙酸二氯荧光黄(DFC-DA)、N-乙酞半胱氨酸(NAC),德国 Calbiochem公司;DMEM 培养液、0.25%胰蛋白酶、FBS,美国 GIBCO公司。FACS Calibur流式细胞仪,美国BD公司;Berthold LB960化学发光检测仪,德国伯托公司。
1.2 大鼠血管SMCs分离、培养 常规处死SD大鼠,剖胸取出胸主动脉。分离血管周围组织,纵向剖开血管,分离中膜。将中膜剪成1 mm×1 mm×1 mm组织块,置入含20%FBS的DMEM培养液,37℃ 5%CO2培养箱培养9~10天。当细胞融合达80%时,用0.25%胰蛋白酶消化、传代。
1.3 Hcy最佳浓度确定 取传3~6代的SMCs接种于96 孔板,分别予 0、50、100、200 μmol/L Hcy 处理24 h,检测不同浓度Hcy对细胞增殖、迁移、活性氧、NADPH氧化酶活性的影响(方法见1.4),以对上述指标影响最明显的浓度为最佳浓度。结果见表1。由表1可见,Hcy呈剂量依赖性诱导SMCs增殖和迁移及ROS产生,激活NADPH氧化酶。本研究确定200 μmol/L为 Hcy最佳浓度,并用于以下研究。
1.4 细胞干预及相关指标观察
1.4.1 细胞增殖能力 采用MTT比色法。将培养细胞随机分为五组,对照组不处理;Hcy组加入200 μmol/L的 Hcy;NAC+Hcy组、DPI+Hcy组、SB203580+Hcy组先分别加入1mmol/L的NAC、10 μmom/L 的 DPI、10 μmol/L 的 SB203580 干预0.5 h,再分别加入 200 μmol/L 的 Hcy;各组均干预24 h。分别加入5 g/L MTT 10 μL继续培养4 h。吸出孔内培养液,加入二甲亚砜100 μL/孔,将培养板置于微孔板振荡器上振荡10 min,使结晶物溶解后,用酶标仪检测各孔570 nm处光密度值(OD值)。
表1 不同浓度Hcy对SMCs增殖、迁移能力及ROS生成、NADPH氧化酶活性的影响(±s)
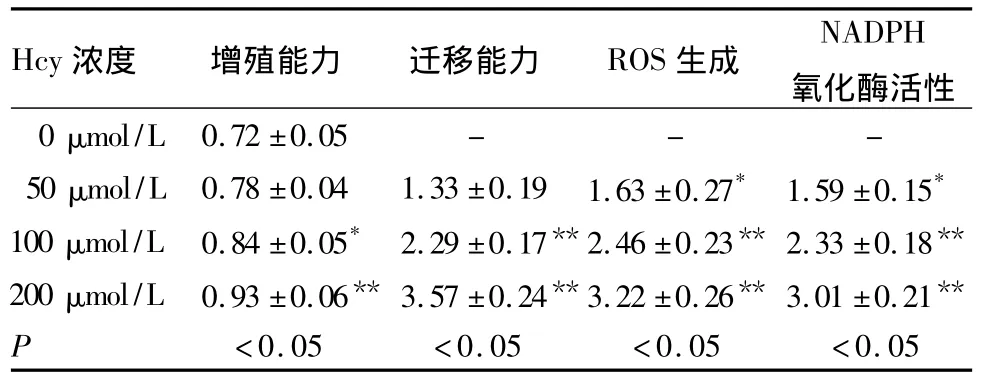
表1 不同浓度Hcy对SMCs增殖、迁移能力及ROS生成、NADPH氧化酶活性的影响(±s)
注:与0 μmol/L 比较,*P <0.05,**P <0.01。
Hcy浓度 增殖能力 迁移能力 ROS生成NADPH mol/L 0.72 ±0.05 - - -50 μmol/L 0.78 ±0.04 1.33 ±0.19 1.63 ±0.27* 1.59 ±0.15*100 μmol/L 0.84 ±0.05* 2.29 ±0.17**2.46 ±0.23** 2.33 ±0.18**200 μmol/L 0.93 ±0.06** 3.57 ±0.24**3.22 ±0.26** 3.01 ±0.21**P氧化酶活性0 μ<0.05 <0.05 <0.05 <0.05
1.4.2 细胞迁移能力 采用Transwell小室法。细胞按1.4.1分组及处理。孵育24 h后,从37℃孵箱中取出Transwell,将上室取出,用棉签轻轻搽拭上室内侧壁,磷酸盐缓冲液清洗,冰乙醇固定,苏木素、伊红染色,显微镜下细胞计数,随机选取5个视野(200倍),取其平均数。将对照组的迁移能力设为1,其他各组细胞迁移能力为与对照组的比值。
1.4.3 细胞内ROS 采用荧光探针H2DCF-DA法。细胞按1.4.1分组及处理。孵育24 h后,冰PBS洗3次,加入10 μmol/L H2DCF-DA 避光反应30 min,PBS洗3次。0.25%胰酶消化后,流式细胞仪观察各组平均荧光强度。将对照组的荧光值定为1,其他各组细胞的荧光值为与对照组的比值。
1.4.4 NADPH氧化酶活性 采用光泽精化学发光法。细胞按1.4.1分组及处理。孵育24 h后加入含蛋白酶抑制剂的冰缓冲液,裂解细胞。以Bradford方法检测蛋白浓度(调整浓度至1 mg/mL)。取100 μL 样品,加入光泽精(5 μmol/L)、NADPH(100 μmol/L),于化学发光计数器上计数。将对照组的NADPH氧化酶活性设为1,其他各组NADPH氧化酶活性为与对照组的比值。
1.5 统计学方法 采用SPSS13.0统计软件。计量资料以±s表示,组间比较采用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
NAC+Hcy组、DPI+Hcy组、SB203580+Hcy组细胞增殖及迁移能力、ROS生成、NADPH氧化酶活性均低于 Hcy组(P <0.05或 <0.01),见表2。
3 讨论
高同型半胱氨酸血症是心血管疾病的独立危险因素,Hcy可损伤血管内皮细胞,促进血管壁细胞合成分泌黏附分子和趋化因子,诱导中膜SMCs向内膜下迁移和增殖,是动脉硬化的始动环节[4]。Hcy在血浆中可以自身氧化或通过二硫键硫化,生成同型胱氨酸和同型半胱氨酸硫内酯,同时激活黄嘌呤氧化酶等氧化酶系统,诱导血管壁细胞产生超氧化物阴离子等ROS并抑制谷胱甘肽过氧化物酶等抗氧化酶活性,最终诱导氧化应激损伤,动脉粥样硬化形成[6]。研究发现,ROS作为第二信使参与细胞信号转导,调控内皮细胞及内皮祖细胞的增殖和凋亡[1,2]。本研究发现,不同浓度 Hcy呈剂量依赖性诱导SMCs增殖、迁移,并伴随细胞内ROS水平进行性升高,给予氧自由基清除剂NAC和NADPH氧化酶抑制剂DPI预处理,在减少ROS生成的同时可明显抑制SMCs增殖和迁移,提示Hcy诱导SMCs增殖、迁移作用也有氧化应激机制参与。
表2 各组SMCs增殖、迁移能力及NOS生成、NADPH氧化酶活性比较(±s)
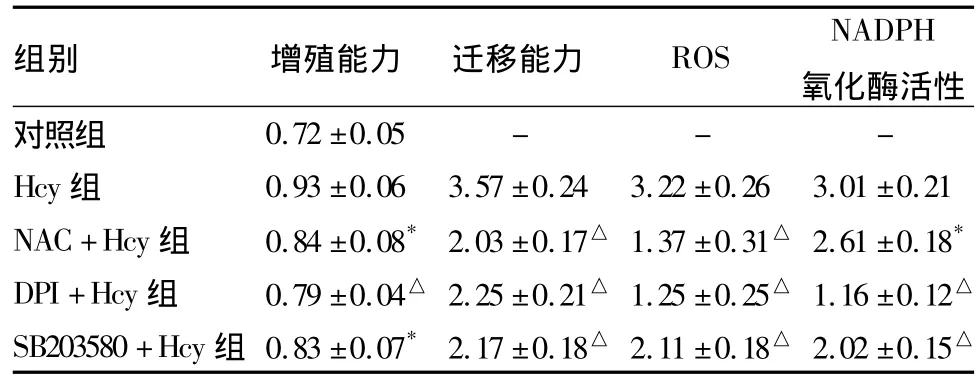
表2 各组SMCs增殖、迁移能力及NOS生成、NADPH氧化酶活性比较(±s)
注:与 Hcy组比较,*P <0.05,△P <0.01。
组别 增殖能力 迁移能力 ROS NADPH氧化酶活性对照组0.72 ±0.05 - - -Hcy 组 0.93 ±0.06 3.57 ±0.24 3.22 ±0.26 3.01 ±0.21 NAC+Hcy组 0.84 ±0.08* 2.03 ±0.17△ 1.37 ±0.31△ 2.61 ±0.18*DPI+Hcy组 0.79 ±0.04△ 2.25 ±0.21△ 1.25 ±0.25△ 1.16 ±0.12△SB203580+Hcy组 0.83 ±0.07*2.17 ±0.18△ 2.11 ±0.18△ 2.02 ±0.15△
作为血管壁ROS的主要来源,NADPH氧化酶的活性受许多外源性或内源性刺激因子的调节。NADPH氧化酶来源的ROS参与了碱性成纤维细胞生长因子、血管紧张素Ⅱ、IL-18和单核细胞趋化蛋白-1诱导的 SMCs迁移[7~11]。有研究发现,采用siRNA技术干扰Nox1基因表达的SMCs,经碱性成纤维细胞生长因子诱导产生的活性氧水平明显降低,迁移活性明显下降,转染Nox1后SMCs的迁移活性可恢复正常。进一步研究发现,来源于Nox1 y/-小鼠的SMCs细胞迁移能力较来源于Nox1 y/+小鼠的SMCs细胞迁移能力明显下降[7]。上述研究均证实,NADPH氧化酶是平滑肌细胞迁移过程中的一个重要环节。有研究还发现,NADPH氧化酶亦参与SMCs增殖过程[8]。因此,抗氧化剂可能通过降低NADPH氧化酶的活性进而降低SMCs的增殖迁移能力。本研究发现,不同浓度Hcy诱导后,SMCs的NADPH氧化酶活性呈剂量依赖性逐渐上升,与ROS的生成相一致。DPI是NADPH氧化酶特异性抑制剂,可与NADPH氧化酶的核黄素结合,从而抑制电子的传递,阻断ROS生成途径。用DPI预孵育0.5 h可基本抑制NADPH氧化酶活性,使ROS生成下降,并明显减少200 μmol/L Hcy诱导的SMCs的增殖和迁移。提示Hcy诱导的SMCs ROS的产生主要来源于NADPH氧化酶。
ROS主要通过激活MAPK家族及其下游转录因子(如NF-κB)产生氧化应激反应。本研究发现,p38 MAPK阻断剂SB203580预孵育0.5 h,再与200 μmol/L Hcy共孵育 24 h,可明显减少 200 μmol/L Hcy诱导的SMCs增殖和迁移,提示MAPK信号途径参与了Hcy介导的SMCs增殖和迁移能力的调节。MAPK属丝氨酸/苏氨酸激酶(Ser/Thr),其家族成员包括 ERK1/2、P38 MAPK、JNK。其中 p38 MAPK可以被细胞外应激源(紫外线、缺氧、血管紧张素Ⅱ、内皮素)等激活,广泛参与细胞增殖、迁移和炎症反应等过程,被认为是细胞外信号引起细胞增殖反应的细胞内信号传递的共同通路或汇聚点。在ERK和JNK途径中,ROS刺激使细胞内Raf-1明显升高[12],Raf-1被激活后依次激活MAP的上游激酶MAK1和MAK3,催化ERK和JNK激酶的酪氨酸和Ser/Thr同时磷酸化,最终通过对转录调节因子表达的影响将细胞增殖信号传递到细胞核内。有研究证实,ROS 增多能增加 p38MAPK 磷酸化[13,14],而siRNANox能抑制 p38 MAPK 磷酸化[15];Nox4 的细胞核定位提示细胞核内源性ROS的生成可直接干预基因表达并激活丝/苏氨酸蛋白激酶[16];氧化应激可使p38 MAPK激活,继而调节下游各种激酶活性,如激活丝裂原应激激酶1和环磷酸腺苷反应结合蛋白转录因子,最终导致基因表达的改变,影响细胞的增殖和迁移[13~15]。
综上所述,Hcy对SMCs增殖和迁移活性具有促进作用,其机制可能与激活NADPH氧化酶、增加ROS生成、活化p38 MAPK信号途径有关。
[1]Bao XM,Wu CF,Lu GP.Atorvastatin attenuates homocysteine-induced apoptosis in human umbilical vein endothelial cells via inhibiting NADPH oxidase-related oxidative stress-triggered p38MAPK signaling[J].Acta Pharmacol Sin,2009,30(10):1392-1398.
[2]Bao XM,Wu CF,Lu GP.Atorvastatin inhibits homocysteine-induced oxidative stress and apoptosis in endothelial progenitor cells involving Nox4 and p38MAPK[J].Atherosclerosis,2010,210(1):114-121.
[3]Rasmussen LM,Hansen PR,Ledet T.Homocysteine and the production of collagens,proliferation and apoptosis in human arterial smooth muscle cells[J].APMIS,2004,112(9):598-604.
[4]Guthikonda S,Haynes WG.Homocysteine:role and implications in atherosclerosis[J].Curr Atheroscler Rep,2006,8(2):100-106.
[5]Shi YF,Chi JF,Tang WL,et al.Effects of rosuvastatin on the production and activation of matrix metalloproteinase-2 and migration of cultured rat vascular smooth muscle cells induced by homocysteine[J].J Zhejiang Univ Sci B,2013,14(8):696-704.
[6]Papatheodorou L,Weiss N.Vascular oxidant stress and inflammation in hyperhomocysteinemia[J].Antioxid Redox Signal,2007,9(11):1941-1958.
[7]Schröder K,Helmcke I,Palfi K,et al.Nox1 mediates basic fibroblast growth factor-induced migration of vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2007,27(8):1736-1743.
[8]Valente AJ,Yoshida T,Murthy SN,et al.Angiotensin Ⅱ enhances AT1-Nox1 binding and stimulates arterial smooth muscle cell migration and proliferation through AT1,Nox1,and interleukin-18[J].Am J Physiol Heart Circ Physiol,2012,303(3):H282-H296.
[9]Bruder-Nascimento T,Chinnasamy P,Riascos-Bernal DF,et al.AngiotensinⅡinduces Fat1 expression/activation and vascular smooth muscle cell migration via Nox1-dependent reactive oxygen species generation[J].J Mol Cell Cardiol,2014,(66):18-26.
[10] Valente AJ,Yoshida T,Izadpanah R,et al.Interleukin-18 enhances IL-18R/Nox1 binding,and mediates TRAF3IP2-dependent smooth muscle cell migration.Inhibition by simvastatin[J].Cell Signal,2013,25(6):1447-1456.
[11]Lo IC,Shih JM,Jiang MJ.Reactive oxygen species and ERK 1/2 mediate monocyte chemotactic protein-1-stimulated smooth muscle cell migration[J].J Biomed Sci,2005,12(2):377-388.
[12]Yu C,Rahmani M,Almenara J,et al.Induction of apoptosis in human leukemia cells by the tyrosine kinase inhibitor adaphostin proceeds through aRAF-1/MEK/ERK-and AKT-dependent process[J].Oncogene,2004,23(7):1364-1376.
[13]Zou T,Yang W,Hou Z et al.Homocysteine enhances cell proliferation in vascular smooth muscle cells:role of p38 MAPK and p47phox[J].Acta Biochim Biophys Sin(Shanghai),2010,42(12):908-915.
[14]El-Remessy AB,Tang Y,Zhu G,et al.Neuroprotective effects of cannabidiol in endotoxin-induced uveitis:critical role of p38 MAPK activation[J].Mol Vis,2008,(14):2190-2203.
[15]Abid MR,Spokes KC,Shih SC,et al.NADPH oxidase activity selectively modulates vascular endothelial growth factor signaling pathways[J].J Biol Chem,2007,282(48):35373-35385.
[16]Kuroda J,Nakagawa K,Yamasaki T,et al.The superoxide-producing NAD(P)H oxidase Nox4 in the nucleus of human vascular endothelial cells[J].Genes Cells,2005,10(12):1139-1151.
